在4 ℃降温平衡过程中0.2g/L咖啡因与精子共孵育时间对猪颗粒冻精质量的影响
郭雅欣 ,张学炜 ,郑 梓 ,李 宁 ,陈 亮 ,穆淑琴 ,李千军 ,崔茂盛 *
(1.天津农学院,天津 300380;2.天津市畜牧兽医研究所,天津 300384;3. 中国农业科学院北京畜牧兽医研究所,北京 100094)
1 引言
随着猪场集约化、规模化发展,猪冷冻精液在长期保存、长途运输和跨区域品种改良以及区域或全国范围内种猪联合育种等方面具有独特的技术优势和重要的现实意义。尤其在目前非洲猪瘟防控压力下,通过猪精液质量监控和冷冻精液无菌化操作,利用冻精输精可大大降低由于种公猪引进而带来的疾病传播风险,有力促进种猪种质资源的交流[1]。
目前猪精液冷冻形式主要有颗粒法和细管法两种,这两种方法各有优势。细管法冷冻效果较好,在保存和运输中可有效避免冻精之间的交叉感染,且已在国内外部分种猪场开展生产应用,取得了较好的应用效果[2],但细管法需要昂贵的仪器设备和专业的人才培训,限制了猪场内冻精生产和应用。颗粒法制作冻精不需要高昂的设备与系统的人员培训,相对来说更易应用推广,但颗粒冻精的质量相对较低[3]。为提高猪精子冷冻效果,前人已在优化猪精子冷冻液成分,如酸碱缓冲体系、能量物质、保护剂等方面做了大量研究与探讨。在稀释液中添加红景天和糖褐藻胶等物质,可提升精子活率、线粒体完整率和顶体完整率[4],在精液冷冻保存中加入丹参酮IIA、灵芝多糖、芦丁[5]、褪黑素[6]、L-半胱氨酸[7]等物质可减少精子氧化损伤,提升冻精质量等。咖啡因是从可可树、茶叶、咖啡豆等植物中提炼出来的一种生物碱,具有刺激精子活动、提高精子活力和解冻后顶体完整率等作用[8]。前人虽然在猪精液细管冷冻过程中添加不同浓度咖啡因[9],以及颗粒冻精解冻液中添加咖啡因[10]等试验进行了多方面研究,探讨了咖啡因对冷冻精子质量的影响。谷合勇等人研究指出冷冻液中0.2 mg/mL的咖啡因添加量,可显著提高猪细管冻精解冻后精子活力、质膜完整率与顶体完整率等[11]。但在猪颗粒冻精制作过程中,咖啡因与精液共孵育时间长短对冻精质量有何影响,尚未见相关报道。在团队前期工作基础上,探讨0.2 g/L咖啡因与精液共孵育2 h、1 h和0.5 h对猪颗粒冻精质量的影响,以期进一步提高猪精液颗粒冷冻效果。
2 材料与方法
2.1 猪精液采集
使用手握法采集某猪场大白公猪精液,收集中段精子密度较高的部分。选择颜色乳白、无恶臭、密度在1.5亿个/mL以上、精子活率在85%以上、精子畸形率低于5%的原精,用等温BTS液按1∶1对原精稀释后,置于37 ℃保温瓶中0.5 h内带回到实验室。
2.2 主要试剂设备
主要试剂:半胱氨酸、葡萄糖、青霉素、链霉素、碳酸氢钠、EDTA等;主要仪器设备:17 ℃恒温箱、4 ℃冰箱、离心机、电热恒温水槽、电子天平等。
2.2.1 冷冻稀释液配制
冷冻Ⅰ液配制:柠檬酸1.25 g,葡萄糖1.18 g,Tris 2.428 g,乳糖20 g,半胱氨酸0.02 g,加蒸馏水至100 mL,调pH至6.21。加入体积百分比为20%的新鲜鸡蛋卵黄,最后加入青霉素0.6 g/L和链霉素1 g/L经磁力搅拌器充分搅拌均匀;冷冻Ⅱ液配制:在I液基础上加入体积百分比为9%的甘油。
2.2.2 精液的稀释与平衡
将带回的精液在室温下静置0.5 h,平均分装于50 mL 康宁(Corning)离心管中,以2 000 r/min离心6 min,弃上清液后按1∶1等温缓慢加入冷冻稀释Ⅰ液并轻轻摇匀,然后在17 ℃恒温箱中平衡1 h,转入4 ℃冰箱中继续平衡2 h。分别在4 ℃平衡的0、1和1.5 h组离心管内添加0.2 g/L的咖啡因。4 ℃平衡结束后在等温条件下按2∶1体积比与冷冻Ⅱ液混合均匀,再平衡15 min开始滴冻。
2.2.3 猪精液颗粒冻精制作
实验利用长和宽稍大于氟板、深度约7 cm的泡沫箱作为冷冻槽。实验前在泡沫箱内倒入1/3体积的液氮,将氟板沉入液氮内充分浸泡后放在特制的冷冻架上,并调整冷冻架与液氮面的距离,使氟板温度在- 120~- 110 ℃之间,盖上泡沫盒盖平衡2 min后开始滴冻。滴冻时用预冷的根据氟板量身定制的多重排枪(已授权实用新型专利,2013年),可一次性完成30粒滴冻,每批滴冻颗粒90粒,总滴冻时间控制在30 s以内。滴冻后迅速盖上槽盖平衡6 min,然后将氟板快速沉入冷冻槽内的液氮中,再盖上盖子平衡5 min以上,随机取出3粒冻精进行解冻、质量检查。
2.2.4 颗粒冻精解冻
实验采用湿解法,解冻液为含有0.1%半胱氨酸和0.05%肌醇的BTS液,解冻温度为45 ℃。解冻时随机取出1粒冻精在空中晃动3~5 s,然后快速放入含有0.5 mL的已充分预热的解冻液的圆底玻璃试管中,在45 ℃水浴锅内快速摇动试管,待冻精颗粒溶解致2/3时迅速将试管离开水浴锅,借助余热使冻精颗粒完全融化。解冻结束后在室温下平衡5 min,开始冻精质量检测检。检测指标为精子活率、活力、质膜完整性和顶体完整性及室温下精子存活时间等指标。
2.2.5 冻精质量评价方法
1)精子活率
伊红-苯胺黑联合染色法判断精子活性,死精子质膜通透性增大,染料进入膜内染色,呈红色;而该染料透不过活精子膜,因此活精子不着色。实验中,在体式显微镜100倍视野下计数200个精子,计算未着色(活精子)占200个精子的百分率,即为活率。
2)精子活力
在体式显微镜100倍视野下计数精液中直线前进运动精子数占总精子数的百分比,即为活力。
3)质膜完整性
采用低渗肿胀实验(HOST)法进行精子质膜完整性的检测。质膜完整的精子尾巴因为低渗肿胀而呈现出较大弯曲,而质膜破裂的精子,不会出现低渗肿胀现象,其尾巴不弯曲或稍微弯曲。
4)顶体完整性
对精子顶体完整性采用金霉素(CTC)荧光染色法进行检测。在实验中,精子经过CTC荧光染色后精子整个头部呈现均一荧光,为顶体完整的精子;整个精子头部无荧光或非常弱的荧光,为顶体不完整的精子。
2.3 实验设计
精液在4 ℃冰箱中平衡2 h的过程中,分别设计在开始平衡的0 h、1 h和1.5 h三个时间点向冷冻稀释液中添加0.2 g/L咖啡因,则咖啡因与精液共孵育时间分别为2 h、1 h和0.5 h,实验中设定无咖啡因添加组为对照组。通过检测冷冻前后精子活率、活力、质膜完整性和顶体完整性以及解冻后精子体外存活时间等指标。探讨在4 ℃平衡过程中咖啡因与精液不同共孵育时间对冷冻前后精子质量的影响。
2.4 数据处理
实验数据使用Microsoft Excel进行初步整理,再利用SPSS 20.0对试验数据进行差异显著性统计分析。采用单因素方差分析、利用LSD法进行多重比较。数据均使用“平均值±标准误(Mean±SE)”的形式进行表示。P<0.05表示差异显著,反之则表示差异不显著。
3 结果与分析
3.1 咖啡因不同平衡时间对冷冻前精子质量的影响
由表1可知,咖啡因与精液不同共孵育时间组活率和活力都呈现出升高趋势,但相较对照组差异不显著;但在顶体完整率和质膜完整率上,对照组分别为 (83.03 ±0.20与 84.32 ±0.21),显著高于共孵育2 h、1 h和0.5 h组,后3组之间差异均不显著。精子质膜完整性、顶体完整性和活率等染色图片分别如图1、图2和图3所示。
3.2 咖啡因不同平衡时间对冷冻解冻后精子质量的影响
由表2可看出,精液和咖啡因共孵育组颗粒冻精,解冻后精子活率和活力均显著高于对照组,其中共孵育1 h组显著高于其他3组(P<0.05),共孵育2 h组和0.5 h组间差异不显著(P>0.05);在顶体完整率和质膜完整率上,共孵育2 h组显著低于对照组和共孵育0.5 h、1 h组(P< 0.05),但后 3组精子顶体完整率和质膜完整率差异均不显著;对解冻后精子体外存活时间而言,咖啡因与精子共孵育2 h组精子存活时间显著低于对照组、共孵育1 h和0.5 h组(P<0.05),虽然共孵育1 h组精子存活时间最长,但相对于共孵育0.5 h组和对照组差异不显著(P>0.05)。
4 讨论
在精液冷冻前,0.2 g/L的咖啡因与精液共孵育并没有显著提高精子的活率和活力。这可能与原精质量本身较好相关,在实验中,原精活率和活力检测结果分别在0.85和0.9以上。实际上,研究结果显示0.2 g/L咖啡因不同共孵育时间,均有提高精子活率和活力的趋势,但没有统计学上的差异。在检测精子质膜完整性和顶体完整性时发现,对照组的质膜完整率和顶体完整率,显著高于平衡2 h、1 h和0.5 h组,后3组之间差异均不显著。研究推测,这可能和咖啡因添加组精子活率和活力升高有关。据研究表明,咖啡因具有刺激精子神经中枢的作用,在增加精子的运动剧烈程度的同时[12],精子内线粒体活性也进一步活化,产生更多的ATP给精子提供能量[13],而较强且持续的能量代谢导致精子产生过量的活性氧[14],对精子细胞器和质膜造成伤害,另外较高咖啡因物质的摄入,还会增加精子膜的通透性,从而在提高质膜内外物质交换的同时,可能会降低质膜的完整率和顶体完整性。然而此次研究结果又表明,平衡2 h、1 h和0.5 h组精子质膜完整性和顶体完整性之间差异并不显著,此研究结果与2 h、1 h和0.5 h 这3组之间精子活率和活力差异不显著的结果一致。

表1 咖啡因不同平衡时间对冷冻前猪精子质量的影响 %
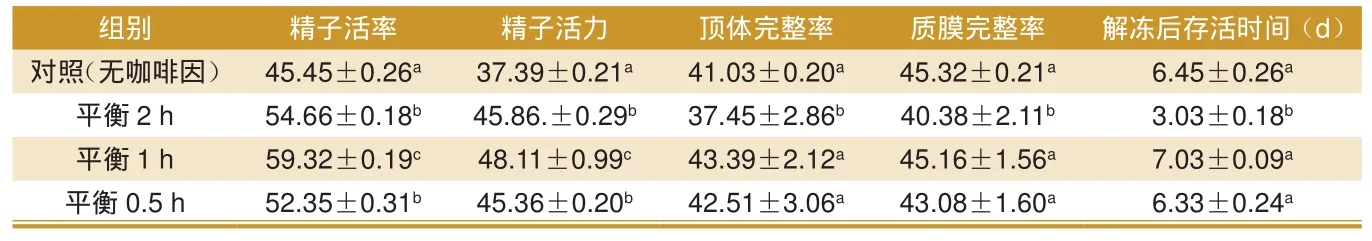
表2 颗粒冻精解冻后精子质量检测 %
猪颗粒冻精解冻后的精子质量检测结果表明,0.2 mg/mL咖啡因共孵育的3组中精子活率和活力均显著高于对照组,该结果与金穗华[15]、黄全成[16]、Pariz[13]等人的研究结果一致;同时此次实验进一步表明,在4 ℃条件下0.2 mg/mL咖啡因与精液共孵育1 h组精子活率和活力显著高于共孵育2 h和0.5 h组(P<0.05)。有研究表明,虽然咖啡因能够提高冷冻后精子活率和质膜完整性[17],但长时间的咖啡因刺激,不仅会导致解冻后精子活率、活力的降低,而且还会因活性氧的产生对精子质膜造成伤害[14]。从此次实验结果可知,在实验条件下0.2 mg/mL咖啡因与精液共孵育时间为1 h,对冻后精子活率和活力最有利。在精子质膜完整率和顶体完整率方面,咖啡因平衡2 h组均显著低于对照组和平衡1 h、0.5 h组(P<0.05),而后3组之间精子质膜完整率和顶体完整率差异均不显著。该结果进一步表明,较长时间的咖啡因与精液共孵育,会对解冻后精子质量产生不利影响。同时,实验中咖啡因与精液共孵育1 h和0.5 h两组中的精子质膜完整率和顶体完整率均与对照组之间差异不显著。此结果说明,0.2 mg/mL咖啡因与精液0.5 h~1 h的共孵育,不会对解冻后精子质膜完整性和顶体完整性造成不利影响。解冻后精子体外存活时间也显示,咖啡因平衡2 h组冻后精子存活时间仅有3 d,其显著低于对照组、平衡1 h和平衡0.5 h组(P<0.05),后3组冻后精子存活时间都在6 d以上,其中平衡1 h组冻后精子存活时间达到7 d以上。此结果与咖啡因平衡2 h组中精子在冷冻之前超活化时间长[18]、消耗能量多[12]以及精子中产生的活性氧多[14]等,都有紧密联系。
5 结论
猪精子在4 ℃平衡过程中,相对于咖啡因与精液共孵育2 h和0.5 h而言,共孵育时间为1 h对解冻后精子质量最有利,该组中解冻后精子活率和活力显著高于对照组和平衡2 h和0.5 h组,而且该组中冻后精子体外存活时间长达7 d以上。

