戈利木单抗治疗白塞综合征心脏大血管受累的临床分析
孙鹿希,刘金晶,侯云霞,李超然,李 璐,田新平,曾小峰,郑文洁△
(1. 中国医学科学院 北京协和医学院 北京协和医院风湿免疫科 风湿免疫病学教育部重点实验室 协和转化医学中心 国家皮肤与免疫疾病临床医学研究中心,北京 100730; 2. 内蒙古医科大学附属医院风湿免疫科,呼和浩特 010050)
白塞综合征(Behcet syndrome, BS)是一种以血管炎为基础病理改变的慢性系统性疾病,由遗传因素及环境因素共同参与致病[1-2]。临床上以复发性口腔溃疡、生殖器溃疡、眼炎和皮肤病变为主要特点,并可累及心血管、神经、消化道等重要脏器[3]。存在大血管病变的BS患者称为血管白塞综合征(vasculo-BS,VBS),心脏受累是VBS的重要组成部分,约占BS总数的1.0%~7.0%[4]。我国VBS的患病率占BS总数的7.7%,是BS致死和致残的主要原因[5]。
BS心血管受累的机制尚不明确,以往研究显示,部分VBS患者对传统糖皮质激素及免疫抑制剂等治疗反应欠佳或不能耐受。近年来随着对血管炎性疾病研究的深入,抗肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)单抗[如英夫利昔单抗(infliximab, IFX)和阿达木单抗(adalimumab,ADA)]在难治性BS中取得了显著疗效[6]。戈利木单抗(golimumab, GOL)是新一代采用转基因技术制备的、全人源抗TNF-α单抗,已获批应用于类风湿关节炎和强直性脊柱炎等自身免疫性疾病的治疗中,但其用于BS的研究较少[7-8],国外报道的病例应用主要针对皮肤黏膜病变、关节、眼和胃肠道,对心脏大血管受累BS患者的疗效依然未知,国内尚未见GOL应用于BS的报道。本研究总结了9例GOL治疗重症/难治性心脏大血管BS患者的临床资料,以期为GOL治疗重症/难治性VBS提供一定临床经验。
1 资料与方法
1.1 临床资料
选取2018年2月—2020年7月在北京协和医院风湿免疫科接受GOL治疗的9例难治性心脏/大血管受累的BS患者进行回顾分析。BS诊断(分类)标准为2014年《国际白塞综合征诊断标准》(the international criteria for BS, ICBS)[9]。如不满足以上诊断标准,结合心脏表现及手术组织病理检查,经专家会诊,并排除其他引起心脏瓣膜的病变(如风湿性心脏病、先天性心脏病、感染性心内膜炎、梅毒、系统性红斑狼疮、大动脉炎等疾病),可临床诊断为BS。本组8例患者符合2014年ICBS,1例患者临床诊断BS。心脏/血管病变的诊断基于临床评估和影像学成像结果,包括多普勒超声、CT血管造影和/或MRI血管造影。收集的临床信息包括:患者年龄、性别、BS病程、临床表现、影像学资料、实验室检查[红细胞沉降率(erythrocyte sedimentation rate,ESR)、超敏C反应蛋白(high-sensitivity C-reactive protein,hsCRP)]、手术治疗情况、GOL使用前后激素和免疫抑制剂使用的种类和剂量。
1.2 治疗方案
GOL 50 mg每4周皮下注射一次,治疗开始时延续原糖皮质激素、免疫抑制剂方案。治疗过程中依据病情调整激素剂量、免疫抑制剂的种类和剂量。
1.3 疗效评估
评估临床症状、美国东部肿瘤协作组 (Eastern Cooperative Oncology Group, ECOG)体能状态评分[10]、血清炎症指标(ESR和hsCRP)情况、血管超声、超声心动图、激素和免疫抑制剂的减量效应,以及手术患者术后是否出现严重并发症。
1.4 统计学分析
数据资料采用SPSS 22.0软件进行统计学分析,计数资料以率表示,符合正态分布的计量资料采用均值±标准差表示,不符合正态分布的计量资料采用中位数(P25,P75)表示,两组间比较使用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
9例患者中男性8例、女性1例,年龄(37.0±8.6)岁,中位病程120 (60, 132)个月,其中7例患者因心脏病变诊断为BS,2例因血管病变诊断为BS。确诊BS至开始应用GOL治疗的中位时间为2 (1, 6)个月。合并症方面,1例患者诊断潜伏期结核(T-SPOT.TB阳性,胸部X线片无活动性结核感染),经感染科评估后予异烟肼预防性抗结核治疗后开始GOL治疗,其余8例患者均无潜伏性结核感染或活动性肝炎证据。
2.2 心脏及大血管受累情况
7例心脏病变患者均存在重度主动脉瓣关闭不全,其中4例可见显著升主动脉根部或主动脉窦部扩张,4例合并二尖瓣和/或三尖瓣反流,2例存在冠脉瓣、主动脉瓣瓣周脓肿,2例存在疑似二尖瓣赘生物,1例存在主动脉根部局限性夹层,1例存在左右冠脉瓣缘联合处可疑撕裂,其中,仅1例同时合并右侧胫前动脉近中段重度狭窄,余未见明显外周动脉异常。
2例大血管病变患者,1例表现为腹主动脉假性动脉瘤、肠系膜上动脉瘤形成伴附壁血栓和闭塞、腹腔干重度狭窄,另1例表现为肺动脉瘤、肺栓塞及多发深静脉血栓(表1)。
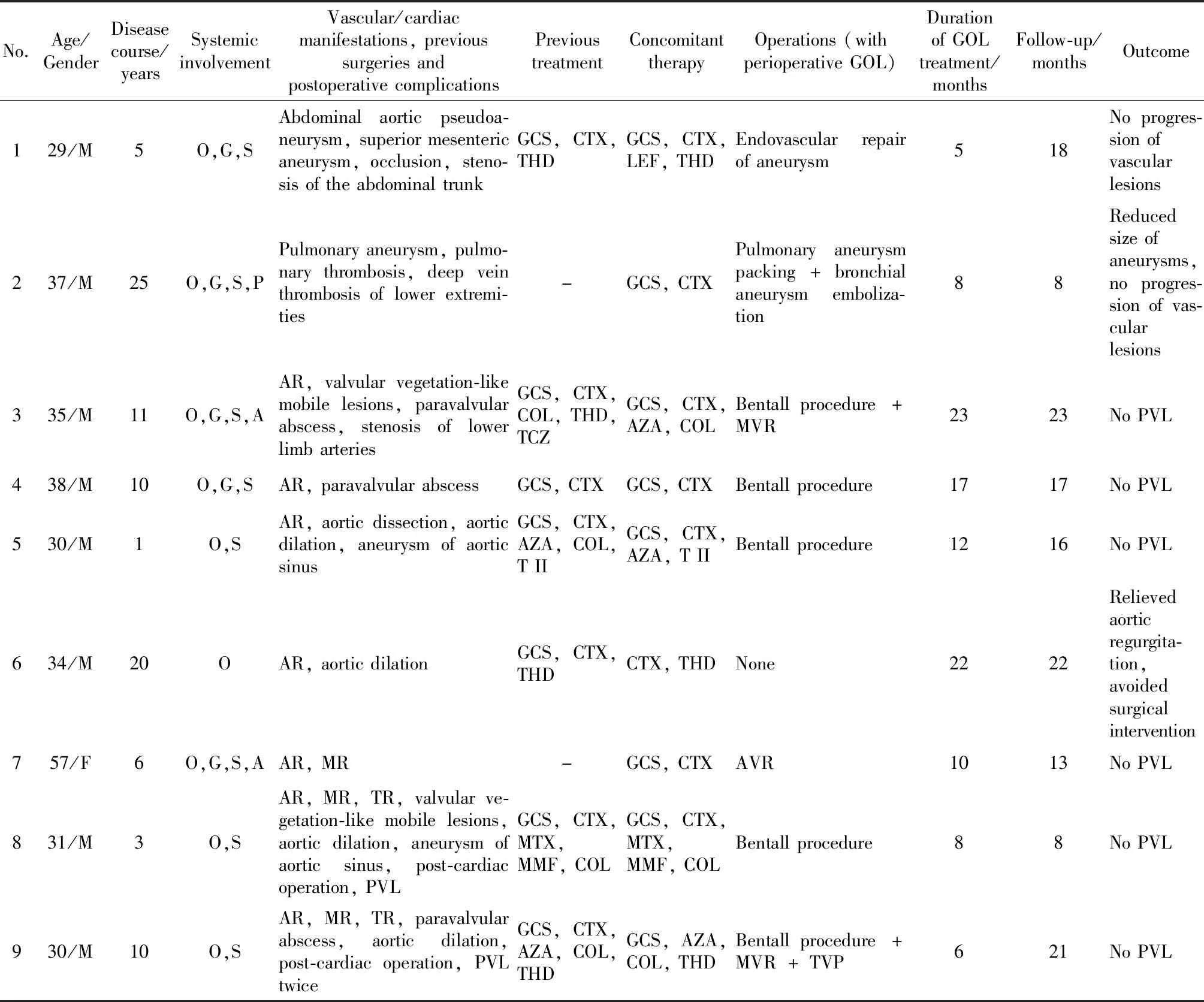
表1 心脏/大血管受累BS患者的临床特征Table 1 Clinical characteristics of BS patients with cardiac/large vessel involvement
2.3 BS其他系统受累情况
9例口腔溃疡,8例皮肤受累,5例生殖器溃疡,2例皮肤受累,2例关节炎。除心脏大血管受累外,9例患者均无眼、胃肠道、中枢神经系统等重要脏器受累。
2.4 治疗
2.4.1既往药物治疗 使用GOL前,7例患者应用激素联合免疫抑制剂/免疫调节剂治疗,激素初始剂量为泼尼松每天0.5~1.0 mg/kg,免疫抑制剂/免疫调节剂种类为4种(范围1~4)。7例患者应用环磷酰胺(cyclophosphamide,CTX,口服50~100 mg/d或静脉滴注0.2~0.4 g/周),仅1例为单用CTX,其余患者为联合用药,包括:沙利度胺(12.5~50.0 mg/d,n=4)、秋水仙碱(0.5~1.0 mg/d,n=4)、硫唑嘌呤(100 mg/d,n=2)、吗替麦考酚酯(1.0 g/d,n=1)、甲氨蝶呤(10 mg/周,n=1)和雷公藤多苷(40 mg/d,n=1)。1例曾使用托珠单抗(8 mg/kg,3次),后因出现消化道溃疡及消化道出血停用。
2.4.2手术史及并发症 在围术期未应用生物制剂的情况下,2例患者有心脏瓣膜手术史,共计3例次(1例患者有二次手术史)。术式包括:主动脉瓣周脓肿清除+主动脉瓣置换术+二尖瓣成形术1例,主动脉瓣置换+二三尖瓣成形术1例,瓣周脓肿清除术1例。3例术后均出现并发症,包括术后多发瓣周漏(3/3例)、瓣周脓肿(2/3例)、瓣内反流(1/3例)。大血管受累的患者GOL用药前未进行手术。
2.5 GOL应用指征
2.5.1心脏瓣膜受累病例 3例因心脏病变出现主动脉窦部或升主动脉根部增宽、重度主动脉瓣关闭不全、主动脉根部夹层、冠脉瓣缘撕裂及瓣周脓肿,需短期内行心脏手术治疗,为快速控制炎症并减少围术期激素用量,术前加用生物制剂。3例入组时新近完成心脏手术,其中2例既往心脏瓣膜术后出现瓣周漏等并发症,1例在未应用激素及免疫抑制治疗情况下进行手术,围术期炎症指标明显升高(ESR 83 mm/h,hsCRP 27.69 mg/L),为快速控制炎症,术后0.5~1.0个月均加用生物制剂。1例因围术期应用托珠单抗期间新发消化道溃疡伴发消化道出血,换用GOL。心脏受累患者围术期应用golimumab的手术术式包括:Bentall术5例(含1例联合二尖瓣置换术,1例联合二尖瓣置换术+三尖瓣成形术),主动脉瓣置换术1例。
2.5.2大血管受累病例 1例在足量激素联合CTX、沙利度胺免疫抑制剂治疗下出现腹主动脉假性动脉瘤进行性增大、肠系膜上动脉瘤形成伴附壁血栓和闭塞、腹腔干重度狭窄,1例因发现肺动脉瘤、肺栓塞、多发深静脉血栓诊断BS,既往未经激素及免疫抑制剂治疗,病情危重。两者均需短期内行手术治疗,为快速控制炎症并减少围术期激素用量,术前加用生物制剂。大血管受累的2例患者接受以下术式:腹主动脉瘤腔内修复术,肺动脉瘤填塞+支气管动脉瘤栓塞术。
2.6 GOL治疗和疗效
9例患者均应用GOL,50 mg每4周皮下注射一次,联合泼尼松和原有免疫抑制剂治疗,平均用药(12.3±6.8)个月,所有患者的临床症状和血清炎症标志物(ESR和hsCRP)都有所改善。患者均恢复正常工作、生活,ECOG评分由1(1,2)降至1(1,1)。心脏受累的7例患者规律随访,超声心动图评估病情平稳,6例围术期应用GOL的患者术后均未出现瓣周漏,1例拟行心脏瓣膜手术的患者因用药后病情平稳,超声评估升主动脉宽度减小,在随访期内未进行手术。2例血管病变患者围术期应用GOL后,经过血管超声评估,未出现明显术后并发症及新发血管病变,评估动脉瘤及血管受累范围缩小。
所有患者的炎症指标均显著下降,ESR由16.5 (6.8, 52.5) mm/h降至4 (2, 7) mm/h (t=2.44,P<0.05)。hsCRP由21.24 (0.93, 32.51) mg/L降至0.58 (0.37, 1.79) mg/L (t=2.46,P<0.05),见图1、2。
泼尼松剂量由35(15,60)mg/d减至 10.0(10.0,12.5) mg/d,CTX均得以减量,1例患者已停用CTX,3例患者联用免疫制剂的种类减少。
2.7 不良反应
无明显过敏和肝肾损伤,无严重感染发生。
2.8 随访
患者平均随访(16.3±5.6)个月,4例患者已停用GOL,2例患者由50 mg每4周一次减量至50 mg每45~50天一次,所有患者定期随访病情平稳。
3 讨论
BS血管受累是引起BS患者致残甚至致死的主要因素,以青壮年男性多见,病变多发且复发率高,可累及全身所有动静脉系统,静脉病变以血栓为主,动脉受累主要包括动脉狭窄、闭塞、动脉瘤伴血栓形成等,动脉瘤破裂可危及生命[11]。肺动脉受累包括肺动脉瘤和肺动脉血栓形成,BS伴发肺动脉受累的发生率小于5%,但死亡率高达25%[12]。BS的心脏受累包括心瓣膜病变、心肌炎和心包炎等,其中心瓣膜病变以主动脉瓣受累多见,常合并升主动扩张或升主动脉瘤。目前VBS发病机制尚未完全阐明,传统治疗方案为大剂量激素联合免疫抑制剂(如环磷酰胺、硫唑嘌呤、环孢素等),可显著改善VBS患者的预后[13],但仍有部分患者存在治疗反应欠佳,无法获得持续缓解,或不耐受副作用[14-16]。此外,在VBS疾病和炎症指标未控制的情况下行手术治疗,往往导致移植物闭塞、吻合血管瘤形成和瓣周漏等严重术后并发症的发生[15],因此,在短期内快速、有效控制炎症水平,为尽快手术创造条件,成为难治性VBS的治疗难题。
目前研究显示,VBS的发生与中性粒细胞活化、内皮细胞功能障碍、高凝状态及促炎因子过度表达相关[17-20]。促炎因子TNF-α过表达被认为在BS的致病机制中具有关键作用[21]。多项研究显示,BS患者血清中的TNF-α水平明显升高,且TNF-α水平与疾病活动度之间存在一定正相关性[22]。BS患者外周血单核细胞和γδT细胞等多种来源分泌TNF-α水平升高[23]。BS患者的多种受累组织(如口腔溃疡、葡萄膜炎)局部TNF-α水平升高[24-25],肠黏膜分离的CD4+和CD8+T细胞均可产生大量TNF-α[26],但对于血管局部TNF-α水平尚待进一步研究。高表达的TNF-α可引起白细胞介素-1、白细胞介素-6等细胞因子过度表达,刺激T细胞向促炎方向分化,介导下游炎症瀑布形成,从而引起组织损伤及疾病发生,因此,抗TNF-α单抗对阻断下游炎症通路、控制疾病进展具有重要作用。
近年来,抗TNF-α单抗(如IFX和ADA)在治疗难治性静脉血栓、动脉瘤BS大血管受累上的疗效得到了证实[27-30],并进入了2018《欧洲风湿病联盟(the European League Against Rheumatism, EULAR)类风湿关节炎治疗建议》的推荐[31]。Aksoy等[27]总结了国外文献报道中共125例应用抗TNF-α单抗(IFX或ADA)治疗难治性血管BS的研究显示,抗TNF-α单抗联合激素和传统免疫抑制剂治疗,患者的临床缓解率可达80%以上,复发率为8.8%。另一项研究显示,抗TNF-α单抗(IFX或ADA)联合免疫抑制治疗9个月、12个月的复发风险均为6%(对照组仅激素和传统免疫抑制剂治疗,复发率分别为35%和41%)[30]。本研究组的研究显示,16例患者应用IFX或ADA联合激素和传统免疫抑制剂治疗,其中15例患者可达临床缓解,随访(19.4±8.2)个月未见新发血管病变,2例联合心脏瓣膜手术治疗的患者术后均未出现明显并发症[32]。
GOL是首个采用转基因小鼠制备的全人源抗TNF-α单抗,因而具有更低的免疫原性。GOL相较于ADA,抗抗体发生率低(4%vs. 14.1%)、疗效稳定[33]。GOL可与可溶性和跨膜活性形式的TNF-α结合,有效抑制TNF-α的生物学活性。有研究表明,GOL与其他TNF-α抑制剂相比,对强直性脊柱炎、类风湿关节炎、银屑病关节炎的治疗持久率更高[34],在溃疡性结肠炎诱导期的疗效优于ADA[35]。同时,GOL和TNF-α的亲和力更强、半衰期长,可每4周1次皮下注射,用药便利,有利于提高患者的依从性[36-38]。多项前瞻队列临床试验及病例报道已证实了GOL在类风湿关节炎、强直性脊柱炎、多关节型幼年特发性关节炎和溃疡性结肠炎等多种自身免疫疾病中的有效性和安全性[39-42]。GOL在我国已获批的适应证为类风湿关节炎和强直性脊柱炎。多项回顾研究显示,GOL与其他抗TNF-α单抗一致,比传统改善病情的抗风湿药物(disease-modifying anti-rheumatic drugs,DMARDs)具有更显著的疗效[43-44]。一项GOL联合激素和传统免疫抑制剂治疗17例非大血管受累的难治性BS的研究显示, 3个月内16例BS患者可达临床缓解,可有效减少激素用量,随访(18.47±20.80)个月时,58.8%的患者停用激素治疗[7]。
本研究的9例心脏大血管BS患者中,7例以升主动脉病变合并重度主动脉瓣关闭不全为主要临床表现,另2例临床主要表现为多发动脉瘤、静脉血栓。心脏大血管病变病情危重者需短期内行手术治疗,或在大剂量激素联合多种免疫抑制剂的规范治疗条件下,血管病变进展迅速,血清炎症标记物(ESR、hsCRP)反复升高,部分术后出现瓣周漏等并发症的患者,为快速控制病情、改善预后而接受GOL治疗。联合应用GOL后,患者的血管病变快速控制,短期内ESR和hsCRP下降至正常范围,影像学检查提示血管病变改善或保持稳定,均达到临床缓解,同时,激素及免疫抑制剂的用量减少,随访(19.4±8.2)个月,8例手术患者围术期及随访均未出现明显并发症。
既往的安全性研究显示,抗TNF-α单抗的主要不良反应包括过敏,感染,出现无症状的抗核抗体阳性,以及潜伏期结核的激活。本研究9例患者均未出现上述不良反应,1例患者入组时诊断为潜伏期结核,规范使用预防性抗结核治疗后应用GOL,随访期间未发生活动性感染。此外,1例患者在既往应用托珠单抗期间出现新发消化道溃疡伴消化道出血,既往曾有报道,患者应用托珠单抗期间出现结肠溃疡伴消化道出血,与其他生物制剂和传统DMARDs相比,应用托珠单抗治疗RA出现下消化道穿孔风险增高[45-46]。本例患者消化道溃疡及出血部位位于回盲部,与白塞病好发部位一致,但临床无法排除托珠单抗副作用的可能,因此停用托珠单抗,更换为GOL,之后随访原发病控制良好,未再出现消化道溃疡及出血。因本研究样本量较少,用药及随访时间不等,尚不能得出有效性和长期安全性的结论,仍待进一步前瞻性临床研究论证。
综上所述,对于重症/难治性心脏大血管BS患者,GOL单抗联合激素和免疫抑制剂可安全、有效控制炎症指标水平,减少激素用量,减少术后并发症发生率,改善患者预后。

