腺相关病毒介导的脑源性神经营养素对脊神经结扎大鼠的镇痛机制
黄爱苹 章巧琪 谷桢 薛纯纯 王开强 谢磊
1上海中医药大学附属市中医医院疼痛科(上海200071);2上海中医药大学附属曙光医院宝山分院肾内科(上海201999)
神经病理性疼痛是由于躯体感觉系统的损伤或疾病所引起的疼痛[1],以自发性痛、烧灼样痛、痛觉过敏和痛觉超敏为特征,在普通人群中的患病率高达7% ~10%,长期的疼痛会严重影响生活及情感[2]。脑源性神经营养素(brain⁃derived neu⁃rotrophic factor,BDNF)参与神经损伤后神经修复、再生,影响继发神经病理性疼痛的产生和维持。目前大多研究集中在内源性BDNF对神经病理性疼痛形成抑制的研究,而对中后期神经病理性疼痛的影响报道较少,特别是外源性BDNF。研究证实腺相关病毒(adeno⁃associated virus,AAV)介导的外源性BDNF在海马表达可缓解炎性疼痛及自发性疼痛[3-4],在鞘内表达可以改善慢性坐骨神经压迫大鼠的疼痛[5],但鞘内表达的镇痛机制研究未见报道。有研究表明脊髓损伤后BDNF可由抑制逆转上调钾离子⁃氯离子共转运体2(potassium chloride cotransporter 2,KCC2)活性,维持γ⁃氨基丁酸(γ⁃aminobutyric acid,GABA)功能而产生镇痛[6]。因此,本研究通过鞘内注射AAV介导的BDNF于脊神经结扎(spinal nerve ligation,SNL)大鼠,观察注射前后SNL大鼠痛阈值变化及注射后BDNF、KCC2在脊髓背角的表达情况,探讨AAV介导的BDNF对神经病理性疼痛的影响及可能的机制。
1 材料与方法
1.1 实验动物及分组选取体质量200 ~250 g雄性SD大鼠56只,由上海西普尔⁃必凯实验动物有限公司提供,生产许可证号:SCXK(沪)2018⁃0006。随机分7组,每组8只,分别为正常组、SNL组、SNL+生理盐水组(NS)、SNL+空载组(AAV0)、SNL+AAV⁃BDNF组(BDNF)、SNL+AAV⁃BDNF+KCC2拮抗剂组(BDNF+Furos)、SNL+AAV⁃BDNF+NS组(BDNF+NS)。
1.2 主要试剂及仪器BDNF抗体(ab203573,Abcam,USA),KCC2抗体(ab134300,Abcam,USA),Westorn⁃blot鼠二抗(M21001F,abmart,USA),BCA蛋白浓度测定试剂盒(P0010,碧云天),蛋白marker(10⁃250KD)(26619⁃1,Fermentas,CAN),ECL发光液(OH188466A,Thermo,USA),足底触觉测定仪(IITC,USA),足底热痛敏测定仪(Ugo Basile,ITA),切片机(MR2076,Leica,DEU),全自动化学发光图像分析系统(Tanon⁃4200,Tanon),GEL im⁃age system(Tanon⁃1000,Tanon)。
1.3 AAV 载体的构建带有BDNF的基因片段的质粒PCR扩增回收,正向引物:5′⁃tccatagaagacacc⁃gggatccgccaccATGTCTGACCCCAGTGCCTG⁃3′,反向引物:5′⁃atccttgtagtcgttaattaaggtaccTCTTCCCCTTTT⁃AATGGTCA⁃3′。扩增后与载体pHBAAV⁃CMV⁃MCS⁃3flag⁃T2A⁃ZsGreen(购自Hanbio Biotechnology)酶切后进行连接反应,转化、挑菌、PCR鉴定测序。将制备的pHBAAV2/9⁃BDNF⁃GFP及其辅助包装载体质粒pAAV⁃RC、pHelper,分别进行高纯度抽提,共转染AAV⁃293细胞,转染后6 h更换为完全培养基,72 h后收集富含腺相关病毒颗粒的AAV⁃293细胞。反复冻融裂解细胞,收集上清液,利用全能核酸酶处理和柱纯化方法,得到高滴度的纯化腺相关病毒颗粒HBAAV2/9⁃BDNF⁃GFP,荧光定量PCR法测定滴度。
1.4 SNL 模型建立以10%水合氯醛300 mg/kg腹腔注射麻醉,以L5/6棘突间隙为中心做一长约4 cm纵向切口,逐层分离至椎板、关节突,咬除左侧L5椎板和关节突,暴露分离左侧L5脊神经并结扎。充分冲洗止血,逐层缝合,肌注青霉素预防感染。造模后48 h测机械痛低于造模前30%为造模成功。
1.5 鞘内注射造模成功48 h后,大鼠3%异氟烷吸入麻醉,一手定位L5/6棘突间隙,16G粗针破皮,另一手持微量注射器,按Mestre报道的方法刺入蛛网膜下腔,穿刺成功可见典型鼠尾甩动。相应试剂于10 s内推完。异氟烷吸入停止后动物在1 min内恢复翻正反射。NS、AAV0、BDNF、BDNF+Furos、BDNF+NS各组分别注射NS 10 μL、AAV0(1×1010)10 μL、AAV⁃BDNF(1×1010)10 μL、AAV⁃BDNF(1 × 1010)10 μL+KCC2拮抗剂15 μg、AAV⁃BDNF(1×1010)10 μL+NS 15 μg。
1.6 机械缩足反射阈值(mechanical withdrawal threshold,MWT)、热缩足反射潜伏期(thermal withdrawal latency,TWL)测定注射前后各时间点上午8:00~11:00,分别测定患侧足底MWT、TWL值。Von Frey测定法测定MWT(足底触觉测定仪最大碰触力50 g),热平板法测定TWL(热源的强度设定为75%,时间上限30 s)。连续测3次,每次间隔5 min,取其平均值。
1.7 取材及Westom blot 检测行为测试后,10%水合氯醛300 mg/kg腹腔注射麻醉,开胸,通过心脏用生理盐水、4%多聚甲醛磷酸缓冲液灌注固定。取L4⁃L6脊髓腰膨大入4%多聚甲醛磷酸缓冲液固定30 min(4 ℃),-80 ℃低温冰箱保存。取适量组织液氮研磨,冰上裂解1 h,4 ℃离心取上清加入5× Loading Buffer,100 ℃煮沸10 min,离心后电泳。电泳后将蛋白转移到PVDF膜上,室温封闭1 h,稀释后一抗4 ℃孵育过夜,洗膜3次,室温稀释二抗孵育1 h,洗膜3次,于保鲜膜上ECL底物反应液反应60 s,沥干,曝光成像。
1.8 统计学方法本实验采用SPSS 20.0软件进行统计学分析。行为学数据采用重复测量方差分析,计量资料以均数±标准差表示。多组间样本均数比较进行方差齐性检验,使用单因素方差分析,方差齐者两两比较采用t检验。Western⁃blot实验结果用Image⁃Pro Plus 6.0软件统计分析;应用Graph Pad Prism 5.0软件进行数据图制作。P <0.05为差异有统计学意义。
2 结果
2.1 各组大鼠注射前后MWT、TWL 比较观察发现造模前各组大鼠基础MWT、TWL值无明显差异。注射后各组MWT、TWL逐渐降低,至注射后7 d,SNL、NS、AAV0各组趋于稳定,BDNF、BDNF+Furos、BDNF+NS各组逐渐回升,与正常组比较差异有统计学意义(P <0.001)。注射后14、21 d,BDNF组MWT、TWL高于SNL、NS、AAV0各组(P <0.001)。BDNF+Furos组注射后各时间点MWT、TWL均低于BDNF、BDNF+NS组(P <0.001)。注射前后相应时间点SNL、NS、AAV0各组间比较差异无统计学意义。见表1、2。
表1 鞘内注射前后大鼠机械缩足反射阈值Tab.1 MWT in rats before and after intrathecal injection ±s

表1 鞘内注射前后大鼠机械缩足反射阈值Tab.1 MWT in rats before and after intrathecal injection ±s
注:与正常组比较,*P <0.001;与SNL、NS、AAV0 组比较,#P <0.001;与BDNF、BDNF+NS 组比较,δP <0.001
分组正常SNL NS AAV0 BDNF BDNF+Furos BDNF+NS注射前2 d 35.49±3.88 37.11±3.13 36.62±2.69 35.47±2.36 36.10±2.42 34.69±2.14 36.07±1.86 0 37.73±1.80 25.49±2.69*25.05±2.47*22.57±2.07*23.82±1.87*23.48±2.53*24.10±1.20*3 d 36.39±3.23 22.04±2.41*19.76±1.55*20.11±2.87*20.70±3.63*10.18±1.15*δ 20.98±3.17*7 d 36.41±1.97 17.47±2.17*17.76±2.73*19.32±1.25*20.52±3.14*11.03±1.54*δ 20.69±3.07*14 d 36.99±3.05 16.08±2.58*15.61±1.45*17.02±2.15*22.99±2.81*#17.99±1.77*δ 22.30±3.06*21 d 36.00±2.50 16.49±1.52*18.01±2.83*17.64±2.19*27.41±2.68*#21.31±3.32*δ 27.13±2.20*
表2 鞘内注射前后大鼠热缩足反射潜伏期Tab.2 TWL in rats before and after intrathecal injection ±s

表2 鞘内注射前后大鼠热缩足反射潜伏期Tab.2 TWL in rats before and after intrathecal injection ±s
注:与正常组比较,*P <0.001;与SNL、NS、AAV0 组比较,#P <0.001。与BDNF、BDNF+NS 组比较,δP <0.001
分组正常SNL NS AAV0 BDNF BDNF+Furos BDNF+NS注射前2 d 24.81±1.90 25.02±2.49 24.92±2.25 24.36±2.91 24.11±1.74 24.84±2.49 23.83±1.74 0 24.69±2.87 16.92±2.65*15.42±1.41*17.74±3.39*16.10±2.53*15.61±2.10*16.97±2.61*3 d 26.05±1.38 13.53±1.53*13.34±3.90*14.64±3.97*12.88±2.53*6.35±1.32*δ 13.09±2.38*7 d 24.47±2.86 9.10±2.64*9.18±1.43*10.69±1.36*10.85±2.00*6.87±1.40*δ 11.41±0.89*14 d 25.76±1.60 7.92±2.23*8.34±3.11*9.1±1.44*13.66±2.43*#7.95±1.09*δ 14.24±2.39*21 d 24.80±2.36 9.29±2.64*8.79±1.05*9.67±1.03*16.21±1.87*#7.82±0.82*δ 15.73±1.18*
2.2 注射后21 d 脊髓背角BDNF、KCC2 蛋白的表达情况正常组与SNL组比较,BDNF蛋白表达无明显差异;BDNF组与正常组、SNL、NS、AAV0组相比,BDNF表达显著升高(P <0.001);BDNF+Furos组与BDNF、BDNF+NS组比较差异无统计学意义(图1A)。造模各组与正常组比较,KCC2蛋白表达明显下降(P <0.001);与SNL、NS、AAV0相比,BDNF组KCC2表达明显升高(P <0.001);与BDNF、BDNF+NS组比较,BDNF+Furos组KCC2表达显著下降(P <0.001,图1B)。
3 讨论
BDNF在正常状态下,神经元细胞、肌肉、施旺细胞等可合成分泌一定量的BDNF,以维持神经元的存活和功能。当神经损伤时,BDNF参与了损伤神经的修复与保护[7]。IKEDA等[8]发现急性脊髓损伤后内源性BDNF在不同细胞内表达增加(包括运动神经元、感觉神经元、胶质细胞等),参与神经的修复,但表达量有限。本研究鞘内注射后21 d发现SNL组与正常组脊髓背角BDNF表达无明显差异,表明损伤后内源性BDNF表达有限,不能满足神经的修复保护。如果给予一定量的外源性BDNF是一种较好的途径。有研究证实通过椎管内给予外源性BDNF[9]、或慢病毒缓慢释放[10]、BDNF转基因小鼠过表达[11]都可促进轴突的再生、神经的修复。
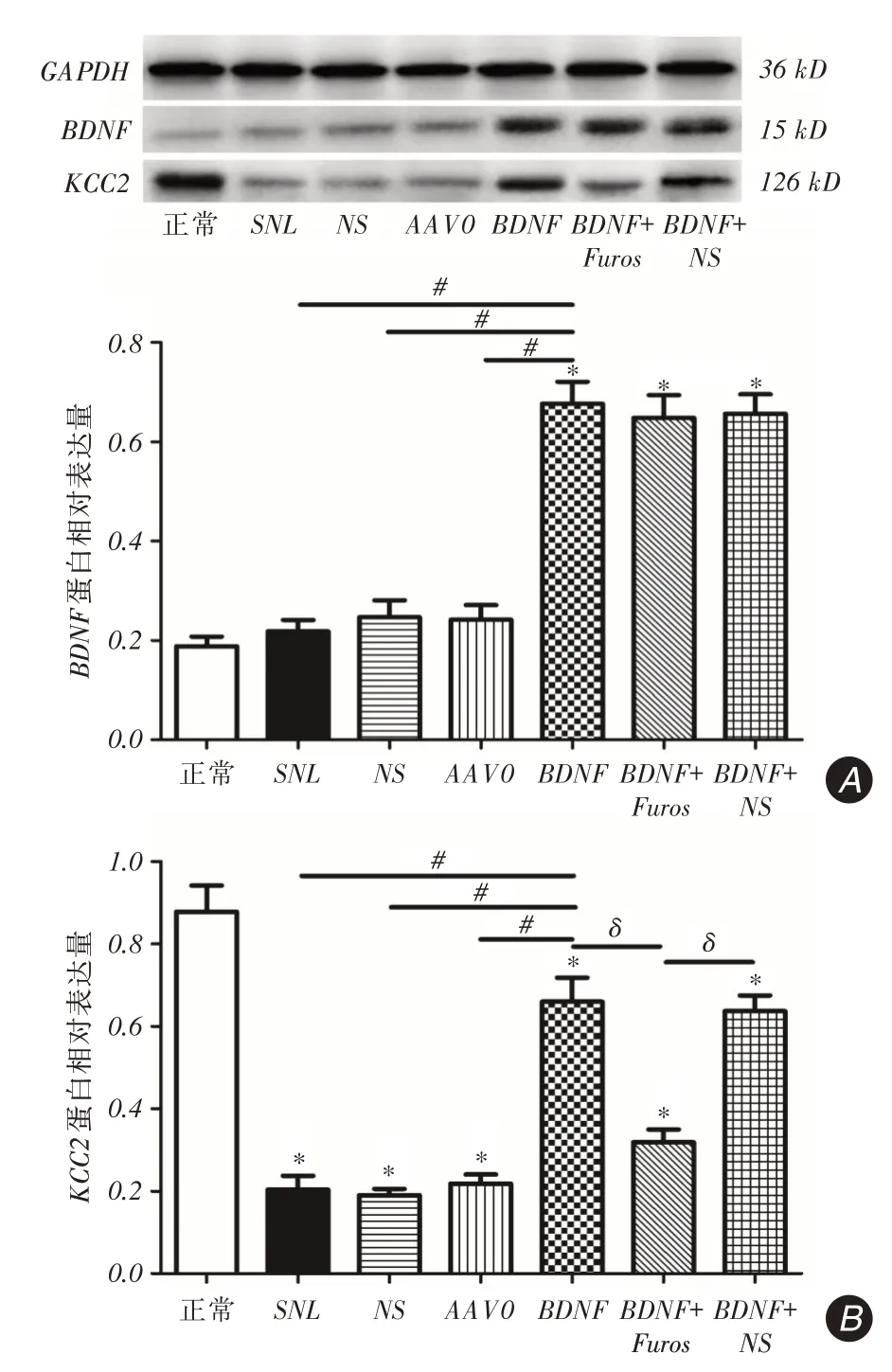
图1 鞘内注射21 d 后脊髓背角内BDNF、KCC2 蛋白的表达Fig.1 Expression of BDNF and KCC2 protein in spinal dorsal horn at 21 d after intrathecal injection
神经的损伤伴随神经病理痛的发生。多项研究表明,BDNF参与了神经病理痛的形成和维持。M′DAHOMA等[12]发现鞘内注射BDNF诱发的痛觉过敏和超敏反应与坐骨神经慢性压迫性损伤引起的疼痛类似,可被BDNF⁃TrkB受体拮抗剂所阻止。CONSTANDIL等[13]也发现正常大鼠鞘内注射外源性BDNF可引起痛觉过敏,但无剂量依赖性、叠加性。UCHIDA等[14]通过部分坐骨神经结扎模型鞘内注射抗BDNF抗体,发现术后2 d注射镇痛效果最佳,4 d后注射疗效甚微,表明内源性BDNF在神经病理痛形成初期起了重要作用。而在疼痛发生的中后期,却有研究发现BDNF可减轻疼痛。MA等[4]报道AAV介导的BDNF在海马内的过表可缓解自发性疼痛,LIANG等[15]研究BDNF的过表达可以减轻脊髓损伤的炎症反应,从而降低炎性疼痛。糖尿病周围神经病变大鼠通过内源性或外源性BDNF增加,可以降低GRD神经元和K+离子通道兴奋性,以缓解疼痛症状[16-17]。
可以看出,BDNF有修复、保护神经及止痛、致痛等多重作用,这可能与BDNF表达的时间与不同部位有关,即初期为疼痛的启动因子,中后期更侧重于修复镇痛,特别是中枢神经系统。因此,本研究通过AAV介导的BDNF鞘内注射SNL大鼠与对照组、空白组比较,发现2周后大鼠机械缩足反射阈值和热缩足反射潜伏期逐渐升高,鞘内注射21 d时病毒载体稳定表达外源性BDNF,表明椎管内缓慢释放外源性BDNF可以减轻异常性疼痛和神经痛的痛觉过敏,与以往报道一致[5]。
GABA抑制功能的下降是神经病理性疼痛发生的关键因素。其中抑制性中间神经元受体以GABAA为主。GABAA受体激活后开启突触后膜上的氯离子通道,使氯离子按照电⁃化学规律快速流入细胞,引起突触后膜电位改变,从而形成抑制性效应。研究表明中枢抑制性功能(GABA)下调可引发自发性疼痛和痛觉过敏[18-19]。KCC2是阳离子⁃氯离子共转运体家族中重要的一员,其能将细胞内氯离子泵出细胞外,造成胞外高氯,从而维持GABAA受体的抑制性功能[20]。神经损伤初期,BDNF激活TrkB通过级联反应引起去磷酸化,细胞表面KCC2降解,导致KCC2活性下降,使抑制性神经元的功能低下,产生致痛作用[21],表明BDNF在脊髓神经损伤早期是神经病理痛启动因子之一。而当损伤进入亚急性期或慢性期,为了应对损伤,BDNF反而促进了KCC2表达上调,此作用可以被TrkB⁃Fc所阻止,同时损伤2周后注射外源性BDNF也可以上调KCC2的mRNA表达[22-23]。HUANG等[6]表明外源性BDNF由未损伤时的抑制逆转为脊髓损伤后上调KCC2表达、恢复GABA激动剂的抑制作用产生镇痛作用。本研究发现鞘内注射21 d BDNF组脊髓背角KCC2表达上调,而当鞘内同时注射KCC2抑制剂呋塞米后,BDNF+Furos组脊髓背角KCC2表达下调,痛域值显著下降,说明损伤后期外源性BDNF的表达产生的镇痛作用与KCC2的表达上调有关,而且此作用可以被KCC2抑制剂所阻止。这可能通过增加KCC2表达活性以维持细胞外高氯,进而维持GABAA受体的抑制性功能实现镇痛。而BDNF是否影响GABA表达产生镇痛需要进一步证实。
综上,携带BDNF基因的AVV病毒鞘内缓慢的表达外源性BDNF可以起到镇痛作用,这与KCC2上调有关。然而BDNF的作用机制复杂,在致痛、止痛、修复保护神经及神经再生都有表现,相关通路多为共用,这些功能的转变尚不清楚,需要进一步研究解决。而如何控制基因表达及控制有效表达的问题仍需克服,过度表达是否会对无损伤神经产生影响则需进一步证实。

