对比剂诱导巨噬细胞来源外泌体对肾小管上皮细胞的作用及甘草酸苷的干预效应
韩崇明,张莹莹,徐兆龙△
对比剂诱发的急性肾损伤,即对比剂肾病(contrast induced nephropathy,CIN),是导致医院获得性急性肾损伤的第三大原因,可发生于30%以上接受碘化对比剂注射的患者[1]。CIN 的病理机制包括肾小管和血管内皮细胞的直接毒性作用、血流动力学紊乱、氧化应激等[2]。然而,其确切的发病机制仍不清楚,故缺乏有效的预防和治疗方法。常规的抗氧化剂和碱性疗法对有肾脏并发症的对比剂肾病患者并无增益[3]。
近期有研究提出,对比剂肾病可能是由原位或浸润的巨噬细胞和肾小管上皮细胞间相互作用导致的[4],但是2种细胞间具体的通讯方式尚不清楚。外泌体是一种携带蛋白质、微小RNA等活性成分的脂质双层囊泡,作为一种新的细胞间通讯方式而成为近年的研究热点[5-6]。在高糖诱导的糖尿病肾病模型中,肾小管上皮细胞可通过外泌体诱导巨噬细胞激活,巨噬细胞来源的外泌体也可促进系膜细胞增殖和活化,表明外泌体在肾脏细胞间是一种普遍且关键的通讯方式。但是在对比剂肾病中,外泌体在肾脏细胞间的作用尚鲜见报道。高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种非组蛋白染色体结合蛋白,在细胞受到外界刺激时,可由巨噬细胞等炎性细胞分泌至胞外。本研究采用对比剂体外诱导巨噬细胞,分离获得外泌体,从而观察其对肾小管上皮细胞功能的影响,并初步探讨HMGB1在外泌体中的表达以及特异性阻断药物甘草酸苷的干预效应。
1 材料与方法
1.1 主要试剂与仪器 人肾小管上皮细胞株HK-2细胞、人急性单核细胞白血病细胞株THP-1 细胞购自美国菌种保藏中心(ATCC);无外泌体的胎牛血清、青链霉素、RMPI-1640培养基、DMEM/F12培养基购自美国Hyclone 公司;碘海醇购自通用电气药业上海有限公司;甘草酸苷、佛波酯(phorbol-12-myristate-13-acetate,PMA)购自美国Sigma 公司;ExoQuick-TC Kit 外泌体提取试剂盒购自美国Systems Biosciences 公司;BCA 蛋白定量试剂盒、膜联蛋白(Annexin)Ⅴ-FITC/碘化丙啶(PI)细胞凋亡试剂盒购自江苏凯基生物技术股份有限公司;外泌体标记试剂盒购自辽宁润基生物科技有限公司;DAPI购自北京中杉金桥生物技术有限公司;Trizol试剂购自德国Qiagen 公司;PrimeScriptTM反转录试剂盒、SYBR®Premix Ex TaqⅡ试剂盒购自日本TaKaRa 公司;兔抗CD63 抗体、兔抗TSG101 抗体、兔抗calnexin 抗体、小鼠抗HMGB1抗体、兔抗Toll样受体4(TLR4)抗体、兔抗核因子κB(NF-κB)抗体购自美国Cell Signaling Technology 公司;兔抗Bcl-2抗体、兔抗Bax抗体、兔抗Cleaved caspase-3抗体、小鼠抗GAPDH 抗体购自英国Abcam 公司;引物合成于苏州金唯智生物科技有限公司。BX-63荧光显微镜购自日本Olympus公司;H-7500 透射电子显微镜购自日本Hitachi 公司;FACS Calibur 流式细胞仪购自美国BD 公司;Gel Doc XR 凝胶成像仪和CFX96荧光定量PCR仪购自美国Bio-Rad公司。
1.2 外泌体的分离与鉴定 THP-1 细胞常规培养于含10%无外泌体的胎牛血清、1%青链霉素的RMPI-1640培养基中,培养于37 ℃、5%CO2的恒温箱中。细胞用含100 nmol/L PMA的完全培养基诱导贴壁24 h。PBS 洗涤2 次后,更换为无血清的RMPI-1640 培养基,分别加入PBS、碘海醇(100 gI/L)、碘海醇+甘草酸苷(10 μmol/L)刺激24 h,收集细胞培养上清液,4 ℃、6 000 r/min离心20 min,上清液经0.22 μm滤器过滤后,采用ExoQuick-TC Kit 外泌体提取试剂盒分离外泌体。适量PBS重悬外泌体沉淀后,采用BCA蛋白定量试剂盒测定蛋白浓度,保存于-80 ℃冰箱。获得的3 种外泌体分别记为NC-Exo、CIN-Exo、CIN-GL-Exo。外泌体的鉴定[7-8]:采用透射电镜观察外泌体的形态;采用蛋白免疫印迹(Western blot)检测CD63、TSG101、calnexin 的表达,一抗分别为兔抗CD63抗体、兔抗TSG101 抗体、兔抗calnexin 抗体,稀释比例均为1∶1 000。
1.3 外泌体的摄取 HK-2 细胞常规培养于含10%无外泌体的胎牛血清、1%青链霉素的DMEM/F12培养基中,放置于37 ℃、5%CO2的培养箱中,将HK-2细胞按照2×104个/孔接种至24 孔板。采用外泌体标记试剂盒对外泌体进行DiR 荧光标记,加入50 μg/L已标记外泌体至培养的HK-2细胞中。共培养24 h后,常规进行多聚甲醛固定和DAPI染色,荧光显微镜下观察和拍照。
1.4 实验分组 将培养的HK-2 细胞随机分为4 组,Con 组(加入等体积的PBS)、NC-Exo 组(加入50 μg/L 的NC-Exo)、CIN-Exo组(加入50 μg/L的CIN-Exo)、CIN-GL-Exo组(加入50 μg/L的CIN-GL-Exo)。
1.5 检测指标
1.5.1 Western blot 检测相关蛋白的表达 Western blot 检测3种外泌体中HMGB1表达量,以及4组细胞中凋亡相关蛋白Bcl-2、Bax、Cleaved caspase-3 及HMGB1/TLR4/NF-κB 信号通路相关蛋白的表达。收集1×106个细胞,加入100 μL 的RIPA 裂解液,充分裂解2 min,12 000 r/min 离心10 min,留取上清液,进行BCA蛋白定量。样本经10%的聚丙烯酰胺凝胶电泳分离,然后将蛋白电转膜至PVDF膜,加入5%的脱脂奶粉常温封闭2 h,加入一抗4 ℃过夜孵育,一抗分别为小鼠抗HMGB1 抗体、兔抗TLR4 抗体、兔抗NF-κB 抗体、兔抗Bcl-2抗体、兔抗Bax 抗体、兔抗Cleaved caspase-3 抗体、小鼠抗GAPDH 抗体,孵育浓度均为1∶1 000。次日,漂洗3 次,加入辣根过氧化物酶标记的二抗室温孵育1 h,漂洗3 次,经ECL显色后,用凝胶成像仪拍照。采用Image J 软件测量各条带的灰度值,将Con 组目的蛋白与内参蛋白GAPDH 的灰度值之比作为1,每组10 个样本,每个样本设置3 个复孔,取其平均值。
1.5.2 流式细胞术检测4 组细胞的凋亡率 收集1×106个细胞,根据Annexin Ⅴ-FITC/PI 细胞凋亡试剂盒说明书进行操作:加入500 μL Binding Buffer 重悬细胞,添加5 μL AnnexinⅤ-FITC混匀,然后再加入5 μL Propidium Iodide,混匀,室温下避光反应5~15 min,流式细胞仪上检测,每份样品收集1×104个细胞。Annexin Ⅴ-FITC 与PI 染色双阳性的细胞为晚期凋亡细胞。凋亡率=晚期凋亡细胞数/总细胞数×100%。
1.5.3 实时荧光定量PCR(qPCR)检测4 组细胞炎性因子白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-αmRNA 的表达 用Trizol 试剂提取细胞中mRNA。PrimeScriptTM反转录试剂盒将其反转录为cDNA,反应条件:37 ℃,15 min;85 ℃,5 s;4 ℃,30 min。采用SYBR®Premix Ex TaqⅡ试剂盒进行qPCR,引物序列,见表1。反应条件:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,40 个循环。按照2-ΔΔCt法计算目的基因的相对表达量,每组10个样本,每个样本设置3个复孔,取其平均值。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.6 统计学方法 采用GraphPad Prism 6.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 外泌体的鉴定 透射电镜观察显示,THP-1细胞来源的外泌体为圆形或类圆形小囊泡,见图1A。Western blot 检测结果显示,外泌体中含有表面标志物蛋白CD63、TSG101,而不含有内质网蛋白calnexin,见图1B。

Fig.1 Identification of exosomes图1 外泌体的鉴定
2.2 外泌体的摄取 荧光染色结果显示,标记DiR荧光素的外泌体可被HK-2 细胞摄取,聚集于核膜附近,见图2。

Fig.2 The uptake of exosomes图2 外泌体的摄取
2.3 3 种外泌体中HMGB1 表达量的比较 Western blot 结果显示,CIN-Exo 的HMGB1 蛋白表达量(4.72±0.45)高 于NC-Exo(1.00±0.23)和CIN-GLExo(0.82±0.27),差异有统计学意义(F=531.500,P<0.01),见图3。
2.4 4 组细胞凋亡情况的比较 Annexin Ⅴ-FITC/PI 双染结果显示,CIN-Exo 组的细胞凋亡率[(20.38±2.54)%]高于Con 组[(3.73±0.76)%]、NCExo 组[(8.41±1.09)%]和CIN-GL-Exo 组[(10.50±1.27)%],差异有统计学意义(F=240.200,P<0.01),见图4。Western blot 结果显示,NC-Exo 组细胞Bcl-2 表达量低于Con 组,而Bax、Cleaved caspase-3 表达量高于Con组(P<0.05);CIN-Exo组细胞Bcl-2表达量低于Con 组、NC-Exo 组、CIN-GL-Exo 组,而Bax、Cleaved caspase-3 表 达 量 高 于Con 组、NC-Exo 组、CIN-GL-Exo组,差异有统计学意义(P<0.05),见图5、表1。
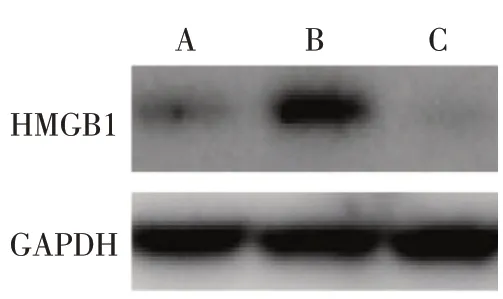
Fig.3 The protein expression of HMGB1 in exosomes detected by Western blot assay图3 Western blot检测外泌体中HMGB1蛋白质的表达

Fig.4 The apoptosis rates of cells detected by Annexin Ⅴ-FITC/PI double staining method图4 Annexin Ⅴ-FITC/PI双染法检测4组细胞凋亡率

Fig.5 The expression of apoptosis-related protein detected by Western blot assay图5 Western blot检测细胞中凋亡相关蛋白的表达
Tab.1 Comparison of the expression levels of apoptosisrelated proteins between 4 groups of cells表1 4组细胞凋亡相关蛋白表达水平的比较(n=12,±s)
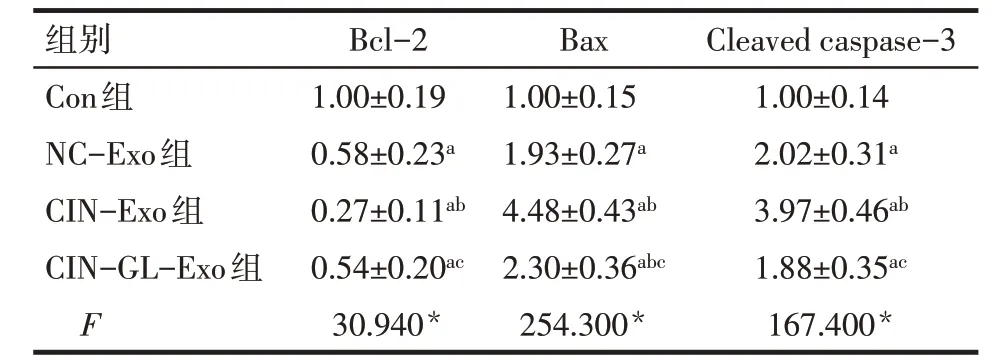
Tab.1 Comparison of the expression levels of apoptosisrelated proteins between 4 groups of cells表1 4组细胞凋亡相关蛋白表达水平的比较(n=12,±s)
*P<0.05;a与Con 组比较,b与NC-Exo 组比较,c与CIN-Exo 组比较,P<0.05
组别Con组NC-Exo组CIN-Exo组CIN-GL-Exo组F Bcl-2 1.00±0.19 0.58±0.23a 0.27±0.11ab 0.54±0.20ac 30.940*Bax 1.00±0.15 1.93±0.27a 4.48±0.43ab 2.30±0.36abc 254.300*Cleaved caspase-3 1.00±0.14 2.02±0.31a 3.97±0.46ab 1.88±0.35ac 167.400*
2.5 4 组细胞炎性因子mRNA 相对表达水平的比较 NC-Exo组细胞中IL-1β、IL-6、TNF-αmRNA表达水平高于Con组(P<0.05);CIN-Exo组细胞中IL-1β、IL-6、TNF-αmRNA 表达水平高于Con 组、NCExo 组、CIN-GL-Exo 组,差异有统计学意义(P<0.05),见表2。
Tab.2 Comparison of the mRNA expression levels ofinflammatory factors between 4 groups of cells表2 4组细胞炎性因子mRNA表达水平的比较(n=12,±s)

Tab.2 Comparison of the mRNA expression levels ofinflammatory factors between 4 groups of cells表2 4组细胞炎性因子mRNA表达水平的比较(n=12,±s)
*P<0.05;a与Con 组比较,b与NC-Exo 组比较,c与CIN-Exo 组比较,P<0.05
组别Con组NC-Exo组CIN-Exo组CIN-GL-Exo组F IL-1β 1.00±0.14 1.59±0.22a 4.36±0.48ab 2.04±0.37abc 238.700*IL-6 1.00±0.16 1.38±0.25a 3.50±0.41ab 1.46±0.39ac 149.600*TNF-α 1.00±0.11 1.80±0.26a 4.93±0.55ab 2.26±0.41abc 253.000*
2.6 4 组细胞HMGB1/TLR4/NF-κB 信号通路相关蛋白表达水平的比较 Western blot 结果显示,NCExo 组细胞HMGB1、TLR4、NF-κB 表达量高于Con组(P<0.05);CIN-Exo 组细胞HMGB1、TLR4、NFκB 表达量高于Con 组、NC-Exo 组、CIN-GL-Exo 组,差异有统计学意义(P<0.05),见表3、图6。
Tab.3 Comparison of the expression levels of HMGB1/TLR4/NF-κB signaling pathway related proteins between 4 groups of cells表3 4组细胞HMGB1/TLR4/NF-κB信号通路相关蛋白表达水平的比较(n=12,±s)

Tab.3 Comparison of the expression levels of HMGB1/TLR4/NF-κB signaling pathway related proteins between 4 groups of cells表3 4组细胞HMGB1/TLR4/NF-κB信号通路相关蛋白表达水平的比较(n=12,±s)
*P<0.05;a与Con 组比较,b与NC-Exo 组比较,c与CIN-Exo 组比较,P<0.05
组别Con组NC-Exo组CIN-Exo组CIN-GL-Exo组F HMGB1 1.00±0.18 2.17±0.34a 3.03±0.45ab 1.95±0.29ac 76.820*TLR4 1.00±0.22 2.48±0.29a 4.79±0.53ab 2.26±0.30ac 237.800*NF-κB 1.00±0.17 2.25±0.26a 4.50±0.58ab 2.49±0.31ac 190.500*

Fig.6 The expression of HMGB1/TLR4/NF-κB signaling pathway detected by Western blot assay图6 Western blot检测细胞中HMGB1/TLR4/NF-κB信号通路的表达
3 讨论
近期有研究发现,原位或浸润的巨噬细胞可能在对比剂肾病中发挥关键作用[4]。循环中的对比剂被原位巨噬细胞摄取后,使Nod 样受体蛋白3(NLRP3)炎性体激活,大量生成并分泌IL-1β 等炎性因子,从而介导循环中的白细胞向肾脏迁移;另一方面,对比剂经肾小球过滤后进入肾小管,然后由肾小管上皮细胞重吸收后,再递送给巨噬细胞,使炎症反应进一步扩大。由此可见,巨噬细胞、肾小管上皮细胞等不同类型细胞间紧密联系,在肾损伤中发挥协同效应,但是细胞间通讯方式尚不清楚。外泌体是一种双层质膜包裹的囊泡样小体,直径为50~150 nm,可由大多数细胞分泌[9-10]。外泌体中包含着丰富的蛋白质、脂质、微小RNA等活性成分,可将重要的信号分子递送至靶细胞,从而发挥各种调节作用[11]。在对糖尿病肾病的研究中发现,血管内皮细胞来源的外泌体可以激活肾小球系膜细胞,促进细胞外基质的分泌,而且肾小球系膜细胞来源的外泌体也可介导足细胞损伤[12-14]。因此,笔者认为在对比剂肾病中,各细胞间的通讯也可能通过外泌体实现。
外泌体的提取与鉴定是本研究的首要环节。本研究采用商品化试剂盒通过沉淀法从巨噬细胞培养上清液中分离得到外泌体,与传统的超速离心法相比较,具有分离快、产量大、纯度高的优点,是较为常用的分离方法[15]。外泌体上富含多种跨膜转运蛋白、多囊泡胞内体产生相关蛋白等,与外泌体的产生与功能有关,可作为外泌体鉴定的特征性标志物。本研究采用Western blot 检测CD63 和TSG101 的表达,结果显示在分离的外泌体中两者均呈高表达,而未检测到内质网蛋白calnexin表达,提示其不含其他细胞成分,纯度较高,与文献[14]报道结果一致。外泌体主要由内吞的方式被摄取,本研究也通过荧光标记的方法证实巨噬细胞来源的外泌体可被HK-2细胞摄取,且主要分布于核膜附近,即胞浆中。但是,本研究未对外泌体摄取的具体通路进行深入探讨,据陈曦等[16]分析可能与网格蛋白介导的内吞通路或胆固醇等非网格蛋白依赖的内吞途径有关,这有待今后进一步研究。
为了进一步探讨巨噬细胞来源的外泌体可否介导肾小管上皮细胞损伤,本研究使用分离得到的外泌体刺激肾小管上皮细胞,结果显示与Con组、NCExo组比较,CIN-Exo组细胞的凋亡率以及凋亡促进蛋白Bax、Cleaved caspase-3 表达量均升高,凋亡抑制蛋白Bcl-2 表达量降低,提示巨噬细胞在碘海醇刺激后分泌的外泌体可诱导肾小管上皮细胞凋亡。郭银凤等[17]报道,高糖环境活化的巨噬细胞上清液可促进足细胞凋亡,与本研究结果一致,并进一步指出外泌体成分在细胞上清液中的关键作用。此外,郭银凤等[17]认为,上清液中含有的高浓度炎性因子是诱导细胞凋亡的效应分子。本研究结果显示,CIN-Exo 组细胞中IL-1β、IL-6、TNF-αmRNA 水平高于Con组和NC-Exo组,证实了炎性因子在外泌体促凋亡效应中的作用。值得注意的是,与Con 组比较,NC-Exo组细胞的凋亡率及炎性因子表达水平也有所上调,提示巨噬细胞在不经碘海醇诱导的情况下,依然可以对肾小管上皮细胞造成一定损伤。
HMGB1 是真核细胞内普遍存在的非组蛋白染色体蛋白,在胞核内主要发挥稳定核小体、调节基因转录的作用,但是在各种因素刺激下可分泌至细胞外,与细胞表面受体TLR4结合,诱导炎症反应[18-19]。为了进一步探究外泌体中发挥损伤效应的活性成分,本研究对这种可介导炎症级联反应的关键分子HMGB1 进行检测,结果显示HMGB1 在碘海醇诱导的巨噬细胞外泌体中表达显著升高,提示外泌体HMGB1 可能是发挥损伤效应的关键分子。甘草酸苷可与HMGB1直接结合,从而发挥特异性抑制剂的作用[20-21]。本研究结果显示,甘草酸苷可显著抑制碘海醇对外泌体HMGB1的上调效应,进一步降低肾小管上皮细胞的凋亡率与炎性因子表达水平,下调HMGB1/TLR4/NF-κB 信号通路相关蛋白的表达,从而发挥保护效应。
综上所述,本研究揭示了巨噬细胞来源外泌体及其HMGB1 高表达在对比剂诱导肾小管上皮细胞凋亡和炎症反应中的关键作用,为对比剂肾病发病机制的研究提供了一个新的视角。甘草酸苷作为传统中药材甘草的主要活性成分,本研究为其用于对比剂肾病的治疗提供了一定的理论依据。
——外泌体与老年慢性疾病相关性的研究进展

