基于转录组测序花烟草响应盐胁迫活性氧清除相关基因的挖掘
鲁琳 杨尚谕 刘维东 鲁黎明
(1. 四川农业大学风景园林学院,成都 611130;2. 四川农业大学农学院,成都 611130)
土壤盐渍化是威胁植物正常生长的最重要因素之一,并对农业生产造成巨大威胁[1]。在高盐胁迫下,Na+所产生的渗透胁迫和离子毒性严重影响了植物细胞代谢和生理功能,阻碍植物生长和发育,严重时会导致植物的死亡[2]。在长期的进化过程中,植物形成了一套复杂的抵御盐胁迫的机制。在盐胁迫下,植物通过活性氧(Reactive oxygen species,ROS)清除、信号转导和下游基因表达,以及启动过度盐敏性 (Salt overly sensitive,SOS)途径等来调节其形态、生理和生化过程,以抵御外界高盐的环境[3]。在这些机制中,ROS清除系统在植物对盐胁迫的适应中起着重要的作用。
植物在高盐、干旱、寒冷、高温和遭受病原菌的侵染时,均会产生大量的ROS,而过量的ROS,会被植物细胞的抗氧化防御系统所清除[4]。研究表明,超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalases,CAT)、抗坏血酸过氧化物 酶(Ascorbate peroxidase,APX)、愈 创 木 酚 过氧化物酶(Guaiacol peroxidase,GPOX)、谷胱甘肽还原酶(Glutathione reductase,GR)、单脱氢抗坏血酸还原酶(Monodehydroascorbate reductase,MDHAR)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)、谷胱甘肽S-转移酶(Glutathione S-transferases,GST)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)等,是植物活性氧清除的关键酶与主要执行者[4]。研究表明,在盐胁迫下,烟草幼苗的SOD、POD、CAT及APX的活性均有所增强[5-6]。同时,SbpAPX在烟草中的过表达,增强了转基因植株对盐及干旱的抵抗能力[7]。Cu/Zn-SOD[8-9]、Mn SOD[10-11]、POD[12]、CAT[13]、APX[14-15]及GPX[16-17]的过表达植株,均表现出较高的对盐胁迫的耐受能力。
转录水平的调控是植物生命活动调节的重要调控形式,转录组测序则是了解植物基因总体表达情况的强大工具。目前,高通量转录组测序技术已经在植物响应生物及非生物胁迫的机制研究中得到了广泛的应用[18-20],一大批涉及防御、物质运输、信号转导及次生代谢的基因得到鉴定,对于揭示植物抗逆的分子机制起到了很大的推动作用。
花烟草(Nicotiana alata)是属于茄科烟草属的一年生野生草本植物,由于其花色艳丽多样、花期较长,在园林绿化中得到了较多的应用。然而,土壤盐渍化也严重影响了花烟草的正常生长。目前,对花烟草盐胁迫响应的相关研究尚不多见。
本研究采用转录组测序(RNA-Seq)技术,分析花烟草响应盐胁迫的基因的表达特性,重点挖掘与分析了ROS清除的相关基因,以期为花烟草耐盐的分子机制的研究,以及耐盐花烟草品种的选育提供参考。
1 材料与方法
1.1 材料
以花烟草(Nicotiana alata)为试验材料,由四川农业大学烟草实验室提供。
1.2 方法
1.2.1 材料处理及转录组测序 幼苗材料培养:挑选籽粒饱满且大小一致的种子,用次氯酸钠溶液表面消毒后,用无菌水清洗数次,随后播种于MS培养基上,并置于恒温培养室中生长(光照:16 h光/8 h暗;温度:25℃)。
盐胁迫处理及总RNA提取:待烟苗生长4周后,挑选36株长势一致的烟苗,分为3组,每组烟苗为1个重复,每重复12株烟苗。在无菌操作台中,将其分别移苗至含有200 mmol/L NaCl的MS培养基上,然后,继续在恒温培养室中进行培养(光照:16 h光/8 h暗;温度:25℃)。在处理0 h和12 h后,按重复进行整株取样,并置于液氮中保存,用于总RNA的提取。参照鲁黎明等[21]方法提取总RNA,并经紫外分光光度计和琼脂糖凝胶电泳检测合格后,送北京诺禾致源科技公司进行转录组测序。
1.2.2 测序数据的分析及功能注释 对测序所获得的原始数据,按照诺禾致源公司的数据处理方法,进行原始数据的过滤,获得高质量的clean reads,并进行后续分析。采用BLAST软件,在NCBI的non-redundant(NR)、UniProt/ Swiss-Prot、Gene Ontology(GO)、KEGG(Kyoto Encyclopedia of Genes and Gnomes)等数据库进行比对,并进行差异基因的功能注释、GO及KEGG分析。
差异基因(Differentially expressed genes,DEGs)的筛选条件为P-value≤0.01,| log2Fold Changes|≥1。其中,Fold Changes代表不同处理之间基因表达量的比值。该值大于1时,则该基因认定为上调表达;反之,则为下调表达。
1.2.3 差异表达基因的验证 为了对转录组测序的结果进行验证,随机挑选8个基因,并利用Primer 5.0软件设计扩增引物(表1),采用qPCR的方法,对其表达水平进行验证。将各处理的样品总RNA反转录合成cDNA,以此为模板,进行qPCR反应,内参为β-actin。qPCR的反应体系、反应程序以及基因相对表达量的计算均参照鲁黎明等[21]方法进行。

表1 qPCR反应所用引物
2 结果
2.1 测序质量分析
采用高通量测序平台,对低温处理组及对照组的样品进行了RNA测序。结果显示,共获得47 599 094-62 591 696 clean reads(表2)。就每个样品的GC含量来看,其含量为42.97%-43.19%,偏差很小,而且基本呈随机分布,且Q30的数值均大于90%,说明本次测序的质量非常可靠。
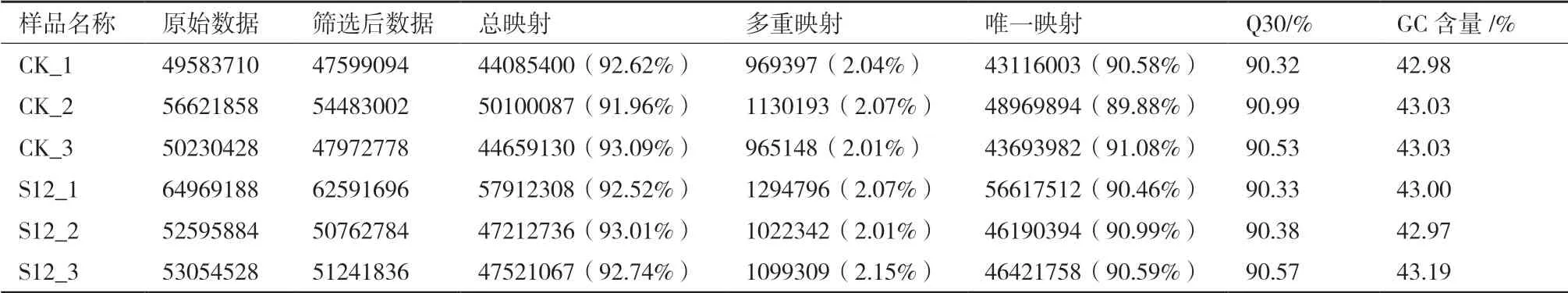
表2 各样品测序质量
通过对样品重复间数据的相关性分析,结果(图1)表明,重复之间的决定系数R2最低为0.962,最高则达到了0.978,说明重复之间数据的重现性较好,可用于下一步的分析。
2.2 差异表达基因统计分析
将盐胁迫处理12 h与0 h样品的转录组数据进行对比分析,以|log2fold changes|≥1,以及P-value≤0.01为筛选条件,筛选差异表达基因。结果表明,高盐(200 mmol/L NaCl)处理12 h后,差异表达基因的数量达到了7 239个,其中,上调表达基因4 077个,下调表达基因3 162个。
2.3 差异表达基因的GO功能注释分析
对差异基因所进行的GO分析结果显示,上调差异表达基因的功能主要集中于生物过程(Biological process)、细胞组分(Cell component)以及分子功能(Molecular function)方面。在生物过程中,差异表达基因所富集的GO的数目达108个;细胞组分以及分子功能则分别富集到7和32个GO条目(P-value≤0.01)。下调差异表达基因富集到12个GO条目,涉及到生物过程及分子功能2个部分。
2.3.1 上调差异表达基因富集的GO 在上调差异表达基因所富集的108个GO中,差异表达基因数量超过500个的有19个GO条目。其中,Biological process最大,包括差异表达基因4 585个(76.97%),其次为Metabolic process,包括3 660个差异表达基因(61.31%)。富集上调表达基因数目较多的属于Biological process的前30个GO条目的具体信息见表3。
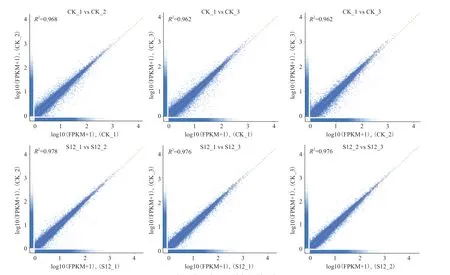
图1 样品各重复之间的相关性分析
富集到Cell component部分的差异表达基因,可以归为7个GO条目,分别为Membrane(1 747,29.26%)、Photosystem(94,1.57%)、Oxidoreductase complex(48,0.80%)、Photosystem I(30,0.50%)、Chloroplast(29,0.49%)、Plastid(29,0.49%) 和Photosystem II oxygen evolving complex(25,0.42%)。其中,有48个上调差异表达基因与氧化还原酶蛋白复合体的形成有关。
在分子功能方面,上调差异表达基因富集到32个GO条目,其中,催化活性(Catalytic activity)基因数目最多(3 314,55.51%),其次为氧化还原酶活性(Oxidoreductase activity)基因(852,14.27%)(表4)。值得注意的是,参与氧化还原酶活性的差异基因达1 520个,占比25.46%。
2.3.2 下调差异表达基因富集的GO 盐胁迫下,烟草显著下调表达的基因主要富集在生物过程(Biological process)与分子功能(Molecular function)(表5)。前者包括5个GO条目,290个基因;后者则含有7个GO条目,270个基因。生物过程的5个GO条目,全部与离子的转运有关;分子功能的GO条目包括离子转运活性及氧化还原活性两类。此结果显示,花烟草在遭受高盐逆境时,其显著下调表达基因的数目及富集到的GO数目,均远远低于上调基因。说明花烟草在响应高盐胁迫时,是以上调表达基因所参与的生理过程为主,同时也暗示,其离子转运及氧化还原的生理过程可能发挥较为关键的作用。
2.4 差异表达基因的KEGG通路分析
通过对差异表达基因进行KEGG通路分析(图2)。上调差异表达基因显著富集到7条主要的代谢通路(q value ≤0.05)。富集因子最高的为Glycerolipid metabolism途径,其次为Glycolysis/ Gluconeogenesis和Carbon fixation in photosynthetic organisms途径。而富集差异基因最多的途径为Biosynthesis of secondary metabolites,富集到543个差异表达基因,其次为Carbon metabolism途径,有162个差异表达基因被富集到该途径。

表3 上调差异表达基因的GO功能注释分析(生物过程)
下调差异表达基因显著富集的通路数量只有5条(q value≤0.05),其中,富集因子最高的通路为Circadian rhythm-plant。在富集基因的数量方面,这5条通路所富集差异表达基因的数量,较上调基因少了很多。富集下调差异基因最多的通路为Pyrimidine metabolism,仅仅富集了58个基因。其次,为Ribosome biogenesis in eukaryotes途径,富集的差异表达基因数为57个。
从富集差异表达基因的代谢途径数量的角度也可以看出,高盐处理后,花烟草代谢途径中,上调基因富集的代谢途径数量远远高于下调基因。从而在某种程度上说明,花烟草在遭受高盐胁迫后,其生理响应过程主要以上调相关基因的表达为主。
2.5 花烟草响应高盐胁迫的抗氧化基因分析
植物在遭受高盐、干旱等非生物及生物胁迫时,均会产生ROS,过量的ROS会对细胞的正常生命活动造成阻遏。因此,细胞会动员其抗氧化系统来清除这些ROS。为了探索花烟草抗氧化系统关键基因的表达对高盐胁迫的响应,分析了差异表达基因中SOD、POD、CAT等7类ROS清除基因的表达。结果表明,在花烟草受到高盐胁迫后,共有45个ROS清除相关基因的表达发生了显著改变,其中,上调表达基因28个,下调表达基因17个。上调表达的倍数最小为1.10倍(GST),最高为3.10倍(CAT);下调表达的倍数最小为1.14倍(GST),最高为3.32倍(POD43)。上调表达基因中,数量最多的为GST(16),其 次 为POD(5)、SOD(4)、CAT(2)和GPX(1)(图3)。下调表达基因中,数量最多的为GST(6),其次为POD(5)、SOD(2)、GPX(2)、APX(1)和GR(Glutathione reductase,2)。综上所述,花烟草在高盐胁迫下,其抗氧化的机制主要是上调抗氧化基因的表达,以启动相应的生理反应,从而抵御不利的环境。
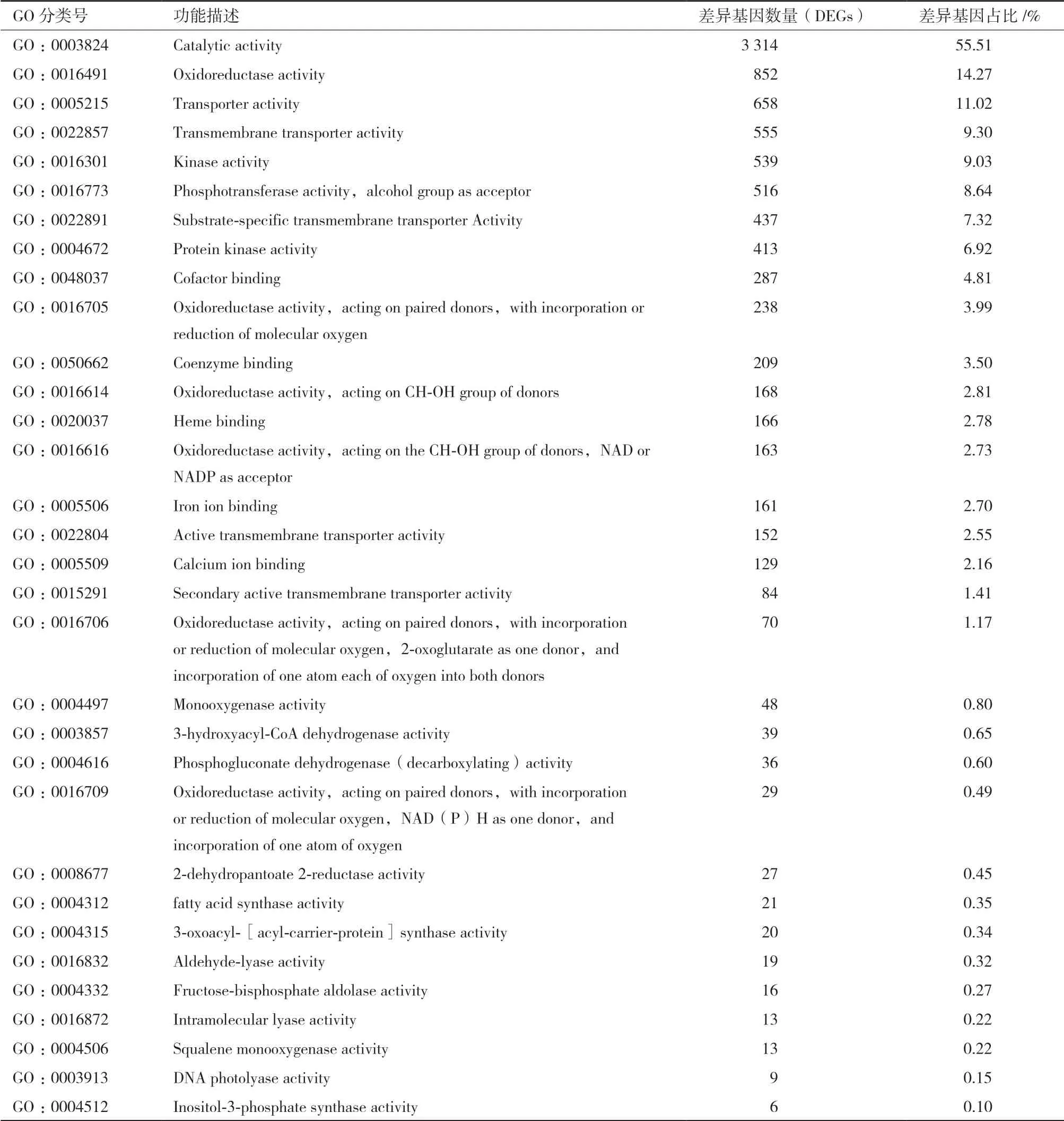
表4 上调差异表达基因的GO功能注释分析(分子功能)

表5 下调差异表达基因的GO功能注释分析
2.6 qRT-PCR验证
为了验证RNA测序结果的可靠性,随机选取了POD42、GST1、CAT1、CIPK11、ERF4、GPX4、MYB5和CIPK6等8个基因进行qPCR扩增,并与其测序结果进行对比(图4)。从图4可以看出,2种方法中,所选择的8个基因的表达趋势一致,从而说明本研究RNA测序结果较为可靠,同时也表明,对RNA测序结果所做的相关分析较为客观。
3 讨论
盐渍化是植物在生长过程中所遭受到的主要的环境胁迫之一。在高盐胁迫下,植物细胞会对自己的生理活动进行调节,以抵御其对植物生长的影响。其中,活性氧清除系统对盐胁迫所诱导产生的ROS的清除,是主要的生理响应过程[4]。高等植物的酶促活性氧清除系统主要包括SOD、POD、CAT、APX、GPX、GST及GR等,其主要的功能,就是将盐胁迫下在叶绿体、线粒体等细胞器中产生的过量的ROS进行还原,以降低其产生的危害。在本研究中,花烟草在盐胁迫下,有7类共45个活性氧清除基因的表达发生了显著变化(P <0.05),暗示盐胁迫将导致花烟草众多的生理进程发生改变。
3.1 SOD、POD和CAT
SOD、POD及CAT是植物最为常见的ROS清除酶类。在逆境胁迫下,植物编码这3类酶基因表达的提高,酶活性的增强,对ROS的清除能力也大幅度提升,从而提高了植物对不良环境的抵御能力[4]。研究表明,抗盐能力较强的基因型,其抗氧化的能力也强,在遭受高盐胁迫时,其长势及生物量均较不耐盐的基因型有较大的优势[1]。同时,当SOD、POD和CAT在植物中过表达时,转基因植株的耐盐能力均显着增强[8-13]。在本研究中,当花烟草面临高盐胁迫时,编码SOD、POD及CAT 3个酶类的11个基因的发生了显著的上调表达变化。其中,上调表达最高为3.1倍(CAT)。揭示花烟草响应盐胁迫过程中,SOD、POD和CAT发挥着十分重要的作用,其中,CAT的作用值得关注。
然而,在本研究中,也有5个编码POD的基因及2个编码SOD的基因发生了下调表达。这种现象产生的意义需要进一步的研究,同时,此结果也说明,花烟草对盐胁迫的响应,可能存在正向与负向两种调控方式,其中,正向调节作用可能占主导地位。
3.2 APX与GPX
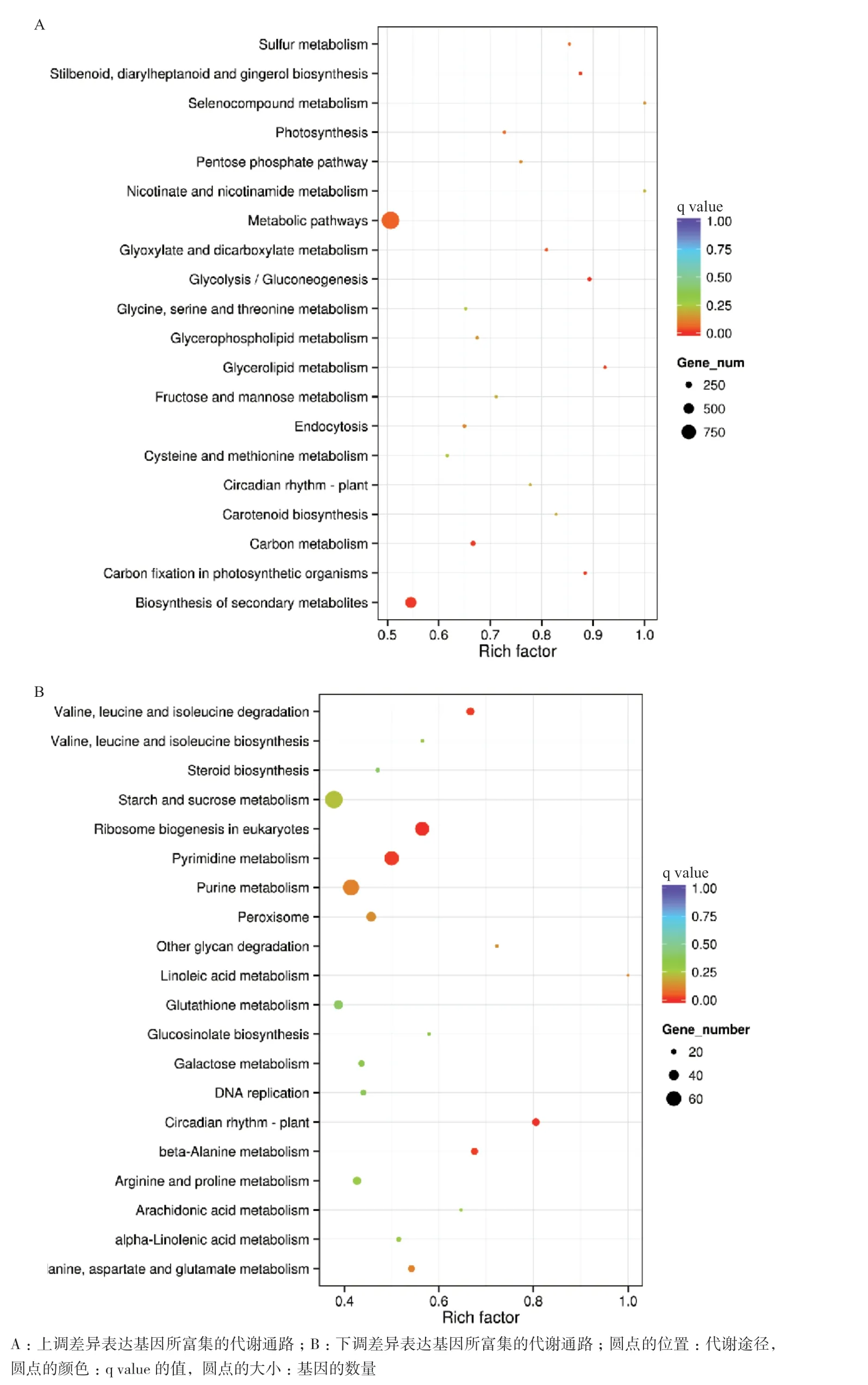
图2 差异表达基因的KEGG分析
抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)及谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)是2个构成植物抗氧化系统的关键酶类。APX是一类在高等植物中广泛存在的亚铁血红素蛋白,包括了4个不同的亚型,即叶绿体APX(sAPX)、类囊体APX(tAPX)、微体APX(mbAPX)和胞质APX(cAPX)[22]。APX的表达受生物及非生物胁迫因子的广泛诱导。研究表明,在盐胁迫下,碱蓬的SsAPX[23]及白桦的APX[24]的表达均显着升高;拟南芥APX[25]及枣树ZjAPX[26]的过表达,则显著增强了转基因植株的耐盐能力。

图3 花烟草响应高盐胁迫的抗氧化基因
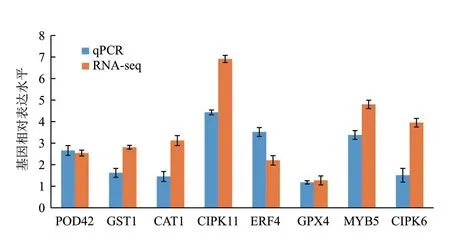
图4 RNA测序与qPCR基因表达水平的比较
GPX也是细胞ROS清除的重要酶类,同样是由多个同工酶组成的大家族。GPX能够有效地清除细胞过氧化物,防止ROS对细胞的伤害,并因而在植物生长发育及逆境胁迫响应中发挥重要作用[27]。例如,衣藻(Chlamydomonas)GPX[28]、小麦GPX[29]的过表达,均增强了转基因植株对盐、低温的耐受能力。然而,植物GPX的表达较为复杂,在大多数情况下,GPX以上调表达的方式参与环境胁迫的响应[27],但高粱(Sorghum bicolor)的SbGPX6与SbGPX7[30],在干旱胁迫下却是下调表达。
以上结果均表明,APX与GPX均参与了植物对盐胁迫的响应。在本研究中,花烟草在盐胁迫下,有1个GPX上调表达了1.27倍,另外2个GPX及1个APX均为下调表达。揭示花烟草APX及GPX参与盐胁迫响应有自己的特点,而且可能主要是负向调控方式。
3.3 GST
谷胱甘肽-S-转移酶(GST)也是由多基因编码的基因家族,其功能较为广泛,参与了细胞的解毒、抗氧化、信号转导等过程,因而在植物的生长发育及逆境胁迫响应中发挥重要的作用[31]。研究表明,植物的GST参与了高盐、低温、干旱、UV及ABA等多种非生物胁迫的响应[32]。例如,拟南芥AtGSTU19参与了植物的抗旱与抗盐胁迫[33];过表达烟草[34]及碱蓬[35]的GST,能够显著增强转基因植物的耐盐能力。然而,GST参与植物的逆境胁迫响应的方式较为复杂,如AtGSTU17可能作为负调节因子,参与了拟南芥对干旱和盐胁迫的应答反应,其较低的表达量或基因敲除有助于拟南芥抗性的提高[36]。
本研究也得出了类似的结果,在高盐胁迫下,花烟草22个GST的表达显著增强,其中,有16个显著上调(最高2.81倍),6个则显著下调(最高2.22倍)(图3)。表明在花烟草的高盐胁迫应答中,GST占有举足轻重的地位,同时,其不同成员间发挥作用的机制可能并不相同。
3.4 GR
谷胱甘肽还原酶(GR)与GST和GPX共同构成了谷胱甘肽循环的重要组件,并且在ROS清除机制中发挥重要作用[31]。GR的基本功能是催化还原型谷胱甘肽(GSH)的合成,维持细胞内的较高水平的还原力;同时,GR还能够与SOD等酶系统共同作用,清除细胞内多余的ROS[37]。所以,GR活性的增强,有利于植物抗氧化能力的提升,并最终提高了植物对生物及非生物逆境胁迫的抵御能力。植物GR在盐胁迫应答中的功能研究报道尚不多见,已有的研究表明,在盐胁迫诱导下,水稻的GR3[38]、茶树CsGR1[39]、油菜的GR2[40]、麻风树(Jatropha curcas)JcGR[41]等基因的表达明显升高;而水稻GR3的敲除,则导致了突变体对盐胁迫的敏感[42]。但是GR对胁迫的应答的方式并不相同,如在盐胁迫下,茶树的CsGR2则显著下降[39]。与此相类似,花烟草在高盐环境下只有1个GR发生了下调表达(下调1.33倍)(图3),说明在花烟草的盐胁迫响应中,GR也可能发挥着一定的作用,其作用的机制有待于进一步的探索。
4 结论
在盐胁迫下,花烟草大量的基因发生了显著的差异表达。这些差异表达基因的功能,主要集中在生物过程及金属离子转运等方面。其中,有7大类45个活性氧清除相关基因的表达模式变化明显。本研究的结果说明,花烟草通过改变自身众多的生理进程,以适应外界的盐胁迫环境。其中,增强对盐胁迫所产生的活性氧的清除能力,是花烟草抵御盐胁迫的主要机制之一。

