一株猪蓝耳病毒的分离鉴定及其全基因组序列的比较分析
罗修鑫张华伟郝根喜曾小燕周明光徐高原
(武汉科前生物股份有限公司,武汉430070)
猪蓝耳病(PRRS)能够引起母猪流产、木乃伊胎、死产和所有猪呼吸系统疾病[1]。 从20 世纪80 年代传播以来给世界养猪业带来了巨大的经济损失[2]。 猪蓝耳病毒(PRRSV)是引起PRRS 的病原,属于正链RNA 病毒,动脉炎病毒科[3]。 PRRSV基因组大概有15 kb,至少有八个ORF:ORF1a、ORF1b 和ORFs2 -7[4]。 ORF1a 和ORF1b 编码多聚蛋白,可以裂解成非结构蛋白(Nsps):Nsp1α,Nsp1β 和Nsp2 -12[5],ORFs2 - 7 编码结构蛋白GP2、GP3 -5、M 和N[6]。 PRRSV 分成两个基因型:欧洲型(代表毒株Lelystad virus,LV)和美洲型(代表毒株VR-2332),可以引起相似的临床症状和病理变化[7-8]。
自从1996 年我国分离出PRRSV,该病毒就广泛存在我国猪场并引起PRRS,2006 年变异的高致病性PRRSV(HP-PRRSV)在中国南方爆发PRRS,引起高热、高发病和高死亡[9-10]。 该病毒的典型特征是在Nsp2 区域有30 个氨基酸缺失。 尽管有减毒活疫苗控制HP - PRRSV,但仍有不同的HP -PRRSV 变异毒株被发现[11]。 2008 年美国国家动物疾病研究中心(NADC)首次分离并命名NADC30毒株,其病毒基因组特征与VR -2332 毒株相比,Nsp2 存在131 个不连续的氨基酸缺失,缺失模式为“111 +1 +19”。 2012 年开始,我国分离到了与美国NADC30 毒株同源性很高的毒株,到2014 年,NADC30 毒株呈现加剧的趋势,我国东北和华中地区分离到了NADC30 毒株[12],增加了我国PRRSV的复杂性和遗传多样性。 目前,我国PRRSV 基因突变率高引起更多新的突变毒株产生,主要流行的美洲型毒株可以分成以JXAI、CH - 1a、GM2、NADC30 和VR -2332 为代表的5 个亚型[13-16]。我国PRRSV 的重组可以在野毒之间或者野毒和活疫苗毒株之间发生,进一步增加了病毒的多样性。目前这样的重组毒株有NADC30 类和JXA1 类重组(HENAN-HEB、JL580、HNhx、TJnh1501 和FJ140)等。 本研究从湖北某免疫过HP -PRRSV 疫苗的发病猪场采集病猪肺组织分离出病毒(CH-WH-19),通过设计12 对引物测出其全基因组序列并进行生物学特征分析。
1 材料与方法
1.1 试验病料 采自疑似猪繁殖与呼吸综合征的湖北某猪场发病猪的血液及淋巴结、肺脏、脾脏、肾脏等组织。
1.2 主要材料和试剂 Marc -145 细胞由实验室冻存。 DMEM 购自Gibco 公司;胎牛血清购自金源康公司;rTaq DNA 聚合酶Mix 和反转录酶均购自宝生物。
1. 3 引物设计 根据GenBank 上已发表的PRRSV 全基因序列设计12 对引物(表1)用于交叉扩增CH-WH-19 株全基因组。
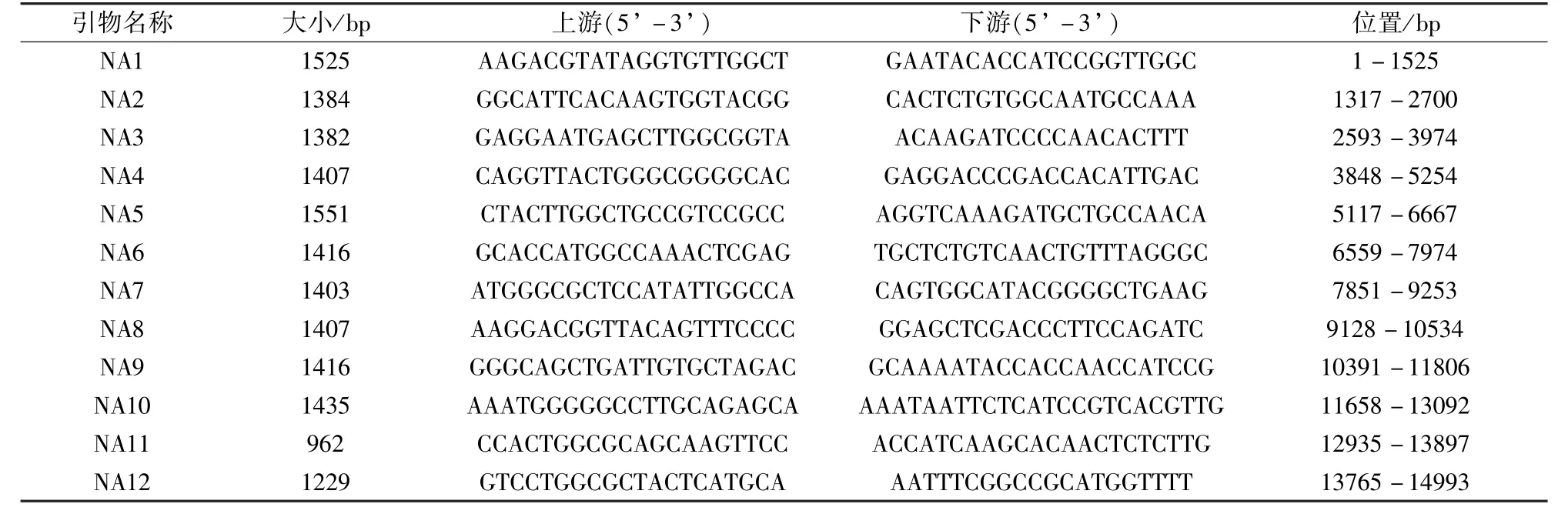
表1 CH-WH-19 株全基因组扩增引物表Tab 1 Full-length genomic sequencing primers of CH-WH-19
1.4 病毒的分离与培养 采集病猪的肺脏用灭菌的生理盐水进行研磨,-80 ℃反复冻融3 次,12000 r/min 离心5 min,取上清,用0.22 μm 的过滤器进行过滤除菌。 将已长成单层的Marc -145 细胞,弃去培养液,用PBS 缓冲液清洗一次,接种1 mL 已融化的滤液,同时设正常Marc -145 细胞为空白对照,置培养箱中吸附1 ~2 h 之后取出培养瓶弃滤液,加5 mL 含2%胎牛血清的DMEM 维持液,于37 ℃5% CO2细胞培养箱中培养3 d,每天观察细胞的状态,及时收集病变细胞。
1.5 RNA 的提取及反转录 RNA 的提取按照RNA提取试剂盒说明书进行操作。 反转录体系为:5 × PrimeScript RT Master Mix 4 μL,模板16 μL,37 ℃15 min。 通过12 对重叠的引物扩增CH-WH-19 全基因组序列。
1.6 全基因组的测序比对分析及进化树分析 通过BioEdit 和MegAlign 软件比对分析序列,用MEGA7 中的N-J 法制作进化树。
2 结果与分析
2.1 病毒的分离结果 从临床收集疑似PRRSV 的56 份病料分离17 株PRRSV,扩增GP5基因测序并进行进化树分析,结果表明PRRSV-17处于NADC30 - like 毒株分支(图1),将其命名CH-WH-19,测其TCID50为106.5/mL。
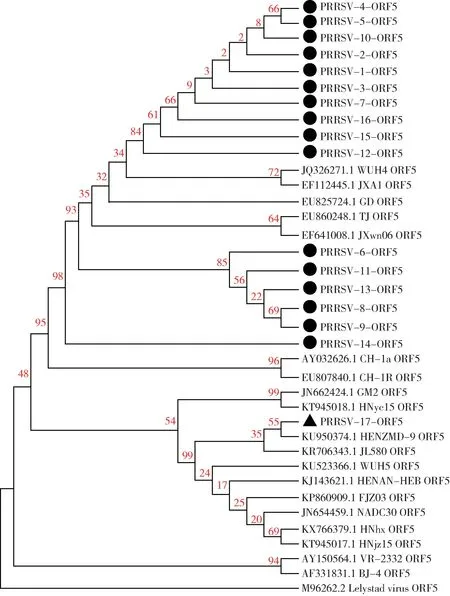
图1 分离的17 株PRRSV GP5 基因进化树分析Fig 1 Phylogenetic analysis of 17 isolated PRRSV based on GP5
病毒分离过程中,盲传第三代出现病变,细胞圆缩,聚集,随着培养时间的延长细胞聚集成堆,最后细胞破碎,脱落,用间接免疫荧光检测出现特异的绿色荧光(图2)。

图2 CH-WH-19 株的细胞病变及间接免疫荧光结果Fig 2 CPE and immunofluorescence of CH-WH-19
2.2 基因组特征及同源性分析 CH-WH-19 基因组全长14993 bp,包括5’UTR 189 bp,3’UTR 152 bp 和8 个ORF。 与NADC30、JXA1、CH -1a、VR - 2332 和GM2 的 同 源 性 分 别 为91. 9%、84.3%、83.9%、83.3%和80.5%,但是与欧洲型的毒株Lelystad virus 相似性仅有58.9%(表2),说明分离的毒株属于美洲型。 为了分析分离的新毒株的基因特征,我们分别比较了CH - WH - 19与NADC30、JXA1、CH -1a、VR -2332、GM2 和LV毒株的5’UTR、3’UTR 和8 个ORF 的同源性,结果显示与NADC30 和JXA1 毒株不同ORF 同源性较高,分别是88. 6% ~97. 4%和81. 8% ~94. 7%,与CH-1a 的同源性是80. 5% ~91. 9%,而与GM2 和VR-2332 毒 株 的 同 源 性 较 低 分 别是74.9% ~90.0%和79. 6% ~90. 7% (表2)。CH-WH-19 ORF1a 和ORF1b 的大小分别是7095 bp 和4383 bp,分别与美洲型毒株的同源性是74.9% ~88.6%和86.2% ~94.7%,但与欧洲型LV 毒 株 同 源 性 仅53. 9% 和63. 3% (表2)。CH-WH-19 ORF2 ~ORF7 大约占全基因组的1/4,编码结构蛋白(GP2 ~GP7),其中变异最大的结构蛋白基因ORF2、ORF3 和ORF5 与美洲型毒株的同源性分别是84.3% ~93.9%,82.1% ~94.6%和84.3% ~93.5%(表2)。
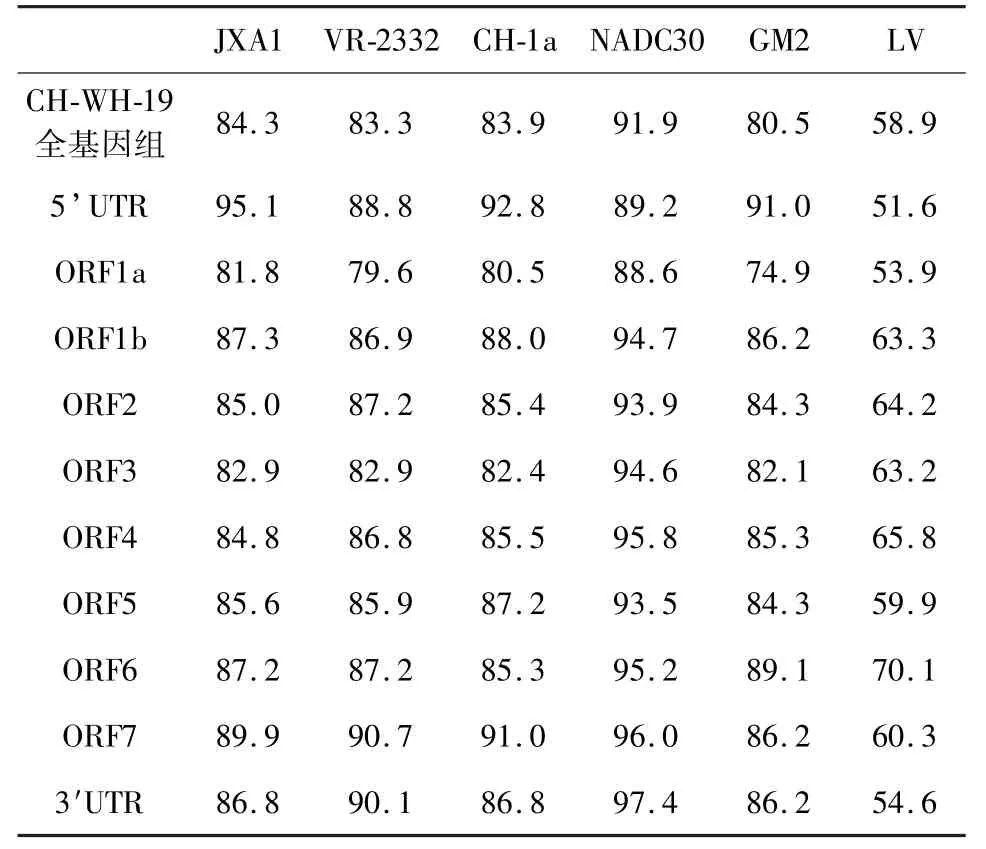
表2 CH-WH-19 与其他毒株的同源性比较Tab 2 Nucleotide identity of CH-WH-19 compared with other strains
2.3 Nsp2 基因分析 NADC30 基因型毒株的基因组特征主要表现为Nsp2 存在“111 +1 +19”个氨基酸缺失,CH -WH -19 毒株与参考毒株的Nsp2 基因氨基酸比对结果显示,CH -WH -19 与NADC30毒株一样分别在322 ~432、481 和530 ~549 的位置出现了“111 +1 +19”个氨基酸缺失(图3)。
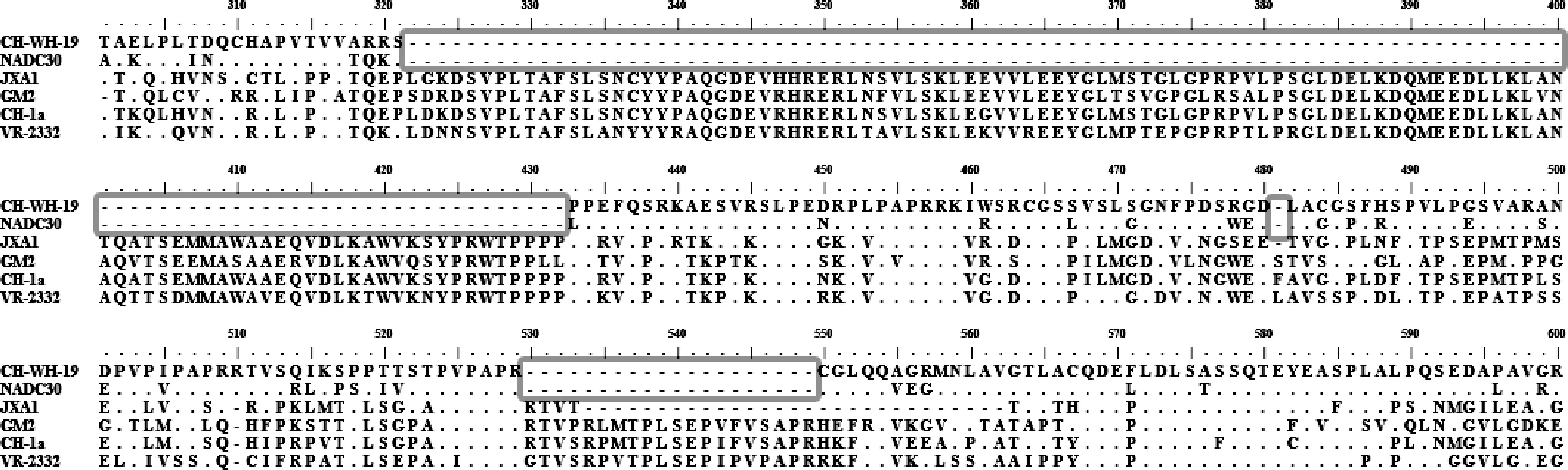
图3 CH-WH-19 与参考毒株部分Nsp2 基因氨基酸比对Fig 3 Alignment of the partial Nsp2 amino acid sequence of CH-WH-19 with reference strains
2.4 ORF5 基因分析 CH -WH -19 毒株与参考毒株ORF5 氨基酸序列比对存在一定的差异(图4)。 CH -WH -19 毒株与参考毒株ORF5 氨基酸序列1 ~26 位置的26 个氨基酸是信号肽,63 ~83、95 ~102 和110 ~127 分别是三个跨膜区(TM1、TM2 和TM3)的位置。 在GP5 蛋白的第13 和151位与毒力相关的氨基酸处,CH -WH -19 在第13位与JXA1、CH-1a 和VR-2332 保持一致(R13),但151 位与NADC30 和GM2 保持一致(K151)。A137 是疫苗株VR - 2332 的标志,但分离的CH-WH-19毒株突变成了S。 N30、N34、N44 和N51 是四个潜在的N -糖基化位点,一些研究表明与病毒感染和抗原特征有关系,CH-WH-19 毒株N34 突变成了D,其他的三个位点很保守。

图4 CH-WH-19 与参考毒株GP5 基因氨基酸序列比对Fig 4 Alignment of GP5 amino acid sequence of CH-WH-19 with reference strains
2.5 进化树分析 为进一步研究CH -WH -19与其他PRRSV 毒株的基因关系制作了全基因组序列的进化树(图5),结果显示所有的全基因组分成两个大分支美洲型和欧洲型,本研究的CH-WH-19和NADC30 处于同一分支,表明CH-WH-19属于NADC30 型毒株。
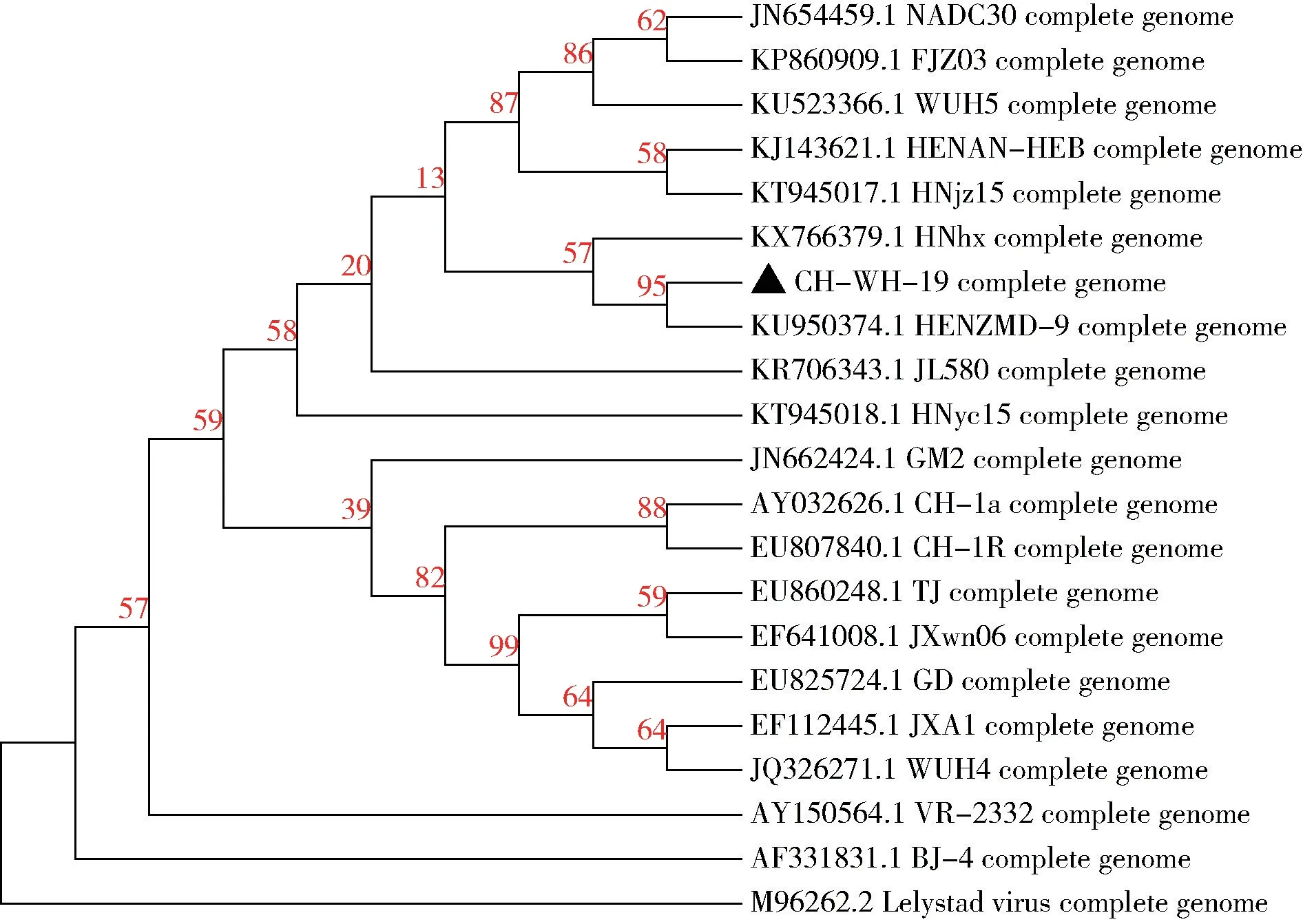
图5 CH-WH-19 和参考毒株全基因组进化树分析Fig 5 Phylogenetic analysis of complete genome of CH-WH-19 and reference strains
3 讨论与结论
自从1996 年中国分离到第一株蓝耳病毒CH1a,猪蓝耳病毒引起猪严重疾病也给我国养猪产业带来严重经济损失。 2006 年,我国南方大面积暴发高致病性猪繁殖与呼吸综合征,至今该病已在全国大范围存在,对我国的养猪业来说更是雪上加霜。 本实验室从湖北某发病猪场分离到1 株PRRSV,命名为CH - WH -19,进行了全基因组测序,并分析它们的基因特征。 同源性分析显示CH-WH-19 与美洲型标准毒株(VR-2332)和欧洲型标准毒株(LV)的相似性分别为83. 3% 和58.9%,说明该毒株属于美洲型毒株。 该毒株与NADC30 型PRRSV 毒株基因序列同源性高达91.9%,且进化树结果显示与NADC30 毒株处于一个分支这都说明CH -WH -19 属于NADC30 型毒株。 CH-WH-19 与参考毒株Nsp2 基因的氨基酸比对发现,与NADC30 毒株一样分别在322 ~432、481 和530 ~549 的位置出现了“111 +1 +19”的氨基酸缺失,也可以推测CH - WH - 19 株属于NADC30 型毒株。
由于PRRSV 引起免疫抑制导致宿主很难彻底清除病毒。 在免疫应答的过程中,PRRSV 为了抵抗机体产生的抗体,就会产生越来越多的变异。 尽管现在有变异的毒株制备的疫苗预防猪蓝耳病,但猪蓝耳病仍然在不同的猪场流行,可能是由于PRRSV 易突变引起PRRSV 致病性的改变,因此蓝耳病毒的分离与基因分析仍然很重要。 本研究分离的CH -WH -19 株属于NADC30 型PRRSV,目前还没有出现NADC30 型的变异株疫苗,因此,本研究可为猪蓝耳病新疫苗的研发提供基础材料。

