白英质量标准初步研究
陈锡龙,钱莘莘,孙真峥,王培峰,焦贵怀,郭 萍,周艺林,赵 贵
(贵州省兽药饲料检测所,贵阳550003)
白英(Solanum lyratumThunb)为茄科植物白英的全草,俗称白毛藤,性微寒,味苦,具有清热解毒,袪风除湿等功效[1],用于治疗感冒发热、黄疸型肝炎、肾炎水肿、子宫颈糜烂、癌症等疾病。 尤其对肺癌、胃癌、肝癌、宫颈癌等多种癌症具有很好的疗效[2]。 化学及现代药理研究表明[3],白英主要含皂苷类、甾体类化合物、有机酸、黄酮类等,是白英药理作用的主要有效成分。 近年来,有关白英的研究主要集中在其抗肿瘤机制方面,如生物碱对人宫颈癌HeLa 细胞增殖的抑制作用[4]、抑制人神经瘤母细胞系SH-SY5Y 细胞氧化活性[5]、影响肝癌Huh-7 细胞p38 和Caspase-3 的表达[6],白英提取物具有抑制肿瘤细胞增殖的活性,能诱导肿瘤细胞凋亡[7]等。 白英是临床上应用较广泛的抗肿瘤中草药,需求量大,但对白英质量控制研究仍处于初步阶段[8]。 齐伟等[9]建立了HPLC 法同时测定白英中绿原酸和咖啡酸的含量,林世和[10]等建立了HPLC 法同时测定白英叶中绿原酸、咖啡酸及芦丁的含量,孙立新[11]等建立了HPLC 法测定中药白英中薯蓣皂苷元的含量,为白英质量标准的建立做了一些基础性工作。 白英未收载入现行《中国药典》中,虽收载于《兽药质量标准》(2017 版中药卷)[12]中,主治外感风寒,湿热黄疸,水肿,帯下;外治痈疮肿毒。 但项下仅有性状及鉴别,已经不能满足越来越多的临床应用及质量控制需要。 本研究对上述文献中测量白英新鲜药材和饮片中绿原酸、咖啡酸的HPLC 法进行了验证及比较,发现白英新鲜药材和饮片中绿原酸的含量变化太大,不宜作为控制白英的质量指标;同时,借鉴了相关白英质量标准中的薄层色谱鉴别方法等,较全面地建立了白英显微、薄层鉴别,水分、灰分检查,醇溶性浸出物以及药材中咖啡酸含量测定方法,以期为白英的质量控制提供科学依据。
1 仪器和试药
1.1 仪器 Agilent infinity LC1260 高效液相色谱仪(配紫外检测器);BP211D 型电子分析天平(德国塞多利斯公司)。
1.2 试药 绿原酸对照品,中国兽医药品监察所,批号:Z0261702,含量:98.3%;咖啡酸对照品,中国食品药品检定研究院,批号:110885 -200102,含量:100%;薯蓣皂苷元对照品,中国食品药品检定研究院,批号:111539 -200001。 共收集到白英原生药材及饮片15 批。 其中自行采集到原生药6 批(所采集的药材除少部分制成标本供鉴别用外,其余部分均干燥粉碎后置磨口玻璃瓶中保存),5 批采自贵州省安顺市平坝县,1 批采自浙江省金华市,经贵州中医药大学中药资源教研室魏升华教授鉴定均为白英。 9 批饮片分别购于北京市、广西玉林、贵阳市的药材公司,详情见表1。 甲醇为色谱纯;水为纯净水;其他试剂均为分析纯。

表1 白英来源登记表Tab 1 Registration information of 15Solanum LyratumThunb. samples
2 方法与结果
2.1 性状 本品长1 ~4 cm,全株被毛,幼枝及叶上尤多。 根较细,稍弯曲,浅棕黄色。 茎圆柱形,稍有棱,灰绿色或灰黄色。 叶互生,叶片皱缩,易碎,完整者展平后呈长卵形,长3 ~8 cm,宽1 ~3. 5 cm;先端渐尖,基部心形,全缘或下部2 浅裂至中裂,裂片耳状或戟状;上表面棕绿色,下表面绿灰色;叶柄长2 ~4 cm。 聚伞花序与叶互生,花序梗折曲状,花冠5 裂,长约5 mm,棕黄色。 浆果球形,直径约1.2 cm,绿棕色至红黑色,果皮薄,稍有光泽。种子扁圆形,直径1.5 mm,气微,味淡。
2.2 鉴别
2.2.1 显微鉴别 本品粉末灰绿色。 石细胞淡黄色,类圆形、类方形、长条形,直径18 ~35 μm,长45~130 μm,纹孔小,孔沟明显。 纤维淡黄色或近无色,长梭形,末端斜尖。 叶表皮细胞壁波状弯曲,内含草酸钙方晶及砂晶,气孔不定式。 非腺毛单细胞,完整者长150 ~500 μm,直径18 ~30 μm。
2.2.2 薄层鉴别 称取本品粉末2.5 g,置250 mL具塞锥形瓶中,加入水13 mL,甲醇70 mL,再加入盐酸17 mL,水浴加热回流3 h,冷却,过滤,取续滤液50 mL,用石油醚(60 ~90 ℃)萃取4 次,每次50 mL,分取石油醚层,回收石油醚层至干,加3 mL甲醇溶解,滤过(0.45 μm),作为供试品溶液。 另取薯蓣皂苷元对照品适量,加甲醇制成每1 mL 含1 mg的溶液作为对照品溶液。 照薄层色谱法试验,吸取上述两种溶液各5 μL,分别点于同一硅胶G 薄层板上,以环已烷-乙酸乙酯(2∶1)作为展开剂,展开,取出,晾干,喷以10%的硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。 供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点(图1)。
2.2.3 样品检测 用新建立的方法分别对编号为1 ~15 号白英新鲜药材或饮片样品行薄层色谱鉴别试验,结果如图1。 结果表明:白英新鲜药材或饮片色谱中,在与薯蓣皂苷元对照品色谱相应的位置上,显相同颜色的斑点。
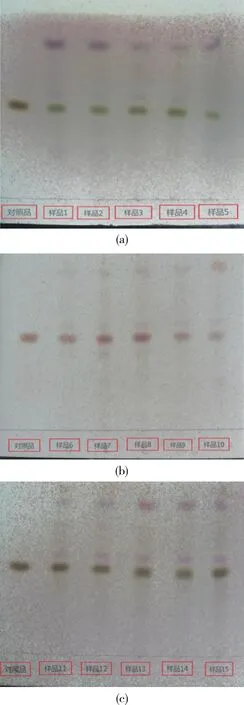
图1 白英及其饮片中薯蓣皂苷元的薄层色谱图Fig 1 TLC chromatograms of diosgenin in raw material and decoction pieces of Solanum Lyratum Thunb.
2.3 检查
2.3.1 水分 照水分测定法(《中国兽药典》2015年版二部附录0832 第一法[13])测定不同产地13批样品的含水量分别为8.71%、7.12%、5.52%、4.60%、4.60%、4.90%、5. 44%、6. 11%、8. 92%、7.60%、3.44%、2.88%、2.94%。 平均值为5.6%,以120%计水分应为7.0%,故规定水分不得过7.0%。
2.3.2 总灰分 照总灰分测定法(《中国兽药典》2015 年版二部附录2302[13])测定不同产地13 批样品的总灰分分别为9. 42%、9. 78%、5. 82%、6.87%、12.20%、6.22%、5.94%、4.84%、5.24%、8.54%、5.48%、7.58%、8.00%。 平均值为7.4%,以120%计水分应为9.0%,故规定总灰分不得过9.0%。
2.4 醇溶性浸出物 照醇溶性浸出物测定法(《中国兽药典》2015 年版二部附录2201[13])测定,13 批不同产地样品的醇溶性浸出物分别为4. 64%、5.68%、9.29%、6.56%、7. 35%、4. 47%、3. 72%、3.66%、3.78%、5.78%、5.37%、4.72%、4.24%。平均值为5.3%,以80%计水分应为4.0%。 故规定醇溶性浸出物不得少于4.0%。
2.5 绿原酸、咖啡酸含量测定
2.5.1 溶液的制备
2.5.1.1 对照品贮备溶液的制备 取绿原酸和咖啡酸对照品适量,精密称定,分别用75%的乙醇溶液制成每1 mL 含1.0 mg 的溶液,即得。
2.5.1.2 标准曲线的制备 分别精密量取上述对照品贮备溶液适量,逐级稀释成每1 mL 含绿原酸5.0、20、50、200、1000 μg 和咖啡酸2.0、5.0、10.0、20.0、50.0 μg 的混合对照品溶液系列,精密吸取各对照品溶液5 μL,注入液相色谱仪,记录色谱图。分别以绿原酸和咖啡酸色谱峰面积为纵坐标,其相应浓度为横坐标,绘制标准曲线。
2.5.1.3 供试品溶液的制备 取本品粉末约1.0 g,置250 mL 具塞三角瓶中,精密加入75%乙醇溶液10 mL,混匀,密塞,超声处理30 min,取出,放冷。过0.45 μm 滤膜,滤液作为供试品溶液。
2.5.2 测定方法
2.5.2.1 色谱条件 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以0.4%磷酸溶液-乙腈(87∶13)为流动相;检测波长为327 nm。 在此色谱条件下,绿原酸、咖啡酸对照品混合溶液及供试品溶液高效液相色谱图见图2。
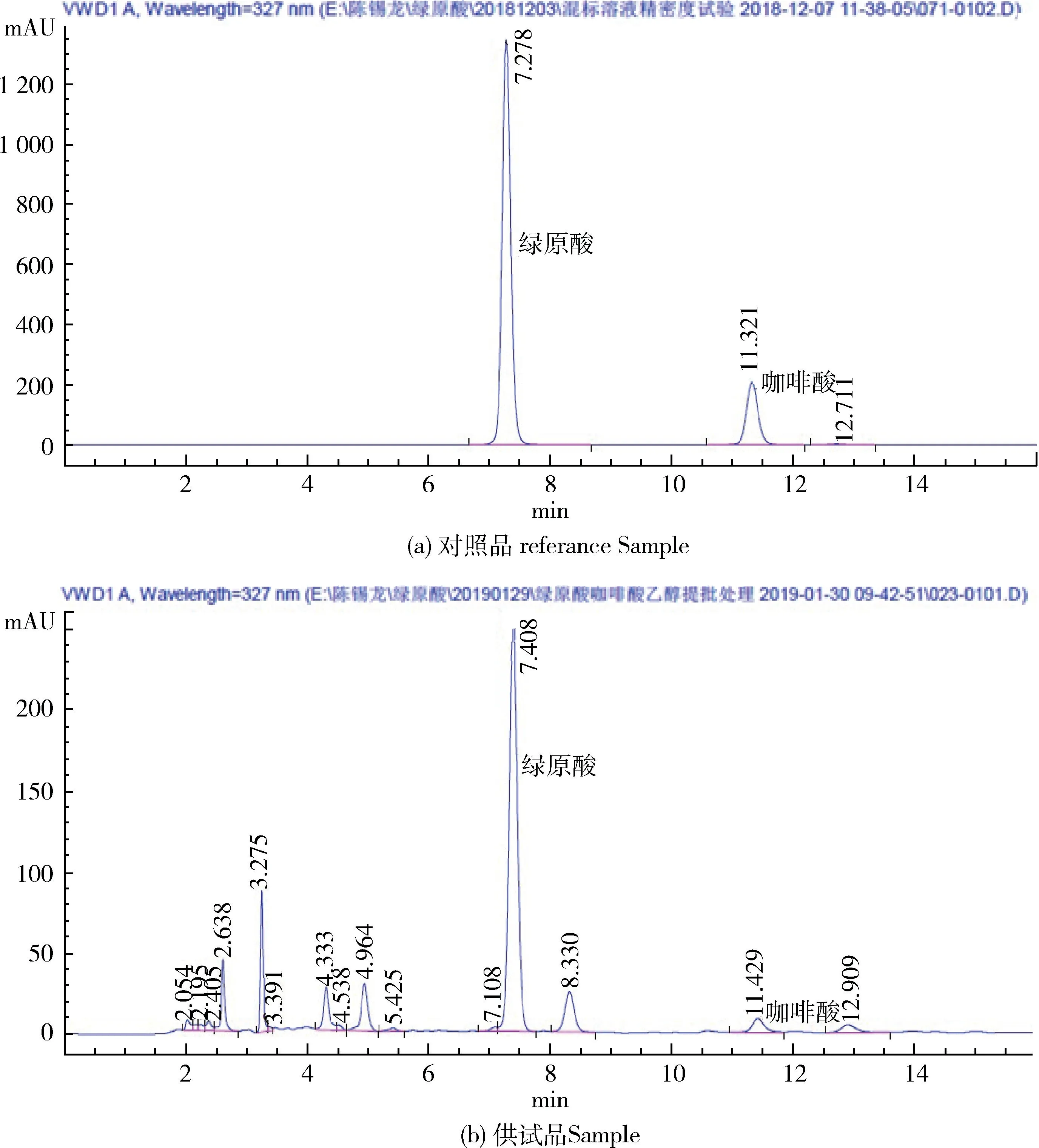
图2 绿原酸和咖啡酸混合对照品溶液及供试品溶液高效液相色谱图Fig 2 HPLC chromatorams of chlorogenic acid and caffeic acid in referance substance andSolanum LyratumThunb. sample
2.5.2.2 线性及范围 分别精密称取绿原酸及咖啡酸对照品约10 mg(实际称量10.17、9.99 mg),各置于一10 mL 量瓶中,加75%的乙醇溶液溶解并稀释至刻度,得含绿原酸和咖啡酸对照品浓度均为1.0 mg/mL 的对照品贮备溶液,用该两个对照品贮备溶液配制成含绿原酸浓度为5. 0、20、50、200、1000 μg/mL,咖啡酸浓度为2.0、5.0、10、20、50 μg/mL的混合对照品溶液系列,精密吸取各对照品溶液5 μL,注入液相色谱仪,记录色谱图。 分别以绿原酸或咖啡酸色谱峰面积(Area), 对其相应浓度(Amt, μg/mL)进行线性回归,求得回归方程,可知绿原酸在5. 0 ~1000 μg/mL、咖啡酸在2. 0 ~50 μg/mL内线性关系良好。 相关数据分别见表2。
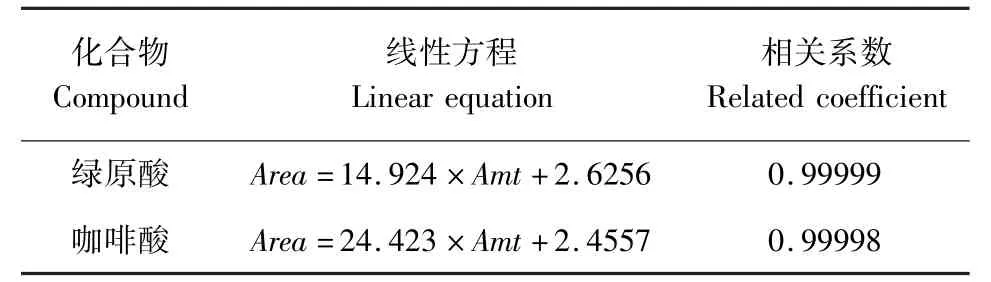
表2 线性方程和相关系数Tab 2 Linear equation and related coefficient
2.5.2.3 精密度试验 精密吸取同一混合对照品溶液,连续进样6 次,测定绿原酸、咖啡酸峰面积,计算6 次进样峰面积的RSD分别为1.2%和0.2%,表明,方法精密度良好。
2.5.2.4 稳定性试验 取同一供试品溶液,分别在0、6、12、24 h 内测定绿原酸、咖啡酸的峰面积,并计算峰面积的RSD分别为1.43%和1.16%,结果表明,在24 h 内有较好的稳定性。
2.5.2.5 重复性试验 精密称取同一批白英粉末共5 份,按样品溶液的制备方法制成供试品溶液,依法测定绿原酸、咖啡酸峰面积并计算RSD分别为1.12%和0.76%,表明方法重复性良好。
2.5.3 绿原酸和咖啡酸添加回收试验 分别向12号样品(绿原酸和咖啡酸的含量分别为1.5 mg/mL和50 μg/mL)中添加绿原酸对照品浓度为10.17 mg/mL 的标准溶液150 μL 和咖啡酸对照品浓度为1.0 mg/mL 的标准溶液55 μL,充分混匀后依法测定绿原酸和咖啡酸的含量并计算回收率,一共作8个平行,结果见表3,结果表明:8 个平行样品绿原酸和咖啡酸的平均添加回收率分别为86. 5% 和83.0%。
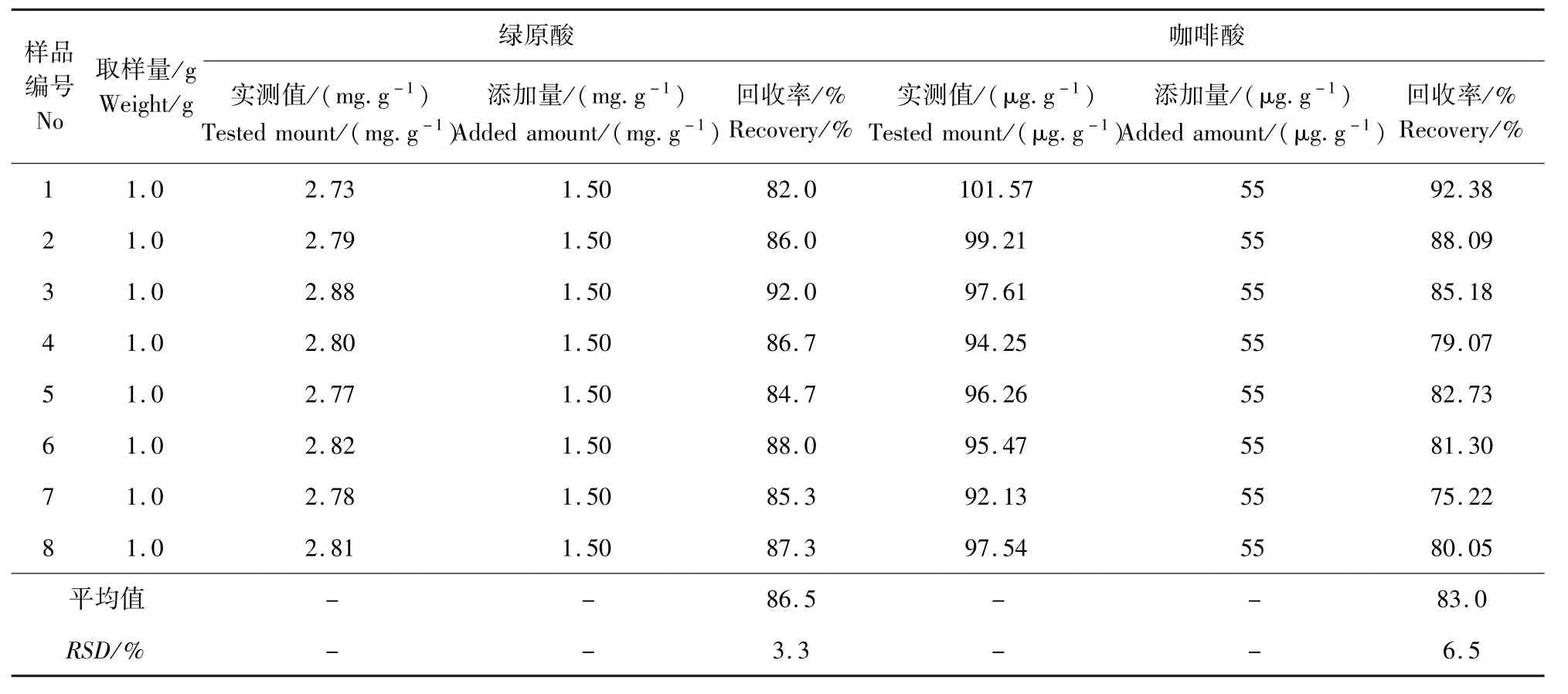
表3 绿原酸和咖啡酸添加回收率试验结果Tab 3 Recovery results of chlorogenic acid and caffeic acid
2.5.4 样品含量的测定 按2.5 项测定法对编号为1 ~13 的白英样品进行含量测定,结果见表4。所测13 批样品中绿原酸的平均含量为4.59 mg/g,而咖啡酸含量的平均值为76.90 μg/g。 3 号样品中绿原酸和咖啡酸含量(21. 80 mg/g 和294. 90 μg/g)明显偏高,分析认为主要原因是该批样品在采集时均为当年新长成的较幼嫩的植株,其较高的含量并不具代表性,作为离群值舍去。 其余12 批样品中绿原酸含量的相对标准偏差为100.6%,而12 批样品中咖啡酸含量的相对标准偏差则为53.5%。 绿原酸和咖啡酸含量最高的5 号样品分别是含量最低的8 号样品的94 倍和7 倍,结果表明白英中咖啡酸含量虽然较低,但却比绿原酸稳定,变化幅度也较小,故采用咖啡酸的含量测定来控制白英的质量。 去除离群值的12 批样品中咖啡酸含量的平均值为58.73 μg/g,58.73 μg/g ×80%=46.98 μg/g,因此,使用47.0 μg/g 作为咖啡酸的测量限值。
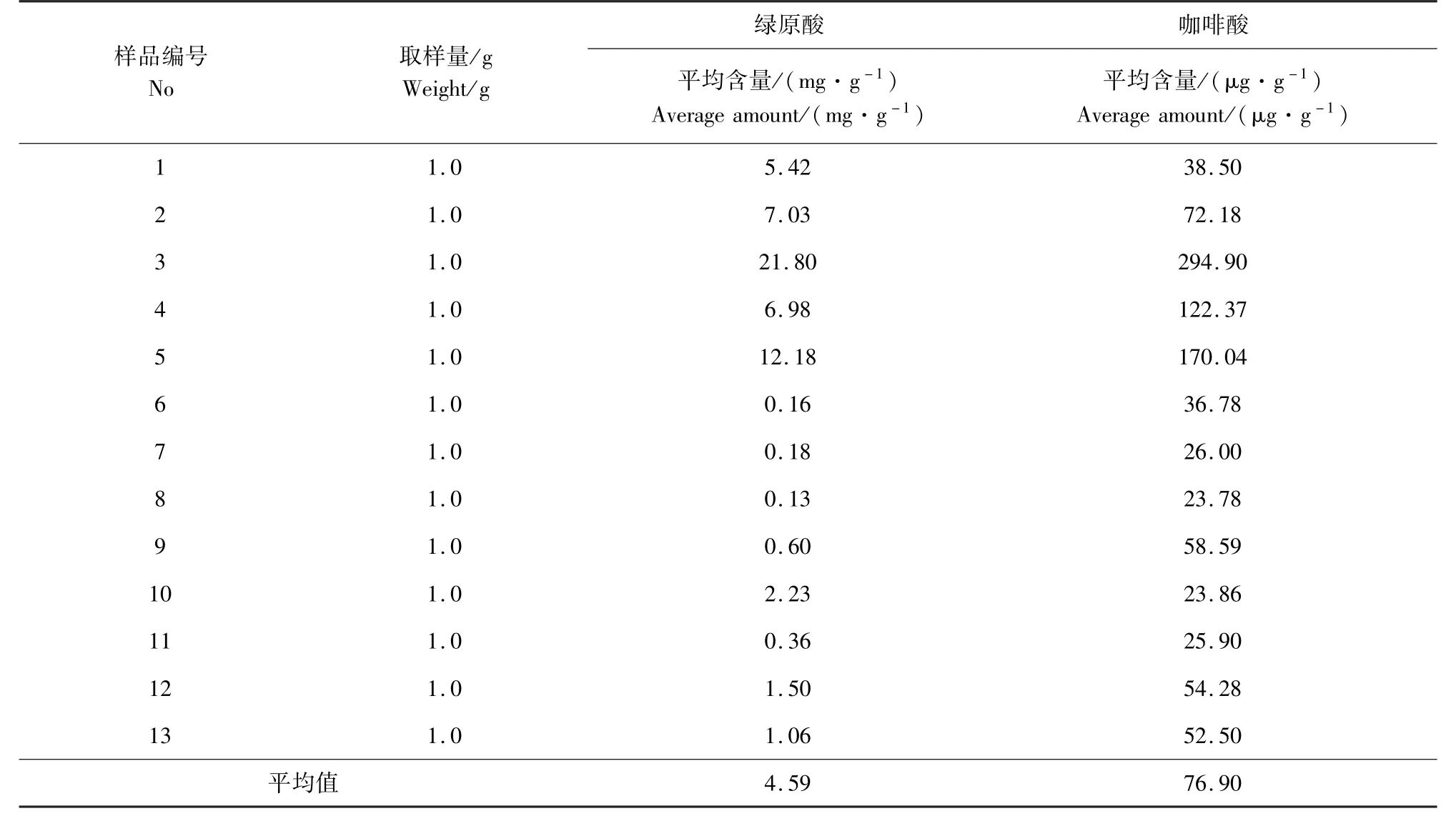
表4 13 批白英样品中绿原酸和咖啡酸含量测定数据Tab 4 Detection results of chlorogenic acid and caffeic acid in 13Solanum LyratumThunb. samples
2.5.5 两种溶剂处理样品绿原酸和咖啡酸含量的测量结果 使用50%的甲醇溶液和75%的乙醇溶液分别处理2 批样品,测定其中绿原酸和咖啡酸的含量,以考察两种提取方法的优劣。 结果见表5。结果表明:使用75%的乙醇溶液处理样品比使用50%的甲醇溶液处理样品,咖啡酸的收获率均有非常明显提高。
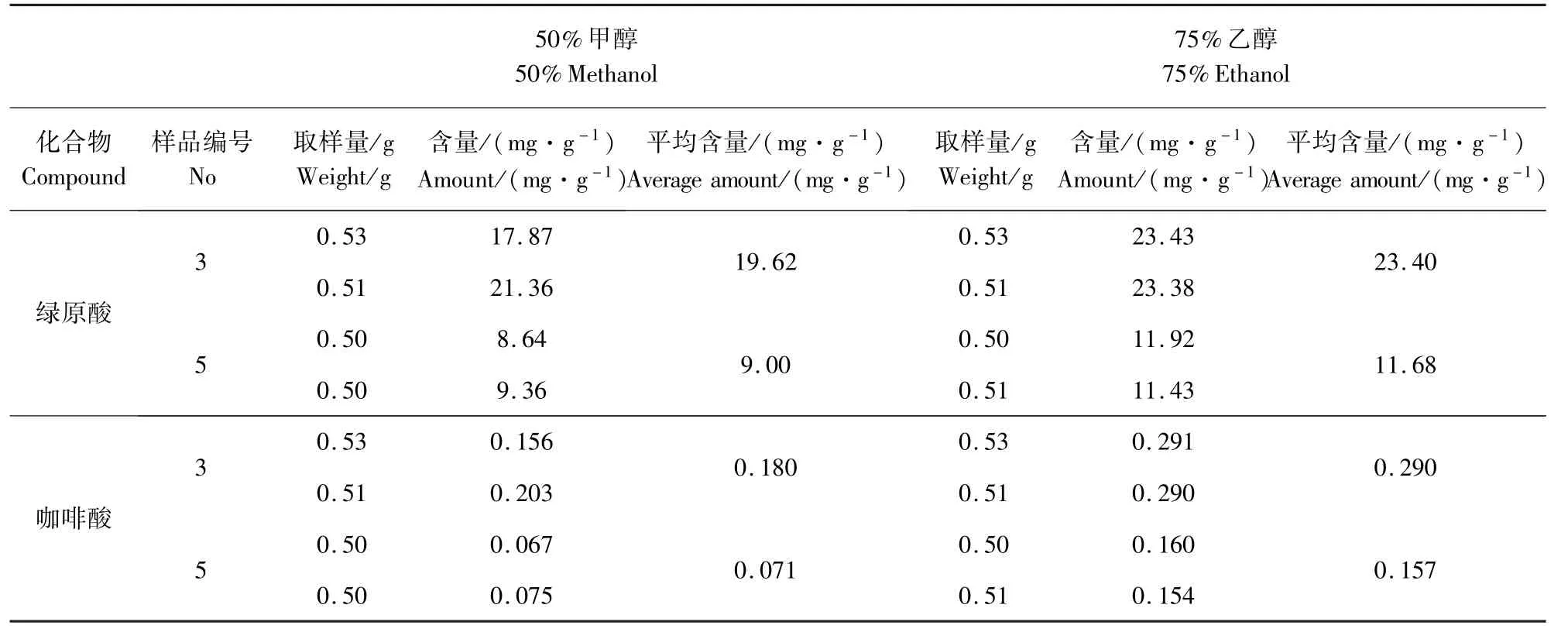
表5 不同溶剂处理2 批样品的绿原酸及咖啡酸含量测定结果Tab 5 Detection results of chlorogenic acid and caffeic acid in 2Solanum LyratumThunb. Samples dealed with two different solvent
3 讨论与结论
3.1 选择薯蓣皂苷元作为薄层色谱鉴别对象的考虑 白英中含有较高的绿原酸及薯蓣皂苷元,两者均可考虑作为薄层色谱鉴别的目标物质。 且《中国兽药典》中对于绿原酸的薄层色谱鉴别有很成熟的方法,从这个角度而言,绿原酸的薄层色谱鉴别应该作为优先考虑的范畴。 但在对白英中的绿原酸进行薄层色谱鉴别时发现,绝大多数白英饮片的薄层色谱鉴别显色均不明显甚至不显色,原因应当是绿原酸不稳定,在贮藏过程中容易分解所致。 对白英中的薯蓣皂苷元进行薄层色谱鉴别时,新鲜药材和饮片的薄层色谱显色均没有出现明显差异。
3.2 薯蓣皂苷元薄层色谱鉴别的显色特点 对薯蓣皂苷元进行薄层色谱鉴别时,斑点的显色情况会因加热及放置时间的不同而出现较大的差别,但基本上是在砖红色到暗绿色之间变化,且对照品与样品所显斑点的颜色均保持一致,并非显色方法不佳所致。
3.3 选择咖啡酸而没有选择绿原酸作为含量测定控制指标的考虑 研究中发现白英新鲜药材和饮片中绿原酸的含量均比较高,13 批样品的平均含量可达4.59 mg/g,而咖啡酸的含量则相对低得多,13 批样品的平均含量仅为76.90 μg/g。 但不同批次的绿原酸含量存在巨大差距,而且绿原酸不稳定,贮藏过程中容易发生降解;而不同批次的咖啡酸含量的偏差则相对小得多,故选择咖啡酸而不选绿原酸作为控制白英质量的含量指标。
3.4 性状中果实的颜色 研究中采集的新鲜药材经贵州中医药大学中药资源教研室魏升华教授鉴定确定均为白英。 关于白英果实的颜色文献中的描述存在一定差异,如《中国兽药典》中果实的颜色为绿棕色,《贵州省中药材、民族药材质量标准》(2003 版)[14]中为红黑色,余南才[15]等认为果实为淡黄色至暗红色。 不同文献中白英果实的颜色之所以存在差异,应该与采集时间有关,采集时间太早,果实的颜色尚为绿色,故干燥后呈现为绿棕色或淡棕色;采集时间过晚,果实已经完全成熟,颜色呈深红色,干燥后会呈现出红黑色的性状;采集时间处于两者之间时,果实正好由绿色变为红色,所以干燥后会呈现出淡黄色的情况。 所以,综合考虑各种情况后,决定把果实的颜色修改为绿棕色至红黑色。
3.5 薯蓣皂苷元含量的测定 本研究还建立了白英中薯蓣皂苷元含量的高效液相色谱测定方法及相应的含量测定标准。
本质量标准较全面、客观地建立了白英性状、显微、薄层鉴别,水分、灰分检查,醇溶性浸出物以及其中咖啡酸含量测定的方法。 方法专属性强,灵敏度佳,准确度高,具有很强的可操作性,为控制白英的质量提供了较全面的科学依据,可作为控制白英的质量标准。

