希瓦氏菌生物被膜研究进展
阎 俊, 谢 晶,3,4*
(1.上海海洋大学 食品学院,上海 201306;2.农业农村部 水产品贮藏保鲜质量安全风险评估实验室,上海 201306;3.上海冷链装备性能与节能评价专业技术服务平台,上海 201306;4.食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306)
希瓦氏菌(Shewanellaspp.)是一种嗜冷性运动革兰阴性杆菌,是海产品中常见的腐败菌,在低温环境下,该菌能够将水生动物和高蛋白食品中的氧化三甲胺(Trimethylamine oxide,TMAO)还原为三甲胺(Trimethylamine,TMA),产生氨类及H2S等腐败腥臭味的气体物质,腐败能力强[1]。因此,希瓦氏菌是评估海产品品质的重要微生物指标[2]。希瓦氏菌也是各种水生生物的条件致病菌[3-4]和人类潜在的病原体[5-6]。生物被膜是微生物附着在生物或者非生物固体表面后分泌胞外基质,并将微生物自身包裹于胞外基质中形成的复杂、异质的多细胞群落[7-9],它无处不在。生物被膜的胞外基质主要由胞外多糖、胞外蛋白和胞外DNA(eDNA)组成。生物被膜的形成增强了细菌在自然界的抗逆能力,并难以清除和杀灭[10],是细菌适应外在环境变化的生存模式。腐败菌和致病菌在食品加工设备表面一旦形成生物被膜,就难以清除,会形成持续的污染源,对人类健康和工业生产造成危害。希瓦氏菌易黏附于物体表面形成生物被膜[11],而加工环境中的生物被膜容易被忽视,形成持续污染源,造成二次污染和交叉污染,产生食品腐败和食品安全问题,这不仅对经济发展造成不良影响,也对人类的身体健康产生极大威胁。因此,抑制生
物被膜的形成并对其进行有效的控制是目前亟需解决的问题。本文对希瓦氏菌生物被膜的形成过程、形成机制、控制方法等进行综述,以期为希瓦氏菌生物被膜的深入研究提供参考。
1 生物被膜的形成
生物被膜的形成是一个动态过程,主要分为4个阶段:细菌的初始黏附、微菌落形成、生物被膜成熟和生物被膜的消解(图1)。
1.1 细菌的初始黏附
浮游态细菌感知并黏附在物体表面,开始进入初始黏附阶段,这个阶段根据细菌与表面结合的强弱,分为可逆黏附和不可逆黏附,不可逆黏附是细菌从浮游态向生物被膜态转换的关键,对于生物被膜的形成至关重要。
当细菌细胞与黏附表面足够接近并允许进行初始黏附时,在范德华力、静电力、疏水作用力下产生黏附。此时,细菌细胞做布朗运动,可以被流体剪切力轻易除去,此时为可逆黏附阶段。随后,细菌通过分泌胞外多糖或与特异性配体如鞭毛、菌毛结合,由可逆黏附转变为不可逆黏附。不可逆黏附只有通过刮、擦或化学清洁剂等强力的物理或化学手段才可清除。在从可逆黏附到不可逆黏附的过渡中,涉及到各种短程作用力,包括共价键、氢键以及疏水键的相互作用,此外,菌体表面的细胞元件及细胞分泌物对黏附的形成都发挥着重要的作用[13-14]。当完成可逆黏附向不可逆黏附的转变后,开始了生物被膜的生命周期。
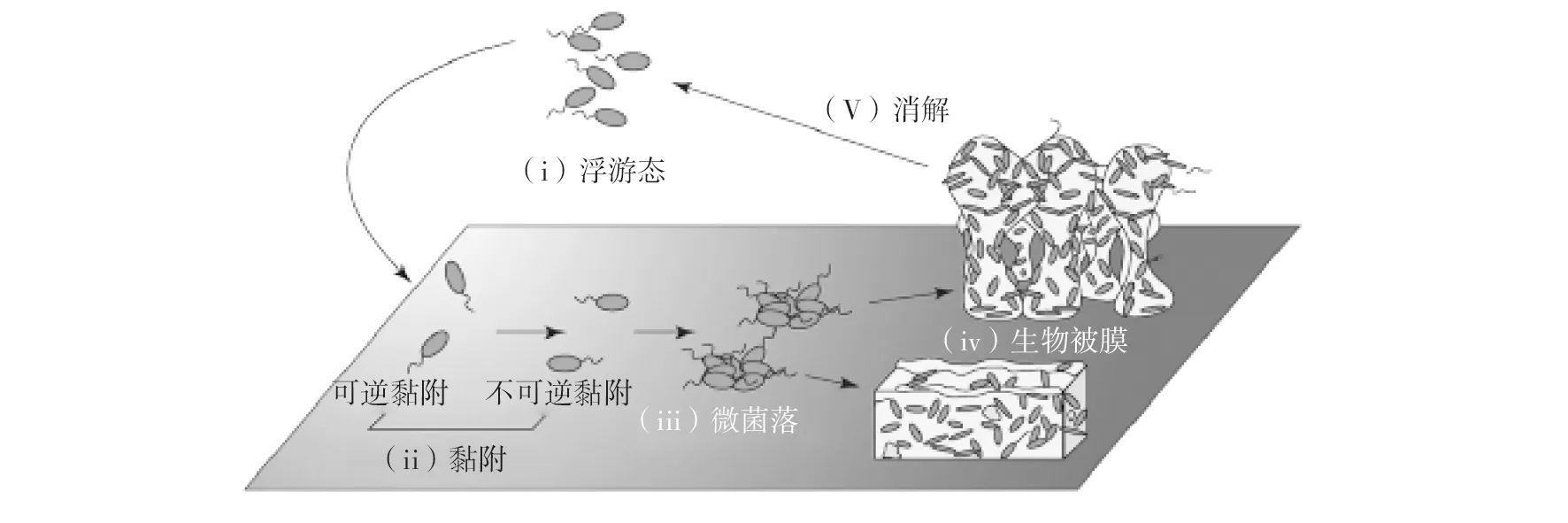
图1 生物被膜形成周期[12]Fig.1 The formation cycle of biofilm[12]
1.2 微菌落的形成
细菌完成初始黏附后迅速增殖,同时开始调整基因的表达,分泌大量胞外物质使细菌聚集,黏附在宿主表面形成微菌落,微菌落一般含有50~100个左右的菌体细胞,是生物被膜的早期形态,其形成是一个相对短暂的阶段,是菌体从不可逆黏附阶段进入生物被膜成熟阶段的过渡期,也是菌体形成成熟生物被膜所必须经历的过程[12]。
1.3 生物被膜的成熟
随着微菌落中菌体的生长繁殖和更多的胞外基质被分泌,生物被膜逐渐成熟,生物被膜基质的成分也越来越复杂,成熟的生物被膜中菌体细胞只占生物被膜总干重的10%,90%均为胞外基质[7]。胞外多糖和蛋白是构成生物被膜的主要成分,eDNA作为补充成分进行填充[15-18],三者通过短程作用力相互作用,从而形成生物被膜的三维结构[19]。
1.4 生物被膜的消解
生物被膜一旦形成就必须完成整个生命周期才能恢复浮游状态。生物被膜的消解是指生物被膜成熟后,在营养物质缺乏等条件的压力下[12]主动释放生物被膜中的细菌,使其恢复浮游状态的过程。浮游状态的细菌在新的位置开始黏附、增殖并成熟[20-21],重新开始一个新的周期。
2 希瓦氏菌生物被膜形成机制
微生物的浮游态和被膜态是微生物生存的两种不同方式,两种状态之间的转变受到微生物严格的调控,以适应环境的变化。随着对希瓦氏菌生物被膜研究的不断深入,多种生物被膜体外研究模型系统已经建立,在已经完成的诸多希瓦氏菌表型研究的基础上,越来越多的学者开始关注希瓦氏菌生物被膜形成机制的研究。
Theunissen等[22]对Shewanellaoneidensis进行了随机转座子插入突变研究,以期发现有助于S.oneidensis在物体表面聚集并形成生物被膜的基因,通过对生物被膜表型破坏最严重的突变株的研究,发现了1个285 kDa的多区域蛋白,其对生物被膜的形成至关重要,并将其命名为生物被膜形成促进因子(biofilm-promoting factor A,BpfA),该蛋白通过Ⅰ型分泌系统分泌到细胞表面,依赖于BpfA的生物被膜形成表型,受到低浓度钙离子的正向调控。
Zhou等[23]通过对模式菌株S.oneidensisMR-1的生物被膜形成的分子机制的深入研究,同样发现BpfA促进了S.oneidensis的不可逆黏附,与LapA促进荧光假单胞菌P.fluorescens的不可逆黏附作用类似[24],并首次对BpfA、BpfG和BpfD 三个关键蛋白进行了详细的研究,阐明了三种蛋白的具体作用。BpfA作为分子“胶水”直接参与生物膜的形成,BpfG不仅是生物膜形成过程中协调BpfA分泌必不可少的物质,而且还是将BpfA转化为生物膜释放的活性物质。BpfD通过与BpfA和BpfG相互作用来调控生物膜的发育,并可能响应信号分子c-di-GMP。此外,BpfD和BpfG的化学计量比对生物膜的形成也至关重要。
这些研究强调了BpfA对希瓦氏菌生物被膜形成的重要性,随着研究的进一步深入,发现BpfA的分泌受到第二信使环二鸟苷酸(c-di-GMP)的调控。c-di-GMP于1987年首次被发现[25],其在细菌中普遍存在,可以调控细菌的多种表型[26-28]。c-di-GMP被认为是革兰阴性细菌浮游态和被膜态转换的开关,胞内c-di-GMP含量较高时,菌体以生物被膜状态生存;胞内c-di-GMP含量较低时,菌体以浮游态生存[29-30]。
c-di-GMP在生物被膜形成的4个阶段都发挥了作用[26]。在初始黏附阶段,c-di-GMP通过调控鞭毛合成和鞭毛转速控制菌体与物体表面接触,通过表达促进不可逆起始吸附的细胞元件以及黏附蛋白以帮助菌体黏附在物体表面;通过调控胞外多糖的合成促进微菌落形成和生物被膜的成熟;当胞内c-di-GMP含量下降时,生物被膜开始释放,菌体通过剪切掉黏附蛋白、抑制胞外多糖的产生、表达运动性相关基因等方式转化生存状态,从生物被膜中逃离(图2)。
因此,诸多学者以c-di-GMP为关键物质,对希瓦氏菌生物被膜的形成机制进行了深入研究。通过早期对S.oneidensisMR-1的研究,发现其生物被膜的形成受到c-di-GMP的控制[31-32],但是对于c-di-GMP的代谢和作用靶点的了解却很少。Cheng等[33]对BpfA的产生机理进行了研究,发现在有氧条件下,BpfA的表达被一种受氧刺激的环化酶增强。根据之前转座子诱变的结果鉴定出FlrA是S.putrefaciensCN3中bpfA操纵子的一个关键转录调控因子,FlrA可以抑制bpfA操纵子的启动子,而c-di-GMP可以解除FlrA与操纵子的结合。此外还证明了FlhG,一种用于鞭毛合成的辅助蛋白,可以拮抗FlrA对bpfA操纵子表达的抑制。由此可知,FlrA在S.putrefaciensCN32中从c-di-GMP到bpfA相关生物膜形成的信号通路中起着中心调节作用(图3),也说明了c-di-GMP在生物被膜形成过程中,对bpfA操作子的调控作用。
在细菌细胞内,两分子GTP在二鸟苷环化酶(Diguanylate cyclases, DGC)的催化下合成c-di-GMP,DGC具有保守催化位点GGDEF催化合成反应[34]。c-di-GMP的降解则是在磷酸二酯酶(Phosphodiesterases, PDE)的催化下进行的,PDE的保守催化结构域为EAL或HD-GYP。根据DGC和PDE的保守结构域序列,对细菌的基因组进行预测发现,多数细菌能够编码DGC和PDE酶[35]。大多数的DGC和PDE的N端(N-terminal domain, NTD)含有信号输入结构域,能够感受外界环境信号,从而调控c-di-GMP的生成[36-37]。
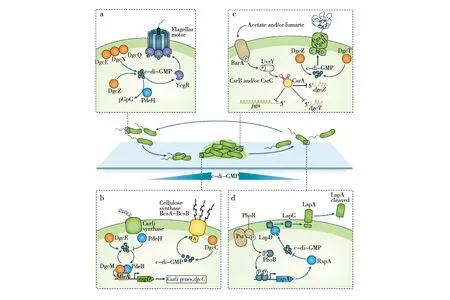
图2 c-di-GMP对生物被膜形成的调控[26]Fig.2 Regulation of biofilm formation by c-di-GMP[26]

图3 FlrA对bpfA操纵子表达调控示意图[33]Fig.3 Schematic of the proposed regulation of FlrA on the expression of the bpfA operon[33]
环境因素对于生物被膜的形成有着相当大的影响,正是受到外界环境的刺激,细菌才启动了浮游态和被膜态之间的相互转换。然而,介导c-di-GMP调控bpfA操纵子表达的响应因子仍然不清楚。环境因素通过不同的信号转导途径影响生物膜的形成。Wu等[38]发现在有氧条件下,二鸟苷酸环化酶DosD的催化作用使环二鸟苷酸(c-di-GMP)水平升高,进而调控bpfA操纵子的表达上调,从而促进有氧生长条件下生物膜的形成。除氧气外,一氧化氮(NO)可以通过连接到H-NOX结构域介导生物被膜的形成,然而大多数NO感应细菌缺乏含有H-NOX结构域的蛋白质。Nisbett等[39]通过研究发现另一种NO感应蛋白(NosP)可能在许多物种中参与双组分信号和生物膜调控,通过对S.oneidensis的研究,证明NosP参与了H-NOX/NO感应的多组分c-di-GMP信号网络。无nosP或顺反子激酶nahK的菌株会产生不成熟的生物膜,而hnoX和hnoK(对NO/H-NOX反应的激酶)突变导致野生型生物膜结构发生变化。NosP可以调节NahK和HnoK的自磷酸化活性。HnoK和NahK被证明可以调节三个反应调节因子(HnoB、HnoC和HnoD),它们共同组成一个NO反应的多组分c-di-GMP信号网络。NosP/ NahK通过调节HnoK和NahK的磷酸盐通量来调节c-di-GMP信号网络,最终调节生物膜的形成。此外,NosP和H-NOX似乎在推拉机制中相互对抗,NosP/NahK通过抑制H-NOX/ HnoK信号促进生物被膜的形成,这本身就降低了生物膜的形成程度。NO主要通过抑制HnoK活性减少c-di-GMP和生物膜的形成。
外界环境中的营养元素对于希瓦氏菌生物被膜形成也起着重要的作用。Liu等[40]通过对S.putrefaciensCN32的研究,发现了三组分负调控生物被膜的系统。该系统包括1个组氨酸激酶LrbS (Sputcn32_0303)和2个同源反应调节因子,包括1个转录因子LrbA(Sputcn32_0304)和1个磷酸二酯酶LrbR (Sputcn32_0305)。LrbS响应碳源乳酸钠的信号,随后激活LrbA。激活的LrbA促进lrbR的表达,lrbR是另一种反应调节基因。含有EAL结构域的双(3=-5=)-环二聚物GMP (c-di-GMP)磷酸二酯酶LrbR降低了细胞内c-di-GMP的浓度,从而对生物膜的形成起到了负调控作用。碳源是细菌生长的重要营养物质,其浓度和种类对生物膜的生物量和结构有重要影响。邓旗等[41]通过添加不同浓度的葡萄糖进行腐败希瓦氏菌生物被膜的培养,发现葡萄糖对希瓦氏菌生物被膜的形成没有显著的影响,这与葡萄糖能够促进双歧杆菌生物被膜形成的结论[42]相悖,推测是因为不同细菌生物被膜的形成所依赖的环境因子不同所致。关于营养元素调控生物膜形成机制的认识还很有限,需要进一步发掘研究。
细菌自身的群体感应系统对于生物被膜的形成也有着一定的作用。Wang等[43]通过对大黄鱼特异性腐败菌S.balticaOS155进行自诱导实验,获得了细胞密度依赖型的luxR型基因。通过体外结合实验发现,外源群体感应信号分子cyclo-(L-Pro-LPhe) (PP)与LuxR01及LuxR02蛋白直接相互作用。luxr型基因(luxR01和luxR02)的缺失在不同程度上影响生物膜的形成。通过转录分析和qRT-PCR验证表明,在luxR01和luxR02缺失株中,与生物膜相关的基因tor、speF和pomA下调。此外,外源cyclo-(L-Pro-LPhe)促进了生物膜的形成,而luxR01或luxR02的缺失可以减弱这一效果。微生物往往是处在和其他物种共生的生存环境中,其相互间的互作机制对于生物被膜的形成也有一定影响。Zhu等[44]研究发现,当S.baltica和P.fluorescens混合培养时,生物被膜的生物量少于单菌培养,生物被膜形成过程受到影响,厚度和微菌落数量明显减少,两种腐败菌的无细胞上清液对彼此的生物膜发育有很大的抑制作用。
环境因子的改变是调控生物被膜形成的根本原因。然而,由于环境的复杂多变性以及实验模拟的局限性,导致对环境因子调控生物被膜形成机制的研究还不够全面。虽然希瓦氏菌生物被膜形成机制的研究已经引起重视,但相对于其他微生物来说,希瓦氏菌生物被膜形成分子机制的研究还处于起步阶段。如果能够寻找到更多的诱导菌体生物被膜形成的环境因子,揭示这些环境因子调控生物被膜的形成分子机制,将为从源头控制生物被膜的形成提供参考。
3 希瓦氏菌生物被膜防控方法
希瓦氏菌生物被膜在加工设备表面形成,在一定环境条件下可以造成不锈钢接触面的腐蚀[11],降低设备使用效率和寿命,形成持续的污染源,造成的经济损失和对健康的威胁也是不可估量的,因此需要采取有效措施控制生物膜的形成,保障水产品的安全。目前,主要通过两种方法控制希瓦氏菌生物被膜形成,一是改变材料特性抑制微生物的黏附,抑制生物被膜的形成;二是利用物理、化学、生物学方法去除已形成的生物被膜。
3.1 材料改性抑制生物被膜形成
通过改变材料表面的电荷、疏水性、表面粗糙度及形态等性质,抑制微生物的初始黏附,阻断生物被膜的形成。代悦等[45]采用溶胶凝胶(sol-gel)法和水热合成法在不锈钢片表面制备ZnO薄膜,并进行疏水性改善处理,较好地抑制腐败希瓦氏菌生物被膜的生长。段长平等[46]借助真空条件,采用溶胶-凝胶(sol-gel)法在孔径约为50 nm的多孔钛片上制备具有不同微观形貌的ZnO薄膜并对其微观结构进行了表征分析,发现具有抑制腐败希瓦氏菌生物被膜形成的作用。由于多孔钛片具有疏水性,其抑制希瓦氏菌生物被膜的性能高于普通钛片且ZnO具有杀菌作用,其对生物被膜的抑制性能增强。通过对不锈钢表面进行电抛光处理,改变表面粗糙度,使其表面变得平滑,也可以明显减少附着的细菌细胞,抑制生物被膜的形成[47]。
3.2 希瓦氏菌生物被膜消除手段
对已经形成的生物被膜一般利用物理、化学、生物学方法去除。超声波技术是最常用的清除表面生物被膜的物理手段,低频高密度超声波通过空化作用破坏细菌细胞膜,引起细胞死亡,同时对胞外基质的结构也有一定破坏作用,使部分生物被膜与物体表面剥离,因此具有去除生物被膜的效果[48]。
天然抗菌剂的使用已经在逐步替代商业的化学消毒剂。Zhang等[49]研究发现茶多酚以浓度依赖的方式显著抑制不锈钢上的初始细胞附着,茶多酚破坏了生物被膜的胞外聚合物并使得菌体空间结构发生改变。Zhu等[50]从群体感应的角度对茶多酚干扰生物被膜的形成进行了阐述,绿茶多酚通过干扰AI-2和DKPs活性,促进AI-2降解,进而干扰生物被膜的形成,绿茶多酚还可以降低S.baltica的致腐特性。
在食品产业中,使用物理方法中清除生物被膜,对于大量的水产品和农副产品来说,效果不甚理想,而化学方法加入的物质又可能会影响食品的风味和品质,还可能带来安全隐患,因此采取生物学方法控制生物被膜形成已经逐渐成为首选。
Zhao等[51]认为含有群体感应信号分子的P.fluorescens无细胞上清液对S.baltica的生长、生物膜发育和腐败能力的抑制,使其稳定期时细胞数量下降,P.fluorescens的无细胞上清液抑制了S.baltica的生物被膜的生成并抑制其腐败表型。邓旗等[52-53]研究了抗菌脂肽对S.putrefaciens生物被膜形成的抑制作用。S.putrefaciens在常见的加工接触面不锈钢片上可形成成熟的生物被膜,成膜能力较强,在寡营养或消毒剂存在的环境中仍有一定的成膜能力,在与其他腐败菌共存的体系中也可形成较多的生物被膜,抗菌脂肽能够有效抑制生物被膜的形成。
以上控制手段都是针对特定微生物在设定的体外模型的条件下进行的,但在实际生产过程中由于微生物的多样性、环境的复杂性等因素的存在会影响控制效果。此外,食品生产过程的成本计算以及外源添加物对食品风味品质等方面的影响,也是必须考虑的。目前,常采用栅栏技术,将多种技术联合使用,以达到较好地控制效果。
4 结 语
由于生物被膜形成影响因素的复杂性、体外研究模型的局限性,使得希瓦氏菌生物被膜形成的分子机制尚未完全明确。截止目前,尚无一种方法可以完全控制生物被膜的形成,仍需通过栅栏技术进行组合优化处理。随着体外研究模型的不断完善、研究手段的不断更新,对生物被膜形成机制的研究和控制技术的开发也可以逐步实现。除此之外,实时、快速的检测技术也有待开发。利用检测技术并结合消除手段,对黏附在食品加工设备等表面的生物被膜实施靶向、精准、有效清除,对消除持续性污染源,减少生物被膜带来的风险,具有重要的应用价值。

