TLS/ERG阳性儿童急性髓系白血病临床特点及预后
胡冠华 陆爱东 贾月萍 左英熹 吴 珺 张乐萍
北京大学人民医院儿科(北京 100044)
虽然近年来对儿童急性髓系白血病(acute myeloid leukemia,AML)的认识不断加深,新的治疗方法不断涌现,但其总体预后仍有待提高。除早期治疗反应外,细胞遗传学及分子学异常是判断危险分层的最重要依据[1-2],早期识别高危险度患儿并及时给予分层治疗尤为重要。TLS/ERG是白血病中罕见的染色体易位形成的融合基因,由位于染色体16p11的TLS基因与位于2 lq 22的ERG基因融合形成。1985年首次报道1例TLS/ERG阳性AML[3]。至今25年来关于儿童TLS/ERG阳性AML的报道只有62例。本文回顾分析北京大学人民医院儿科于2008年6月至2018年12月间收治的6例伴TLS/ERG阳性AML患儿的临床资料,并对既往文献报道病例进行汇总分析以探讨TLS/ERG阳性AML患儿的临床特征及预后。
1 临床资料
2008年6月至2018年12月北京大学人民医院儿科共收治AML(非M 3)患儿461例,所有患儿均于治疗前行融合基因及染色体核型分析,其中6例TLS/ERG基因阳性。同时对1985至2020年的国内外文献进行复习,汇总了文献报道的62例儿童TLS/ERG基因阳性病例资料,对其中22例详尽描述患儿生存预后的病例进行回顾性生存分析。
本组6例TLS/ERG患儿占同期收治AML(非M3)患儿的1.3%。其中男4例、女2例,中位年龄9.1岁(4.0~14.0岁)。6例患儿中,肝肿大2例,脾肿大2例,淋巴结肿大1例。1例患儿起病时伴有头痛,脑脊液检查提示中枢神经系统(central nervous system,CNS)浸润分级2级,脑脊液残留阳性,头颅磁共振成像可见脑膜强化,诊断为CNS白血病。本组患儿未见突眼、皮肤包块等髓外浸润表现。
6例患儿发病时中位白细胞(WBC)为45.6×109/L(3.7×109/L~93.2×109/L),骨髓原始细胞比例中位数为69.2%(28.0%~90.0%)。3例患儿FAB分型为M2型,3例为M5型。参照北京大学人民医院常规方法[4],应用流式细胞术检测免疫表型并根据初治时白血病特异免疫表型进行跟踪随访。本组患儿除表达髓系抗原标记如CD13、CD33、CD34及CD117外,4例患儿表达CD 56。初诊骨髓细胞经过24~48小时培养后,收集细胞常规制片、G显带,根据《人类细胞遗传学国际命名体制(ISCN,1995)》进行核型分析[5],其中4例可见t(16;21)(p11;q22)异位,1例患儿为包含t(16;21)(p11;q22)异位的复杂染色体畸形,2例染色体核型正常。
首次诱导缓解采用阿糖胞苷(Ara-C)+去甲氧柔红霉素(IDA)/柔红霉素(DNR)+依托泊苷(Vpl 6)诱导方案,具体方案:Ara-C 100~150 mg/m2×7天(前48小时持续静滴)+IDA 10 mg/m2×2天或DNR 40~60 mg/m2×2天+Vpl 6 100 mg/m2×3天。对于获得形态学完全缓解(complete remission,CR)的患儿继续原方案巩固化疗1疗程;未获得CR患儿采用HA方案再诱导化疗,具体方案:高三尖杉酯碱2~3 mg/m2×7天+Ara-C 100~150 mg/m2×7天(前48小时持续静滴)。
6例患儿在诱导缓解治疗后血象开始回升时,采集骨髓标本进行骨髓涂片检查。常规进行瑞氏染色及髓过氧化物酶(POX)染色,低倍镜下观察骨髓有核细胞增生程度,油镜下计数分析100个有核细胞。3例患儿骨髓涂片显示CR(原始及幼稚细 胞比例≤5%),且临床无白血病细胞浸润所致的症状和体征。同时应用流式细胞术及聚合酶链式反应(polymerase chain reaction,PCR)进行微小残留病(minimal residual disease,MRD)检测,6例患儿1个疗程诱导化疗后中位免疫残留(flow cytometry,FCM)为3.7%(0%~7.6%),中位TLS-ERG拷贝数为150.8%(0.2%~430.0%)。
经过再诱导化疗后,5例患儿达CR状态,中位FCM为0.8%(0%~2.8%),中位TLS-ERG拷贝数为3.1%(0%~8.5%)。
1例患儿选择规律化疗,其后续方案包括DA/IA(Ara-C 2 g/m2×7天+IDA 10 mg/m2×2天或DNR 40~60 mg/m2×2天),HA及首次诱导缓解方案,序贯使用上述3个方案12个月,完成巩固化疗后停药随访。在巩固化疗期间TLS/ERG及ETO/AML 1拷贝数动态波动于0.001%~0.01%之间,于治疗开始后的30个月开始基因拷贝数持续阴性。现随访79个月,患儿持续缓解并存活中。
本组5例患儿行半相合异基因造血干细胞移植 (HLA-haploidentical hematopoietic stem cell transplantation,haplo-HSCT)治疗,中位移植时间为诊断后4.8个月(4.0~6.0个月),其中4例于移植前处于CR状态,1例处于未缓解(non-remission,NR)状态,移植前中位FCM为0.1%(0.0%~0.4%),中位TLSERG拷贝数为0.4%(0%~2.2%)。移植前预处理方案均采用常规改良的Bu+cy方案联合应用抗胸腺细胞球蛋白[6],移植物抗宿主病预防均采用环孢素A+霉酚酸酯+短程甲氨蝶呤方案[7]。5例患儿中3例出现骨髓复发,中位复发时间为11.6个月(3.0~22.0个月);分别于移植后3个月、4个月、3个月TLS/ERG转阳,1例于TLS/ERG转阳1个月后骨髓形态复发,另2例于TLS/ERG转阳3个月后FCM开始转阳;予供者淋巴细胞回输,TLS/ERG拷贝数短暂下降后很快上升形态复发,放弃治疗。5例接受haplo-HSCT患儿中1例移植后监测MRD持续阴性,现随访83个月骨髓持续缓解;1例患儿起病时伴CNS白血病,于移植后3个月再次反复头痛,经脑脊液检查证实为CNS白血病复发,予加强鞘内注射治疗后脑脊液恢复正常,现随访21个月骨髓持续缓解。
本组患儿的中位随访时间为61个月,6例患儿中有3例死亡,均为复发相关死亡。6例TLS/ERG阳性AML患儿临床资料见表1。
截至2020年6月,共检索到国内外文献报道的儿童TLS/ERG阳性AML患者62例,其中欧洲报道31例,我国报道25例,日本5例,法国1例。最大宗报道来自Berlin-Frankfurt-Munster(BFM)AML研究组,其回顾分析了14个研究中心自1995年至 2016年收治的1 380例AML患儿,其中伴TLS/ERG阳性者31例,伴TLS/ERG阳性者5年无事件生存率明显低于不伴TLS/ERG患儿(7%对51%)[8]。汇总分析已报道的26例儿童TLS/ERG阳性AML临床资料(36例曾报道病例因无患者详细临床特点及预后描述被除外),见表2。26例患儿中,男14例、女12例,中位年龄6.8岁(1~15岁),19例(73.1%)表达CD56;FAB-M0 1例FAB-M1 3例,FAB-M2 6例,FAB-M4 1例,FAB-M5 13例,FAB-M 7 1例,骨髓增生异常综合征转化型1例。2例患儿诱导化疗未缓解后放弃治疗,1例于诊断后放弃治疗,1例死于诱导化疗期间严重感染,此4例未纳入生存分析。将剩余22例患儿中9例未进行HSCT治疗的患儿归入化疗组,13例行HSCT治疗者归入移植组(1例无关供者HSCT后复发2次行haplo-HSCT,1例全相合HSCT后复发2次行haplo-HSCT,9例haplo-HSCT,2例脐血移植)。化疗组有4例诱导化疗不缓解,复发率为100%;移植组9例复发,复发率为69.2%,其中1例于复发后行二次移植后持续缓解长期存活,移植组存活患儿比例为38.4%。
2 讨论
TLS基因位于16 p 11,是一种蛋白质编码基因,负责编码多功能蛋白成分参与调控基因表达、维持基因组完整性和mRNA-微RNA处理等细胞过程。ERG基因位于21q22,属于ETS基因家族,是胚胎发育,细胞增殖、分化,血管生成、炎症和凋亡的关键调控因子。TLS/ERG基因既往报道可出现于尤文肉瘤等实体瘤中[9],于1985年首次于1例复发AML患者中发现TLS/ERG基因,后陆续有个案报道。其在白血病中发病率较低,文献报道发生率不到1%[10]。自1985年以来曾报道的儿童TLS/ERG阳性AML仅62例。本研究中TLS/ERG阳性者在儿童AML中所占比例为1.3%,与既往报道相近。
最初研究认为,TLS/ERG是伴t(8;21)或16号染色体异常AML的一种,直到1993年成功地建立了伴t(16;21)(p11;q22)的细胞系并推测其可能是一种独特类型的AML[9]。本组患儿除表达髓系抗原标记如CD 13、CD 33、CD 34及CD 117外,66.7%患儿表达CD 56。研究显示,t(16;21)AML约有45%表达CD 56[11],而CD 56抗原表达阳性已被诸多研究证实为影响AML患者预后的不良因素[12-13],易伴CD 56阳性可能为TLS/ERG阳性患儿预后不良的原因之一。另外,文献报道伴TLS/ERG的白血病细胞发生在干祖系分化的较早阶段,可累及粒系、单核系、巨核系和淋巴系,所以此类AML患者病程进展快,常规化疗难以完全缓解或缓解后易复发,预后不良[14]。本组患儿中2例除伴TLS/ERG外同时合并有预后较好的基因或变异,1例合并ETO/AML1,1例合并NPM1,此2例患儿均持续缓解现长期存活,但其余3例不伴预后良好基因或变异的患儿中除1例经造血干细胞移植后现存活外,其余2例均复发死亡,故虽然既往文献报道伴TLS/ERG患儿预后极差,但存在不均一性,其预后与合并的基因或变异有关。研究报道,在TLS/ERG阳性AML患儿中可同时检测到RUNX 1及TET 2变异[16]。国内也同样发现部分TLS/ERG阳性患儿同时伴有IKZF1、TET2、PHF6及NOCTH2等预后不良变异[10]。所以容易合并其他预后不良的基因和变异亦是TLS/ERG患儿预后不良的原因之一。
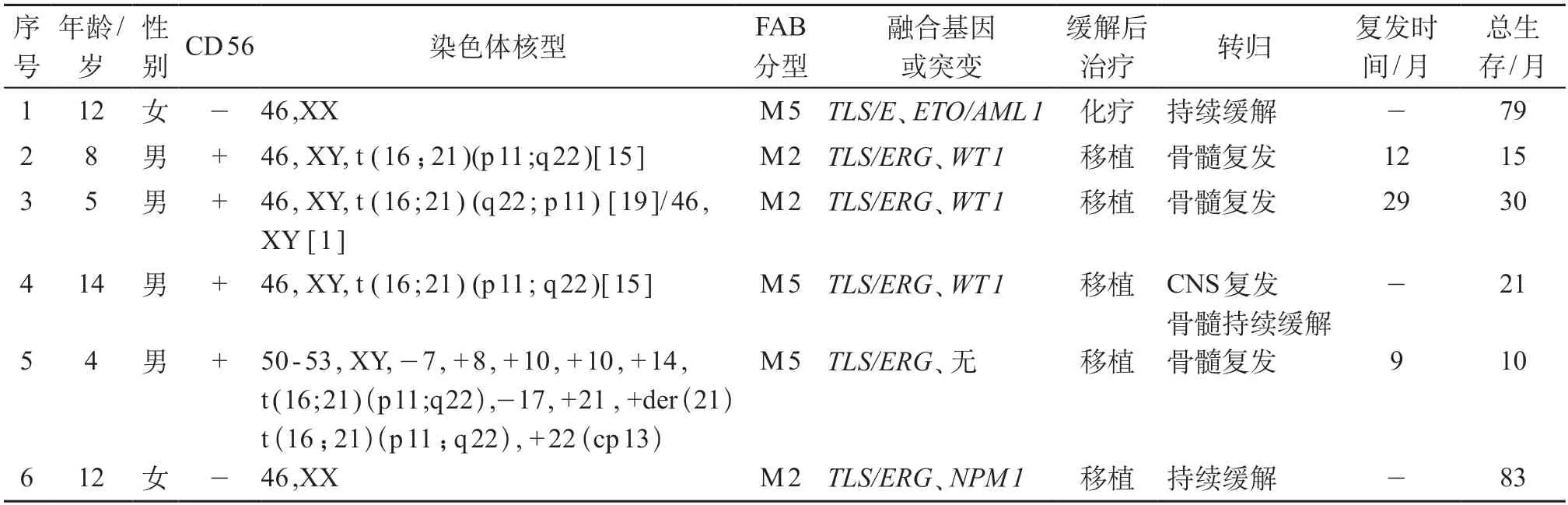
表1 6例TLS/ERG阳性AML患儿临床资料

表2 文献报道26例TLS/ERG阳性AML患儿临床资料
目前的研究已达成共识,虽然TLS/ERG在儿童AML中发生率极低,但其可作为预后不良的独立因素。应积极提倡在第一次缓解期行移植治疗[17-18]。本研究回顾性分析既往报道的TLS/ERG阳性AML患儿的生存资料,发现化疗组全部复发,移植组13例中9例复发,其中1例于复发后行二次移植后持续缓解长期存活,提示HSCT较化疗相比可提升生存率。既往研究发现,TLS/ERG白血病融合蛋白起源于干细胞水平,可下调周期蛋白依赖性激酶1和阻断髓系祖细胞的分化成熟[15],所以与化疗耐药和早期复发相关。也有研究认为,TLS/ERG阳性AML患儿常规化疗难以完全缓解或者是完全缓解持续时间较短,且复发后很难再次缓解,HSCT可能是治疗此类患者唯一可能有效的治疗方法[16]。本研究汇总既往病例报道提示,虽然移植组患儿复发率较化疗组低,但仍有69.2%患儿移植后出现复发。研究亦发现,移植患者中长期存活比例仍很低,大部分患者仍然会出现复发[16]。我国目前最大样本的研究发现,虽然移植可以延长总生存率,却不会提高无复发生存,因为移植后复发率仍然很高[17],所以亟待寻找新的治疗方法改善此类患儿的生存。曾有文献报道1例TLS/ERG阳性AML移植后复发患儿,在给予阿扎胞苷挽救性治疗后赢得了8个月的缓解期[18]。研究表明,TLS-ERG蛋白是维甲酸信号通路的转录抑制因子[19],可能因此而发现新的治疗TLS/ERG阳性AML的方法。
TLS/ERG基因除了可作为预后不良的独立危险因素之外,TLS-ERG转录水平可预测疾病复发并可指导临床早期干预,从而改善预后。在本组6例TLS/ERG阳性AML患儿中,2例在移植后首先出现TLS/ERG低拷贝数转阳,3个月后FCM开始阳性,后TLS/ERG拷贝数逐渐上升最终形态学复发,提示监测TLSERG转录水平可更敏感地预测疾病复发。国内其他研究亦发现TLS/ERG转录水平可预测预后同时指导干预性治疗[20]。
总之,TLS/ERG基因在儿童AML中发生率低,容易合并CD56阳性及预后不良的基因及突变,其总体预后不良。患儿预后不均一可能与同时合并的基因或变异对预后的影响有关。TLS/ERG阳性AML治疗难度大,造血干细胞移植仍是重要的治疗方法,但移植后复发比例仍高,总体生存极差,亟待改进目前治疗方案及寻找新的治疗方式。

