多西环素对荷瘤小鼠子宫内膜癌组织中CCAT1、MMP-2及TIMP-2表达的影响①
魏旭静 李 林 张红真 王 景 徐 静
(河北医科大学第一医院产科,石家庄 050000)
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统常见的恶性肿瘤之一,常发生于老年妇女,近年来子宫内膜癌的发生率逐渐升高,严重威胁女性的生殖健康[1]。导致子宫内膜癌发生的危险因素有糖尿病、高血压、不育和晚绝经等,但其发病机制尚未明确。研究发现,长链非编RNA结肠癌相关转录子1(long non-coding RNA colon cancer associated transcript 1,lncRNA CCAT1)与多种肿瘤的发生、发展、转移和预后过程密切相关[2,3]。基质金属蛋白酶-2(metalloproteinases-2,MMP-2)属于明胶酶A,主要作用是消化Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原和弹性纤维,能够通过破坏局部组织结构促进肿瘤生长,破坏基底膜屏障促进肿瘤转移,通过改建细胞外基质促进肿瘤新生血管形成[4,5]。组织金属蛋白酶抑制剂(tissue inhibitor of metallo proteinase,TIMP)是MMPs的天然抑制剂,TIMP-2可通过与活化的MMP-2形成复合物抑制其活性[6]。多西环素作为一种四环素类抗生素,具有抑菌作用,是一种MMPs广谱抑制剂。前期研究表明:CCAT1通过调控上皮-间质转化相关基因的表达和瘤细胞病毒癌基因蛋白的表达发挥促进子宫内膜细胞增殖、侵袭和转移的能力[7,8]。目前尚未发现多西环素对子宫内膜癌组织CCAT1、MMP-2、TIMP-2、PCNA 和Ki67表达影响的研究,本研究通过建立子宫内膜癌小鼠模型,成瘤后给予多西环素干预,观察CCAT1、MMP-2、TIMP-2、PCNA和Ki67在子宫内膜癌组织及正常增生期子宫内膜组织的表达水平,分析其表达水平对子宫内膜癌的影响,为临床治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 8周龄健康雌性C57BL/6小鼠50只,体质量(22±2)g,由河北省实验动物中心提供,合格证号:SYXK(冀)2018-008。饲养温度(23±2)℃,湿度(55±5)%,自由摄食和饮水,适应性饲养1周,经实验动物伦理委员会批准。
1.1.2细胞与试剂 多西环素购自美国Sigma公司,兔抗人MMP-2和TIMP-2多克隆抗体购自武汉博士德公司,小鼠抗人PCNA和Ki67单克隆抗体购自英国Abcam公司,二抗工作液购自北京杉金桥生物技术公司,子宫内膜癌HEC-1A细胞株购自中国科学院上海细胞生物学研究所。
1.2方法
1.2.1动物模型的建立 子宫内膜癌HEC-1A细胞株培养于RPMI1640培养基(含10%胎牛血清,1.0×105U/L青霉素和100 mg/L链霉素),于37℃及5%CO2条件下培养,取处于对数生长期的细胞经0.25%胰蛋白酶消化后,调整细胞密度为1.0×106个/ml。取0.2 ml接种于小鼠右腋外侧皮下,每天观察成瘤情况,约接种6 d后可见肿瘤开始形成,以移植瘤达到5 mm×5 mm为成瘤标准,约28 d达标[9]。
1.2.2分组与给药 小鼠40只,随机分为模型组、多西环素低、中和高剂量组,低、中和高剂量素组分别腹腔注射5、10、20 mg/ml多西环素,模型组给予等体积的生理盐水,1次/d,连续给药15 d。
1.2.3标本采集 连续给药7 d后处死小鼠,剥离肿瘤组织后称重,计算抑瘤率(inhibition rate,IR),公式如下:IR(%)=(1-多西环素组瘤重/模型组瘤重)×100%。称重后迅速取小块肿瘤组织置于-80℃保存。
1.2.4HE染色观察组织形态 取移植瘤组织,采用4%多聚甲醛溶液固定,不同浓度乙醇脱水,透明处理,石蜡包埋,切成4 μm的组织切片,常规HE染色,置于光学显微镜下观察肿瘤组织形态结构。
1.2.5RT-PCR法检测CCAT1、MMP-2和TIMP-2表达 取移植瘤组织,采用TRIzol法提取组织总RNA,采用紫外分光光度计检测280 nm波长下总RNA浓度及纯度,逆转录生成cDNA,置于PCR扩增仪检测lncRNA CCAT1 mRNA表达水平。通过Primer 5.0软件设计引物,CCAT1引物序列:上游5′-CCAATTGAACCGAGCCTTGT-3′;下游5′-TCGTGAGCGTTTTCGCAATG-3′,长度298 bp;MMP-2引物序列:上游5′-AGTGGGACAAGAATCAGATCACAT-3′;下游5′-TCGGTGGTACAGCTGTTGTAAGAG-3′,长度447 bp;TIMP-2引物序列:上游5′-GGCAAGATGCACATTACC-3′;下游5′-TTGACATCCCTTCCTGGA-3′,长度386 bp;内参GAPDH引物序列:上游5′-TCCTCTGACTTCAACAGCGACAC-3′,下游5′-TCTCTC-TTCCTCTTGTGCTCTTGC-3′,长度176 bp。PCR扩增体系为10 μl,反应条件:50℃,2 min;95℃,10 min;95℃,15 s;60℃,1 min,进行35个循环。采用2-ΔΔCt方法表示lncRNA CCAT1 mRNA相对表达量。
1.2.6免疫组织化学法检测MMP-2、TIMP-2、PCNA和Ki67蛋白表达水平 取肿瘤组织置于10%甲醛固定,采用梯度乙醇脱水,石蜡包埋,切成4 μm的组织切片,采用二甲苯脱蜡,乙醇梯度水化,采用3% H2O2灭活内源性过氧化物酶活性,微波抗原热修复,分别加入一抗,置于4℃孵育过夜。加入二抗置于37℃孵育15 min,PBS冲洗3次,DAB显色,苏木素复染,脱水透明,封片。每张切片于高倍镜下取6个视野,测定每个视野的平均光密度值,分别表示MMP-2、TIMP-2、PCNA和Ki67蛋白表达水平。

2 结果
2.1多西环素对小鼠抑瘤率的影响 与模型组比较,多西环素低、中和高剂量组小鼠移植瘤质量明显降低(P<0.05)。多西环素高、中剂量组小鼠肿瘤抑制率明显高于低剂量组(P<0.05)。见表1、图1。

图1 各组小鼠子宫内膜癌组织Fig.1 Endometrial carcinoma tissues of mice in various groupsNote:A.Model group;B.Low dose group;C.Medium dose group;D.High dose group.
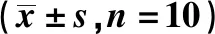
表1 各组小鼠瘤重和肿瘤抑制率比较Tab.1 Comparison of tumor weight and tumor inhibition rate among various
2.2多西环素对小鼠肿瘤组织病理的影响 模型组小鼠肿瘤细胞排列紧密,形状不规则,生长旺盛。与模型组相比,多西环素低、中、高剂量组小鼠肿瘤细胞体积明显减小,排列稀疏。多西环素高剂量组小鼠癌细胞可见大面积坏死核碎裂,周围组织浸润减轻。见图2。

图2 各组小鼠子宫内膜癌组织HE染色图(×100)Fig.2 HE staining of endometrial carcinoma tissues of mice in various groups(×100)Note:A.Model group;B.Low dose group;C.Medium dose group;D.High dose group.
2.3多西环素对小鼠肿瘤组织CCAT1、MMP-2和TIMP-2 mRNA表达的影响 与模型组相比,低、中和高剂量多西环素组大鼠子宫内膜癌组织lncRNA CCAT1 mRNA相对表达量均明显降低(P<0.05),呈剂量依赖性,3组差异有统计学意义(P<0.05)。见表2。
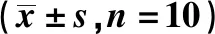
表2 各组小鼠子宫内膜癌组织lncRNA CCAT1 mRNA表达水平Tab.2 lncRNA CCAT1 mRNA expression levels of endo-metrial carcinoma tissues of mice among various
2.4多西环素对小鼠肿瘤组织MMP-2和TIMP-2表达的影响 与模型组相比,多西环素低、中、高剂量组小鼠子宫内膜癌组织中MMP-2蛋白表达明显降低(P<0.05),TIMP-2蛋白表达明显升高(P<0.05);与多西环素低剂量组比较,多西环素中、高剂量组小鼠子宫内膜癌组织中MMP-2蛋白表达明显降低(P<0.05),TIMP-2蛋白表达明显升高(P<0.05);与多西环素中剂量组相比,高剂量组小鼠子宫内膜癌组织中MMP-2蛋白表达明显降低(P<0.05),TIMP-2蛋白表达明显升高(P<0.05)。见表3、图3。
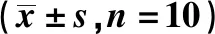
表3 各组小鼠移植瘤组织中MMP-2和TIMP-2蛋白表达比较Tab.3 Comparison of expressions of MMP-2 and TIMP-2 of transplanted tumor in mice among various
2.5多西环素对小鼠肿瘤组织PCNA和Ki67表达的影响 与模型组相比,多西环素低、中、高剂量组小鼠子宫内膜癌组织中PCNA和Ki67蛋白表达明显降低(P<0.05),与多西环素低剂量组相比,中、高剂量组小鼠子宫内膜癌组织中PCNA和Ki67蛋白表达均明显降低(P<0.05)。见表4、图3。
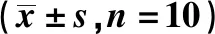
表4 各组小鼠移植瘤组织中PCNA和Ki67蛋白光密度值比较Tab.4 Comparison of optical density of PCNA and Ki67 transplanted tumor in mice among various

图3 各组小鼠子宫内膜癌组织免疫组织化学图(×200)Fig.3 Immunohistochemistry of endometrial carcinoma tissues of mice in various groups(×200)Note:A.Model group;B.Low dose group;C.Medium dose group;D.High dose group.
3 讨论
子宫内膜癌是严重危害女性生殖健康的一种生殖系统恶性肿瘤,对如何有效抑制子宫内膜癌组织恶化是目前临床肿瘤医学的难题[10]。lncRNAs是指不具有编码蛋白潜力的长度超过200 bp的RNA,在生命活动调控过程中起重要作用,包括充当信号、引导蛋白和分子支架等方式调控基因表达。CCAT1是近几年发现的一种具有促癌作用的lncRNA,在多种肿瘤中异常高表达,能够促进肿瘤的发生和发展[11]。CCAT1过表达能够促进癌细胞的增殖、迁移和侵袭[12,13]。高金苹等[14]研究表明,CCAT1参与调控cMYC基因转录,增强肿瘤细胞放射敏感性,抑制肿瘤细胞增殖。在MMPs家族中,MMP-2可降解基底膜Ⅳ型胶原,从而促进肿瘤细胞侵袭和播散[15]。
TIMP-2作为肿瘤预后不良标志物,可促进癌细胞增殖,与肿瘤发展有密切联系[16]。TIMP-2是MMPs 的抑制物,随着MMP-2的表达水平升高而升高[17]。
多西环素是MMPs的抑制剂,可以通过与MMPs的活性中心Zn2+结合从而阻断MMPs的酶活性,同时能够从转录水平下调MMPs mRNA表达,减少MMP-2产生[18]。本研究结果表明在不同剂量的多西环素干预下,能够不同程度地敲低CCAT1基因,其具体作用机制有待进一步研究,同时低、中和高剂量多西环素均能减低MMP-2和TIMP-2在肿瘤组织中表达水平,其水平高低与肿瘤细胞的发展有密切联系,与相关报道结论一致[19,20]。PCNA 和Ki67是与增殖细胞相关的核抗原,仅在增殖细胞中合成表达,尤其在恶性肿瘤细胞中呈高表达,通常作为评估细胞增殖活性的指标[21]。一般情况下,增殖期细胞比例越高,PCNA 和Ki67阳性率越高,肿瘤生长快,恶性程度高[22]。本研究结果表明,模型小鼠给予不同剂量多西环素干预后,肿瘤组织中PCNA和Ki67表达明显降低,说明多西环素对肿瘤细胞的增殖有一定抑制作用。
综上所述,多西环素对荷子宫内膜癌小鼠移植瘤生长和肿瘤细胞增殖有一定抑制作用,其作用机制可能与下调CCAT1、MMP-2表达水平,上调TIMP-2表达水平有关。