免疫检查点抑制剂治疗的肝脏毒性管理
黄佩新, 张 岚, 陈 漪
复旦大学附属中山医院肝肿瘤内科,上海 200032
近年来,以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为代表的免疫治疗在恶性肿瘤治疗领域获得了令人瞩目的疗效,成为继化疗、靶向治疗后,肿瘤全身治疗的又一重要选择。随着ICIs的广泛运用,在改善多种肿瘤预后的同时,其带来的免疫相关不良事件(immune-related adverse events, irAEs)也不容小觑。肝脏是消化系统的重要器官,承担人体的消化吸收、药物代谢及部分免疫功能,也是irAEs的累及系统之一。基于CheckMate 040[1]及KEYNOTE-224[2]研究结果,美国FDA批准纳武单抗(nivolumab,2017年)和帕姆单抗(pembrolizumab,2018年)作为二线用药,用于索拉非尼治疗失败的肝细胞肝癌(hepatocellular carcinoma, HCC),但其在提高疗效的同时,也增加了肝脏相关不良事件[3]。系统认识ICIs相关的肝脏不良反应,早期诊断和规范管理,对于改善肿瘤患者预后具有重要意义。
1 ICIs概述
目前批准的ICIs类药物主要包括细胞毒性T淋巴细胞抗原4(CTLA-4)抑制剂和程序性死亡因子-1(PD-1)及其配体(PD-L1)抑制剂。ICIs的作用机制区别于传统的“免疫增强”理论,被认为是“免疫正常化”,即选择性阻断PD-1/PD-L1或CTLA-4下游信号通路,通过恢复效应T细胞的功能,特异性识别和杀伤肿瘤细胞,从而在肿瘤微环境中发挥阻断肿瘤免疫耐受和免疫逃逸的作用[4-5]。irAEs的发生可能与免疫系统非特异性激活,降低自身免疫耐受、打破免疫平衡相关,但具体机制尚不明确。研究[6]显示,不同的ICIs发生irAEs的毒性谱并不相同,irAEs的产生机制也各有差异。可能的机制主要有3个方面:(1)ICIs与非肿瘤组织的靶受体结合诱导下游免疫反应的产生;(2)效应T细胞对非靶组织上的抗原再激活,诱导免疫攻击;(3)ICIs诱导炎症因子的产生。
2 irAEs的发生率及致死率
irAEs可发生在全身各个系统,大多数为轻至中度,经激素治疗后可逆,致死率较低。最常发生的部位包括皮肤、消化道、内分泌及肝脏;而肾脏、心脏、眼、神经系统、呼吸系统及血液学毒性较为罕见,但致死率较高[7-10]。ICIs首次治疗的6个月内是发生irAEs的高峰期,皮肤毒性通常最早(2~3周)出现,其次是消化道不良反应,如腹泻、结肠炎(一般6~7周),肝脏毒性(8~12周),但整个免疫治疗过程中,甚至治疗结束后均有发生irAEs的风险。ICIs的常见irAEs及其发生率见表1[11-12],在不同瘤种和不同临床试验中数据有差异。Wang等[13]的研究显示, 从2009至2018年全球药物不良反应数据库Vigilyze-Vigibase(http://www.vigiaccess.org/)总计超过1 600万例报告中共筛选出31 059例接受ICIs治疗的相关病例,仅有613例患者死于irAEs,占0.3%~1.3%。该研究统计了112项共计19 217例患者的临床试验结果,显示4种不同ICIs免疫不良反应的总体死亡率分别为0.36%(PD-1抑制剂)、0.38%(PD-L1抑制剂)、1.08%[14](CTLA-4抑制剂)及1.23%[15](CTLA-4/PD-1联合用药),联合用药的irAEs死亡率升高;发生的中位时间分别为40 d(PD-1/PD-L1抑制剂)、40 d(CTLA-4抑制剂)和14.5 d(联合用药),数据多来自黑素瘤临床试验。CTLA-4抑制剂的irAEs发生率和严重程度均高于PD-1/PD-L1抑制剂,其最常见的致死性irAE为结肠炎,占CTLA-4抑制剂irAEs致死病例数的70%[16];PD-1/PD-L1抑制剂相关的致死性毒性,常见为肺炎(35%)、肝脏毒性(25%)和神经毒性(15%)[17]。联合用药的irAEs致死率显著升高,其中免疫性结肠炎(5%)、心肌炎(39.7%,致死率最高)、内分泌毒性(2%)、肝炎及肺炎(10%~17%)为主要致死性不良反应类型[18]。
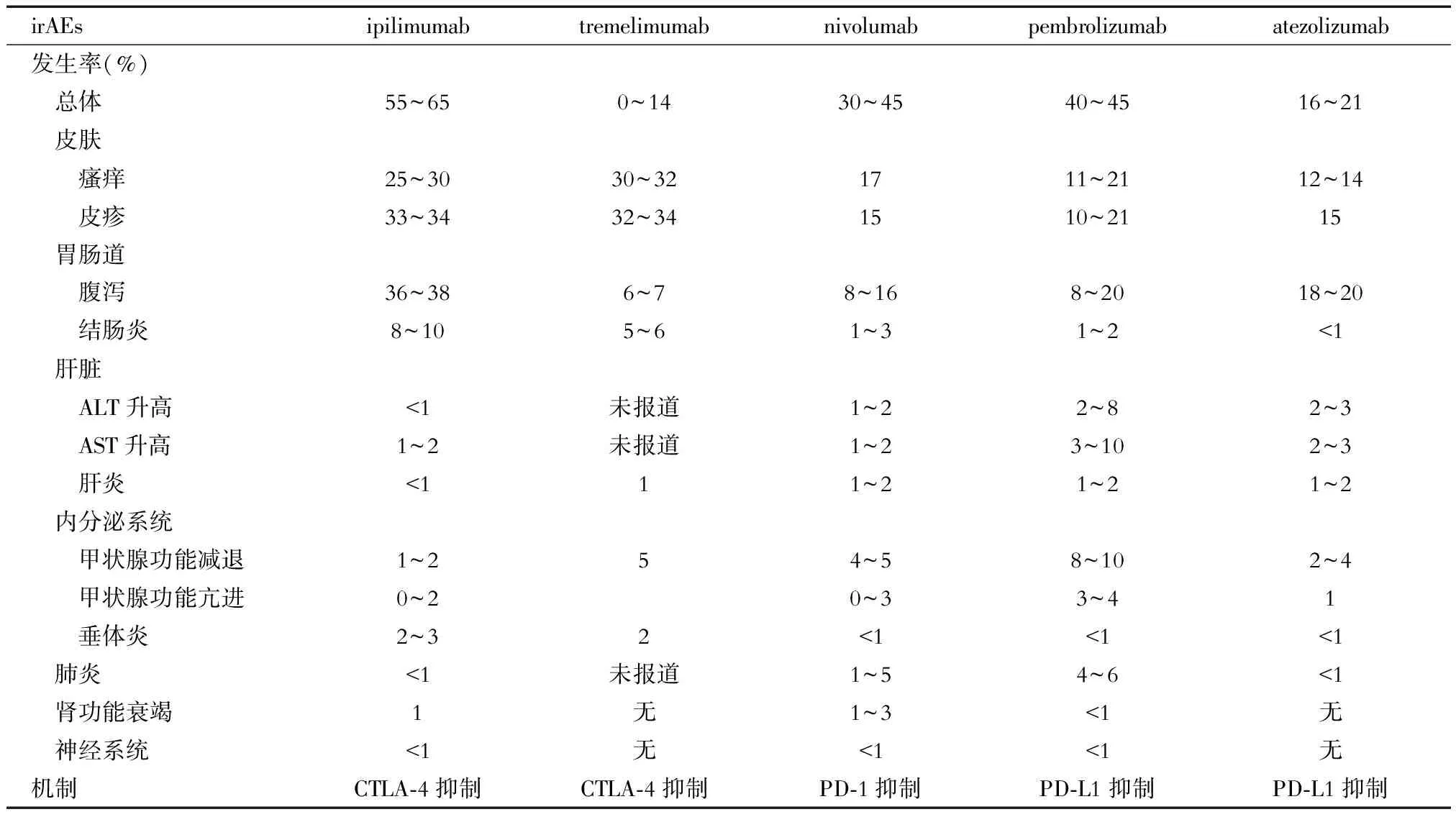
表1 常见ICIs致irAEs的发病情况[11-12]
ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶
3 ICIs的肝脏不良反应
肝脏是重要的药物代谢器官,也具有一定的免疫功能。接受常规剂量ICIs治疗,免疫相关的肝脏毒性发生率单药为1%~10%,3级及以上为1%~2%;CTLA-4抑制剂出现丙氨酸转氨酶(alanine transaminase, ALT)和/或天冬氨酸转氨酶(aspartate aminotransferase, AST)升高的发生率在10%以内;PD-1/PD-L1抑制剂发生率约5%;联合用药的肝毒性发生率为25%~30%,3级及以上约为15%[19]。单药3级以上肝脏irAEs发生的中位时间约为14.1周,联合用药的3级以上irAEs发生中位时间为7.4周,且持续时间更长[20]。值得注意的是,ICIs联合化疗或靶向治疗时,irAEs的发生率均有所升高(9%~20%)[19]。肝脏irAEs的发生通常较为隐匿,可不伴有明显的临床症状,也可与其他消化道症状伴随出现,如纳差、乏力等。实验室检查主要表现为ALT及AST升高,伴或不伴胆红素升高,需进一步完善检查,如肝炎病毒学检测、肝脏影像学检查,必要时进行肝穿刺活检,获得病理学依据。病理学诊断有助于鉴别其他抗肿瘤药物引起的药物性肝损伤、病毒激活或肝内肿瘤进展引起的肝功能异常等,对于指导后续治疗具有重要意义。ICIs肝毒性的病理表现为活动性泛小叶型肝炎,与自身免疫性肝炎较难鉴别,需要有经验的病理科医师参与。CTLA-4抑制剂引起的肝脏irAEs,通常伴以淋巴细胞为主的混合炎症细胞浸润(肝窦组织细胞增生症)和中央静脉炎;而PD-1/PD-L1抑制剂引起的门静脉炎症较轻;罕见门静脉炎症及胆管炎报道[21-22]。
4 肝脏irAEs的治疗及预后
随着ICIs在临床实践中大量应用(美国FDA已在8种恶性肿瘤中批准使用[23])及对irAEs认识的逐渐加深,国内外相关专业机构制订irAEs管理的指南和指导意见。目前国际上常用的irAEs管理指南主要由美国国立综合癌症网(National Comprehensive Cancer Network, NCCN)与美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)联合发布[23-24],欧洲医学肿瘤学协会(European Society of Medical Oncology, ESMO)[25]、国际肿瘤免疫治疗学会毒性反应管理协作组[Society for Immunotherapy of Cancer(SITC)Toxicity Management Working Group][7]等权威发布,在我国,则由中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)[26]发布。
这些指南在肝脏不良反应分级上基本一致,分为1~4级(G1~G4),分别为轻、中、重度及致死性肝脏不良事件,以ALT及AST为主要评价指标;但在对胆红素升高的评价和管理上,略有区别。毒性管理根据不良反应级别进行:轻度(G1)肝脏毒性(ALT、AST<3倍正常上限),建议继续使用ICIs治疗,每周监测1次肝功能,如肝功能稳定,适当减少检测频率。中度(G2)肝脏毒性(ALT、AST 3~5倍正常上限),建议暂停ICIs治疗,排除其他可能引起肝功能异常的因素后,予以口服泼尼松治疗(推荐剂量每天0.5~1 mg·kg-1),肝功能好转后逐步减量,各指南建议皮质类固醇的总疗程为至少4周。重度(G3)肝脏毒性(ALT、AST达5~20倍正常上限),建议暂停ICIs,静脉使用甲泼尼龙1~2 mg/kg;待肝脏毒性降至2级后,可等效改口服泼尼松并继续缓慢减量。对于ALT/AST>400或胆红素、INR或白蛋白异常者,建议每天1~2 mg·kg-1甲泼尼龙静脉使用,并密切监测肝功能。对于静脉激素治疗3 d效果不佳者,可考虑加用吗替麦考酚酯0.5~1 g,每日2次。致死性(G4)肝脏不良事件者(ALT、AST>20倍正常上限),所有指南一致建议永久停用ICIs治疗,住院接受每天1~2 mg·kg-1静脉皮质类固醇治疗,降至2级后,改等效泼尼松口服并逐步减量;3 d后如肝功能无好转,考虑加用吗替麦考酚酯;如吗替麦考酚酯效果仍不佳,可加用他克莫司,对于ICIs肝脏毒性患者不推荐使用英夫利西单抗,因该药物本身可致肝损。NCCN和ESMO指南均指出,在个例报道中,激素和吗替麦考酚酯治疗无效的急性重型肝炎使用抗甲状腺球蛋白抗体可能有效。此外,IL-6单抗、抗CD20及抗TNF-α单抗成功治疗危重和难治性肝毒性的案例也有报道[27],但NCCN指南指出,抗TNF-α药物应避免用于免疫相关性肝炎。各指南对于胆红素升高的管理各有不同,ESMO和NCCN指南对转氨酶升高1级以上且胆红素升高>1.5正常上限的irAEs患者,建议永久停用ICIs治疗,其治疗遵从4级不良反应治疗原则;CSCO和SITC指南将胆红素参照常见不良事件评价标准(CTCAE 5.0)[28]分为1~4级,与ALT、AST并列,管理相同。此外,对于基线存在肝转移的患者,SITC和CSCO提示可在相当于2级肝脏毒性以内的肝功能水平进行ICIs治疗;当发生肝脏irAEs,ALT/AST升高超过基线50%,并持续1周以上时,则须永久停止ICIs治疗。
值得注意的是,肝细胞肝癌患者使用ICIs后的irAEs发生率增高可能与患者的肝病基础有关,如肝硬化、病毒性肝炎等[29],目前各大指南对此均无针对性的指导建议。CheckMate 040研究中,nivolumab治疗肝细胞肝癌患者,肝脏毒性的发生率为31%,中位发生时间为6周,3级以上肝脏毒性发生率为14.5%,中位发生时间为2.1周,大多数患者经治疗后缓解[1]。CSCO指南结合我国合并病毒性肝炎(HBV/HCV感染)患者较多的现状,指出需将HBV-DNA控制在2 000 U/mL以下再开始ICIs治疗,并定期监测;对于HCV感染患者,指南没有推荐在进行ICIs治疗的同时进行核苷类似物或干扰素的治疗,但需定期监测HCV-RNA水平的变化。
总体来说,ICIs引起的肝脏损伤预后较好,患者较少发生肝功能衰竭及死亡,通常在治疗后1~3个月肝功能可恢复至基线水平。2级肝脏毒性好转后可恢复ICIs治疗;3级以上肝脏毒性患者经治疗好转后,CSCO指南建议谨慎尝试重启ICIs治疗,但存在再次发生严重肝脏不良事件的可能,需要充分评估可能的风险和生存获益,国外指南均建议永久停用ICIs治疗。此外,接受一种类型ICIs治疗后出现毒性者(如ipilimumab),可考虑接受另一种类型的ICIs治疗(如nivolumab),此时并不一定会再次出现肝脏毒性,但不建议换用同一类型的ICIs(如PD-1抑制剂换用为PD-L1抑制剂)。
5 小结及展望
随着ICIs在肿瘤治疗领域广泛应用,irAEs的出现也越来越受到临床医师的重视[30]。肝脏是重要的药物代谢及消化器官,可有原发和继发肿瘤的累及,在ICIs治疗过程中,肝脏不良事件是值得关注的重要事件。定期监测肝功能,有助于早期识别irAEs。鉴别肝功能异常的原因,排除肝内肿瘤进展引起的肝功能异常、病毒感染或再激活、其他抗肿瘤药物引起的肝脏损害和基础肝病的恶化,有助于明确ICIs引起的肝毒性,从而指导治疗。各大指南在肝脏irAEs的管理上基本达成共识,但对肝细胞肝癌或有基础肝病的患者仍缺乏有针对性的管理策略。皮质类固醇治疗,是应对肝脏irAEs的有效手段,大多数患者经治疗后肝功能可以恢复。但对于免疫相关肝脏不良反应的早期预测指标、早期快速诊断以及个体化管理等问题,有待于建立国际性的登记系统,收集真实世界的irAEs数据来进一步解决。

