真实世界中50例免疫检查点抑制剂相关严重不良反应分析
艾罗燕, 余一祎, 林瑾仪, 刘红春, 胡 洁, 高 地, 吴 薇, 金 航, 赵 琳, 孙 颖, 王 妍, 李 倩, 崔越宏, 徐 蓓, 刘天舒*
1.复旦大学附属中山医院肿瘤内科,上海 200032 2.复旦大学附属中山医院肿瘤防治中心,上海 200032 3.复旦大学附属中山医院心内科,上海 200032 4.复旦大学附属中山医院消化内科,上海 200032 5.复旦大学附属中山医院呼吸内科,上海 200032 6.复旦大学附属中山医院皮肤科,上海 200032 7.复旦大学附属中山医院药剂科,上海 200032 8.复旦大学附属中山医院放射科,上海 200032 9.复旦大学附属中山医院内分泌科,上海 200032 10.复旦大学附属中山医院风湿科,上海 200032
近年来,以免疫检查点抑制剂(immune-checkpoint inhibitors, ICIs)为代表的免疫治疗在肿瘤领域取得突破性进展,是继化疗、放疗、靶向治疗后肿瘤治疗的第四大支柱[1]。目前,ICIs已获得多个晚期实体瘤适应证的批准,包括非小细胞肺癌、胃癌、头颈部鳞癌、尿路上皮癌、恶性黑素瘤、霍奇金淋巴瘤等,在多肿瘤治疗中显示出良好的前景[1-2]。
目前,使用最广泛的ICIs是程序性死亡因子-1(programmed death 1,PD-1)及程序性死亡因子配体-1 (programmed death ligand 1,PD-L1)和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)的抗体。ICIs作用于免疫细胞,通过恢复或加强机体的免疫系统效能杀伤肿瘤细胞[1-3]。因此,这类药物导致的免疫相关不良事件(immune-related adverse events, irAEs)与传统化疗药物和靶向药物差异较大,本质上为免疫系统过度激活导致的炎症反应[4],累及多个系统。其中较易受累的器官或系统为皮肤、胃肠道、肝脏、肺及内分泌系统。虽然大部分irAEs为G1、G2级,但G3、G4级不良反应(重症)常使得免疫治疗被迫终止。部分irAEs(如结肠炎、心肌炎、肺炎)处理不及时可能导致患者死亡[5]。
目前irAEs数据大部分来自于临床试验,真实世界中irAEs发生情况的报道较少,多以单个病例报道为主。本研究纳入2018年6月至2020年6月复旦大学附属中山医院收治的50例重型irAEs住院患者,收集并分析其临床数据,探讨真实世界中重型irAEs发生概况,以期提高患者和临床医师对irAEs的警惕性和认知程度,及早干预,使患者获得最大受益。
1 资料与方法
1.1 一般资料 回顾性分析2018年6月至2020年6月复旦大学附属中山医院收治的重型irAEs住院患者50例。重型irAEs定义为需要住院治疗的irAEs患者,包括全部心肌炎患者和G3/G4级肝炎、肠炎、肺炎、原发性肾上腺皮质功能减退、糖尿病和神经系统炎症患者。纳入标准:(1)接受免疫检查点抑制剂治疗;(2)经复旦大学附属中山医院免疫药物不良反应多学科团队诊断为irAEs;(3)住院治疗患者。排除标准:(1)既往病史和治疗情况不明确;(2)无法排除其他因素所致不良事件;(3)非疾病治疗所需(如社会因素等)入院者。本研究经复旦大学附属中山医院伦理委员会批准(B2020-247R),所有患者均知情并签署知情同意书。
1.2 资料收集 收集患者的年龄、性别、累及系统、原发疾病药物治疗、从ICIs应用到首次发病时间和症状、肌钙蛋白(cTnT)量、氨基末端脑钠肽前体(NT-proBNP)水平、左室射血分数、合并其他系统受累、起始激素剂量、其他免疫抑制剂种类、全身糖皮质激素应用情况及转归。

2 结 果
2.1 基本情况分析 结果(表1)显示:50例重型irAEs包括心肌炎、肺炎、肠炎、肝炎、原发性肾上腺皮质功能减退、糖尿病和神经系统炎症,其中心肌炎19例(38.0%),占比最大。中位发病年龄为 61岁(28~72岁),男性33例(66.0%),PD-1抑制剂联合化疗18例(36.0%),联合抗血管治疗18例(36.0%),联合CTLA-4抑制剂2例(4.0%)。合并其他系统irAEs 19例(38.0%),其中心肌炎患者最易合并其他系统irAEs ,为15例(78.9%)。全身静脉使用糖皮质激素45例(90.0%),好转出院39例(78.0%)。死亡11例,包括5例心肌炎、5例肝炎和1例肺炎。

表1 50重型irAEs基本情况分析
2.2 中位发病时间分析 结果(图1)显示:总体重型irAEs中位发病时间为6周(0.5~63周),除原发性肾上腺皮质功能减退发病中位时间为14.5周,糖尿病为63周,其他均在6周内,提示重型irAEs患者大多在首次用药1~2周期内发病。
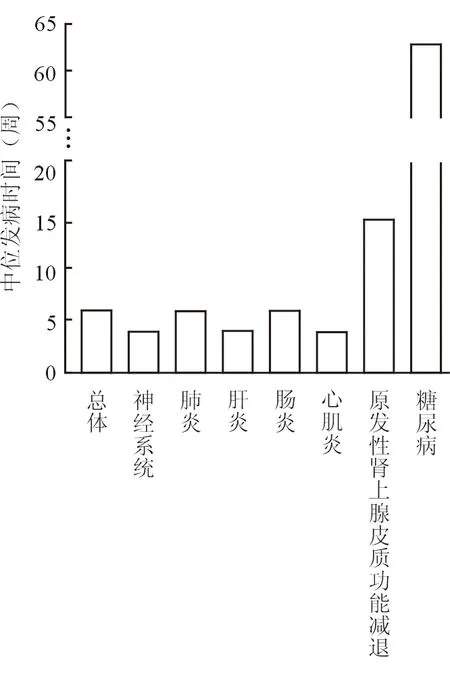
图1 各系统重型 irAEs从用药到首次发病中位时间
2.3 PD-1抑制剂使用情况 结果(表2)显示:纳武利尤单抗导致心肌炎发生率比较低。不同厂商来源的PD-1抑制剂导致的其他重型irAEs并无明显区别。
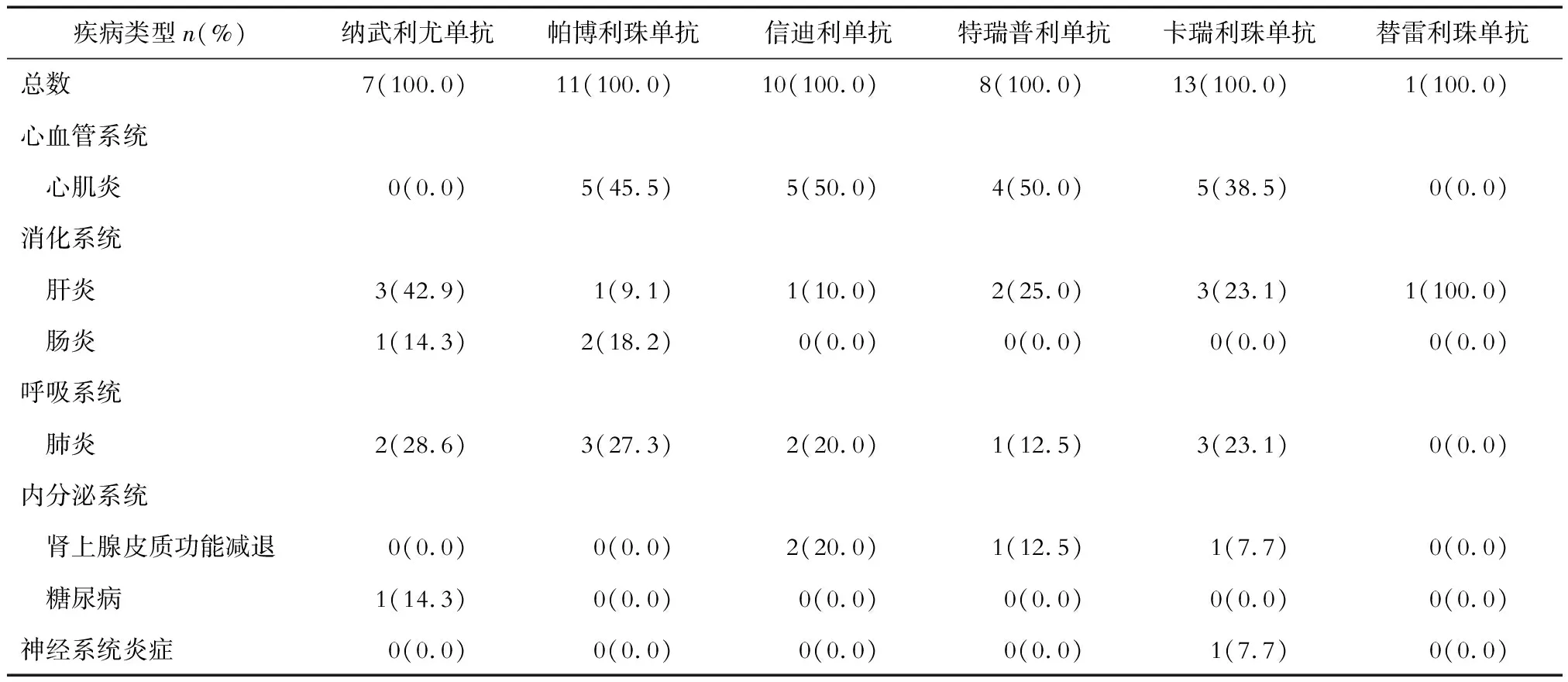
表2 50例重型irAEs患者不同PD-1抑制剂使用情况
2.4 预后影响因素分析 结果(表3)显示:死亡患者较好转者激素应用剂量更大[(267.27±190.22)vs(105.38±145.49)mg,P=0.021],联合应用其他免疫抑制剂比例更高(10.0%vs6.0%,P=0.000),提示对于重型irAEs患者,即使临床积极干预,预后仍不佳。在性别、年龄、发病距离首次用药时间、是否合并抗血管治疗及是否合并其他系统irAEs等差异均无统计学意义。

表3 好转和死亡患者基本情况分析
2.5 重型irAEs心肌炎分析 结果(表4)显示:心肌炎患者中男性占53%,中位年龄为64岁(28~71岁),中位发病时间为4周(0.5~36周),半数患者无明显症状,有症状者多表现为气促、乏力、胸痛等。如表3所示,心肌炎患者多合并其他系统受累,以甲状腺炎、肌炎、皮疹为主。89.5%(17例)患者全身使用激素,其中50%患者激素剂量大于2 mg·kg-1·d-1, 31.5%(6例)患者初始使用甲强龙500 mg/d冲击治疗。42.1%(8例)患者除糖皮质激素外,联合应用其他免疫抑制,主要有丙种球蛋白、托法替布、英夫利昔单抗,其中1例患者进行血浆置换。73.7%(14例)患者好转,26.3%(5例)患者死亡。5例死亡患者中激素使用剂量均至少为2 mg·kg-1·d-1,3例患者联合应用其他免疫抑制剂。
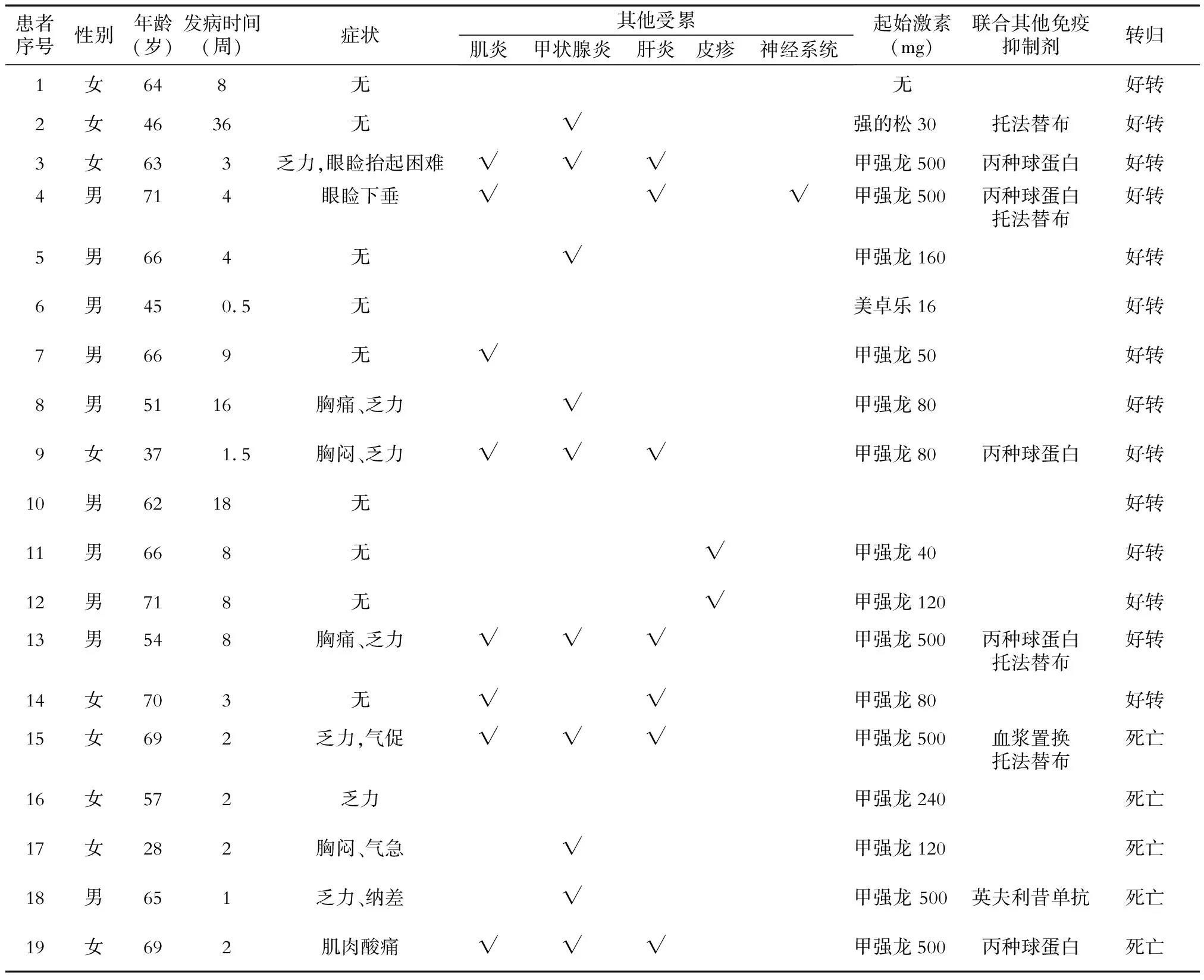
表4 19例心肌炎患者基本情况
结果(图2)显示:相比于好转组,心肌炎死亡患者的NT-proBNP和cTnT明显升高(12 844vs479.7 pg/mL,P=0.000 6;0.928vs0.233 ng/mL,P=0.006 4)。但左室射血分数差异无统计学意义(62.75%vs65.11%,P=0.348 2)。因此,cTnT和NT-proBNP升高是心肌炎预后不良的指征。

图2 心肌炎死亡和好转患者cTnT、NT-proBNP和左室射血分数比较
3 讨 论
随着ICIs的广泛应用,临床医师应充分了解其相关不良反应。既往irAEs数据大部分来自临床试验、meta分析及单个病例或病例系列报道,真实世界中irAEs发生情况报道很少。本研究为国内真实世界中较大病例数重型irAEs的分析报告。本研究纳入患者均为重症患者,且近半数为心肌炎,好转率78%,说明总体上糖皮质激素治疗对重型irAEs相对有效,但部分患者预后仍较差。死亡患者中糖皮质激素已是大剂量,且超过半数患者加用其他免疫抑制剂,仍难以挽回,提示进一步研究irAEs的发病机制,开发更有效的药物是未来研究方向。
抗PD-1治疗多发生肺炎、甲状腺功能减退、白癜风和关节痛,而抗CTLA-4单药治疗最常见的是结肠炎/腹泻,垂体炎和皮疹也多见于CTLA-4治疗[6]。大部分irAEs症状较轻,但心肌炎、部分肺炎、肝炎、结肠炎和神经系统毒性有致命可能。在既往临床试验[4]中,超过13%的PD-1单药治疗患者因发生重型irAEs而停止免疫治疗。
一项包含112个ICIs临床试验19 217病例的meta分析[5]显示,抗PD-1、PD-L1、CTLA-4和联合治疗引起致命性irAEs发生率分别为0.36%、0.38%、1.08%和1.23%。研究[5]显示,2009至2018年Vigilyze数据库中收录的613例致死性irAEs中,70%抗CTLA-4导致的irAEs死亡事件为结肠炎,抗PD-1/PD-L1的主要致死性irAEs为肺炎、肝炎、神经毒性和心肌炎。与该报道一致,本研究死亡病例中心肌炎占全部病例的45.5%(5/11),肝炎占45.5%(5/11),肺炎占9%(1/11),为重型irAEs主要致死原因。
发作时间上,irAEs既可即刻发生,亦可延长至2年后[7]。大部分irAEs发生在首次用药后1~2个月[8-9]。重型irAEs发生时间也相对较早,联合治疗通常为首次用药的14.5 d,单药平均发作时间为40 d。一项包含7个国际多中心研究[5]报道,发生致死性irAEs中位发病时间为起始治疗后15 d。本研究总体发病时间为6周,处于既往报道时间内。本研究中死亡患者较好转患者发病距离首次应用时间缩短一半[(5.6±6.19)vs(11.10±12.44)周],差异无统计学意义,可能与病例数相对较少有关。在分析导致各系统重型irAEs的不同厂商PD-1抑制剂时发现,除纳武利尤单抗可能不易发生心肌炎外,其余并无差别,可能也与病例数相对较少有关。替雷利珠发生重型irAEs相对较少,可能与其较晚进入临床应用有关。
通常认为irAEs不可预测。PD-1/PD-L1抑制剂联合CTLA-4抑制剂增加irAEs的发生风险,尤其是结肠炎的发生[10]。本研究纳入的3例结肠炎患者,有1例为CTLA-4抑制剂联合PD-1抑制剂。最近一项研究[11]表明,炎症性肠病患者应用ICIs,胃肠道irAEs发生率为41%,远高于正常组的11%。本研究中有6例患者既往有风湿免疫系统疾病病史或自身抗体阳性,提示这部分人可能体内存在更低的免疫调定点,更易发生irAEs,但仍需更大样本量的研究数据支持。
ICIs相关性心肌炎为罕见并发症,目前报道发病率为0.09%~1.14%[12-13],推测实际发病率更高。本研究心肌炎患者19例,与本研究纳入标准为重型irAEs及本中心成立国内首家irAEs多学科诊疗门诊有关。本研究心肌炎患者的中位发病时间为4周,与国际上报道的心肌炎中位发病时间27 d[14]和34 d[13]吻合,提示心肌炎发病时间较早。有研究[14]分析101例心肌炎患者发现,25%合并肌炎,10%合并重症肌无力,4%合并结肠炎。本研究也发现,与其他系统irAEs通常单个系统受累不同,心肌炎患者易合并肌炎、肝炎和甲状腺功能减低。通常重症患者入院表现为肌钙蛋白、肌红蛋白、肌酸激酶、转氨酶、NT-proBNP明显升高。且发病时间往往较早,ICIs用药1个周期后即可发病。心肌炎死亡率则高达35%~50%[13~18]。即使早期干预,积极治疗,病死率仍可高达23%[19]。本中心处理心肌炎经验相对丰富,病死率仍为26.3%,与已有报道[19]一致。另外,本研究发现,死亡患者肌钙蛋白和NT-proBNP均明显高于好转患者,而两者间左室射血分数无明显差异。上述101例心肌炎患者中亦发现,cTnT≥1.5 ng/mL时发生严重心血管不良事件的风险增加4倍(95% CI 1.5~10.9,P=0.003),但该研究并未发现NT-proBNP/BNP在2组间有差异[13]。
目前认为,何种人群会发生irAEs不可预测,早期识别并采取强有力的控制措施是管理irAEs的关键。未来需要在多学科治疗模式的基础上,积极探索发病机制、预测危险人群及综合管理[20]。另外,免疫抑制剂治疗相对安全,重症irAEs发生率相对较低,临床医师在提高irAEs意识的同时,不需要因此降低此类有效药物的临床使用。由于本研究为真实世界中irAEs单中心回顾性分析,相对于大型临床试验及高质量meta分析而言,病例数仍相对较少,存在一定偏倚,后续本中心将前瞻性设计分析真实世界中irAEs的发生情况,为irAEs的更优化管理及有关部门制定指南提供数据支持。

