紧扣课程标准学习非金属及其化合物
■杨 锐
一、抓住化合价变化的主线学习非金属及其化合物的变化
2017年版普通高中化学课程标准,在“元素与物质”部分要求“认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化”。学习中,抓住了该关键点,就抓住了学习非金属及其化合物部分的必备知识,从而就可以实现与该部分知识有关的关键能力的提升。
以氮元素为例,它的化合价有-3 价(NH3)、0 价(N2)、+1 价(N2O)、+2 价(NO)、+3 价(N2O3、HNO2)、+4 价(NO2、N2O4)、+5价(N2O5、HNO3)。
中学化学教材中重点介绍的转化关系如下:
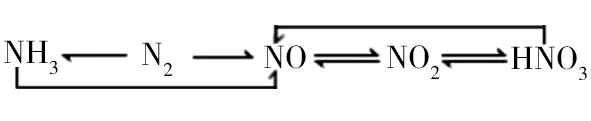
对于这些重要的转化反应,大家应该从每个反应参加物质的组成、状态、颜色、气味,以及反应条件、反应现象,特别是要从氧化还原反应角度对其进行全面掌握。
例1 图1是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( )。
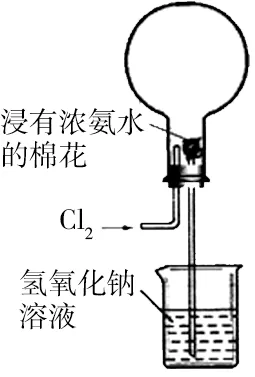
图1
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体

浓氨水挥发出NH3,NH3中N 是-3价,具有还原性,Cl2具有强氧化性,根据题意,二者发生反应3Cl2+2NH3══N2+6HCl,继而NH3和HCl反应生成固体NH4Cl,产生白烟。
答案:B
例2 采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)1840 年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种气体,其分子式为____。

氧化反应由 Cl2引发,AgNO3中Ag、N 均处于其最高价,所以被氧化的只能是负二价氧元素,根据已有知识和题中条件,氧化产物应为O2。即反应方程式为4AgNO3+2Cl2══4AgCl+2N2O5+O2。
答案:O2
例3 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为____。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为____(填化学式)。
(3)H3PO2的工业制法:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:_____。

(2)①根据氢+1价、氧-2价,并依据整个分子化合价“代数和为零”的原则计算出其中的磷元素为+1价。这种计算元素化合价的方法,对于高中学习非常重要。
②Ag+还原为银,即银离子为氧化剂,H3PO2中还原性最强的应该是+1 价的P。Ag+和+1价P个数比4∶1相互反应,每个P需要升高4价,即氧化产物为H3PO4。
(3)反应过程中白磷中零价的P 发生“歧化反应”,生成-3 价P 的化合物PH3和+1 价P的化合物Ba(H2PO2)2,即反应生成PH3和Ba(H2PO2)2的个数比为2∶3。反应方程式为2P4+3Ba(OH)2+6H2O ══2PH3↑+3Ba(H2PO2)2。该方程式配平时,使用到了一个很重要的化学学科思想方法,即在水溶液中进行的反应配平时,根据需要可以把H2O 作为反应物或产物进行补充。
(2)①+1
②H3PO4
(3)2P4+3Ba(OH)2+6H2O ══2PH3↑+3Ba(H2PO2)2
二、联系化学实验和生产、生活实际学习非金属及其化合物知识
课程标准的课程内容部分,关于“非金属及其化合物”部分的描述为“结合真实情境中的应用实例或通过实验探究,了解氯、氮、硫及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响”。历年的高考试题也都遵照这样的要求,通过与化学实验、环境保护和生产、生活实例,考查非金属及其化合物知识。

1.结合化学实验学习非金属及其化合物知识。
例4 喷泉实验装置如图2所示。应用下列各组气体-溶液,能出现喷泉现象的是( )。
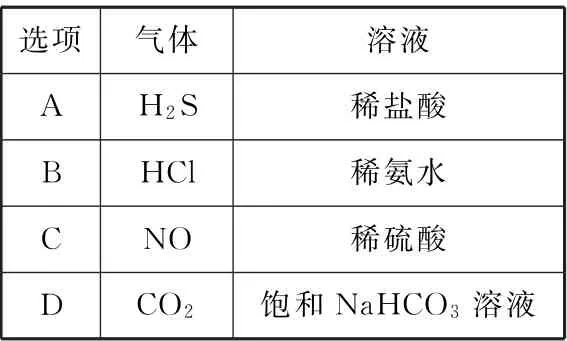
选项气体溶液_________A H2S稀盐酸_______B HCl稀氨水________C NO稀硫酸________D CO2饱和NaHCO3 溶液__
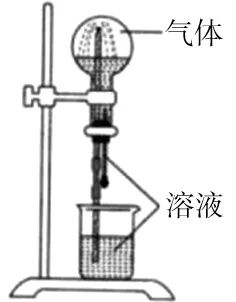
图2
要想在如图所示的装置中形成喷泉,气体必须易溶于对应的溶液。联想HCl与水的喷泉实验,结合HCl与氨水的中和反应,即可得出答案。
答案:B
例5 下列气体去除杂质的方法中,不能实现目的的是( )。


选项气体(杂质)方法__________A SO2(H2S)通过酸性高锰酸钾溶液B Cl2(HCl)通过饱和食盐水____C N2(O2)通过灼热的铜丝网___D NO(NO2)通过氢氧化钠溶液___

A 选项中的两种气体虽然能够发生反应,但是在实际情境中二者是能够共同存在的。但二者均易与酸性高锰酸钾溶液反应,即A 选项不能实现实验目的。B 选项中Cl2难溶于饱和食盐水,HCl则易溶,C选项中通过灼热的铜丝网时,O2反应转化成CuO,N2则不反应,即B、C选项均能达到实验目的。D 选项虽然能够发生两种气体同时被反应吸收的情况,但是除去NO 中少量杂质NO2的目的还是可以达到的。作为单项选择题,结合实际情景进行优化选择,应该不难得出答案。
答案:A
2.结合环境问题学习非金属及其化合物知识。
例6 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图3)。下列叙述错误的是( )。

图3
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关

NH3参与了反应但没有重新在后续的反应中生成,它不是形成无机颗粒物的催化剂,即C 选项符合题意较为明显,做题时对不熟悉的A、D 选项不需要过多考虑。雾和霾的分散剂都是相同的空气,过度施用氮肥当然会导致作物及土壤中氮元素增加,容易产生雾霾。
答案:C
3.联系生产实际学习非金属及其化合物知识。
例7 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用图4所示装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
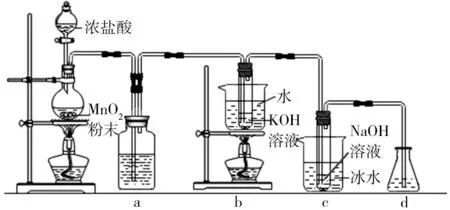
图4
回答下列问题:
(1)盛放MnO2粉末的仪器名称是_____,a中的试剂为_____。
(2)b中采用的加热方式是_____,c中化学反应的离子方程式是_____,采用冰水浴冷却的目的是____。
(3)d 的作用是_____,可选用试剂_____(填标号)。
A.Na2S B.NaCl
C.Ca(OH)2D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,____,____,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO 溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2 号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力_____(填“大于”或“小于”)NaClO。

第(1)(3)两问,考查了该部分最基本的知识,靠记忆和简单的知识迁移即可解决问题。
第(2)问,要结合实验目的是制备+5价Cl的K 盐和+1 价Cl的钠盐,进行对比分析,才能得出正确的离子方程式和不同加热方式的原因。
第(4)问考查了基本的化学实验操作。结晶后需要过滤顺理成章,接下来需要洗涤过滤所得固体,除去表面吸附的其他杂质,大家可能容易漏答。它同样属于化学实验的基本问题,关于洗涤漏斗中固体的方法,大家也要注意掌握。
第(5)问,2号试管中生成了I2而1号试管则没有发生类似反应,根据氧化还原反应的规律,KClO3的氧化能力应小于NaClO。这种敢于从事实出发,根据规律得出结论的勇气和思维方法非常重要,这也正是核心素养的体现。
答案:(1)圆底烧瓶 饱和食盐水
(2)水浴加热 Cl2+2OH-══ClO-+Cl-+H2O 避免生成NaClO3
(3)吸收尾气(Cl2) AC
(4)过滤 少量(冷)水洗涤
(5)紫 小于
总之,学习非金属及其化合物知识,必须用氧化还原反应的规律进行统领,使基础知识“系统化、网络化”。在掌握各种物质基本反应规律的基础上,结合不同的实际情景,灵活运用必备知识,解决相关问题。

