生物基聚对苯二甲酸丙二醇酯低聚物的提取及其热性能
王晶晶,陈 咏,王朝生,王华平,,边树昌,乌 婧
(1. 东华大学 材料科学与工程学院,上海 201620; 2. 东华大学 纺织产业关键技术协同创新中心,上海 201620; 3. 江苏国望高科纤维有限公司,江苏 苏州 215000)
熔融本体聚合制备逐步缩聚物的过程中,受热力学驱动,聚合物中常含有一定比例的低聚物[1-2]。由于其相对分子质量较低,易在聚合物后续加工过程中迁移[3-5],会极大干扰聚合[6]、纺丝和染色等多个生产环节[7-9]。对纤维级聚酯切片所含低聚物进行定性、定量分析,并针对性地降低纤维生产加工过程中低聚物的含量,对于提升聚酯纤维的生产效率及后道产品品质具有重要研究意义。Franz等[10]在1967年首次对聚对苯二甲酸乙二醇酯(PET)中低聚物进行了提取分离工作。结果表明,PET切片中低聚物质量分数约为2%~3%,纤维中低聚物质量分数约为2.5%~3%[11-12];低聚物的主要成分为环状三聚体。Weijers等[13]对聚对苯二甲酸丁二醇(PBT)中的低聚物进行定性定量分析发现,PBT中低聚物的总含量约为1%~2%,其中环状二聚体为主要成分。随着聚对苯二甲酸丙二醇酯(PTT)的成功产业化,研究人员也针对PTT所含低聚物进行了研究。Bumchan等[14]利用溶解-沉淀法对PTT进行提取发现,其低聚物主要由环状二、四、五聚体组成,含量最高的为环状二聚体,占总样品质量的2.5%。与此相反,宛新华等[15]利用“假高稀”条件在冰水浴条件下合成了PTT环状低聚物,产物主要由二、三、四、五、七聚体组成,其中三聚体含量最高,质量分数为34.9%。总体而言,基于已有研究工作,PTT中环状低聚物的含量较PET(1%~3%)和PBT(1%~2%)更高,甚至可达3%~5%左右[16-17]。
近年来,随着有机物提取分离技术的进一步发展,多种方法在芳香族聚酯低聚物的提取研究中均获得了应用。主要包含基于传统技术发展起来的溶剂溶解-沉淀法和索氏萃取法[18-19],以及基于现代技术发展起来的超声波萃取法和超临界流体萃取法等[13, 20-21]。然而,目前的所有方法都存在一定的局限性,且环状低聚物的提取结果与所使用的提取方法密切相关。
生物基PTT作为我国新型聚酯品种,其大容量、高品质化生产对于我国生物基纤维产业的升级具有重要的战略意义。鉴于前述低聚物,特别是环状低聚物对于聚酯生产的多个环节均存在潜在影响,样品的形态也会对聚酯样品内部的低聚物迁移性有一定的影响。综合考虑实验成本及装置的简易性[22-23],本文采用溶解-沉淀法和索氏萃取法对生物基PTT进行提取。本文研究的生物基PTT样品形态主要包括切片、粉末和纤维,对其所含低聚物进行定性定量分析,并研究其热学性能,以期为深入理解生物基PTT中低聚物对于聚合、纺丝和后道加工的多个生产环节的影响提供参考。
1 实验部分
1.1 主要原料
生物基PTT样品(PTT-1,盛虹集团有限公司;PTT-2,美景荣化学工业有限公司;PTT-3,美国杜邦公司);氯仿、1,4-二氧六环(分析纯,国药集团化学试剂有限公司);六氟异丙醇(质量分数为99%,沃凯化工科技有限公司);甲醇、四氢呋喃(上海凌峰化学试剂有限公司);氘代氯仿、乙醇(质量分数为95%,上海金畔生物科技有限公司);二甲基甲酰胺(分析纯,阿达玛斯试剂有限公司)。3种生物基聚酯样品的相关物理性能参数如表1所示。
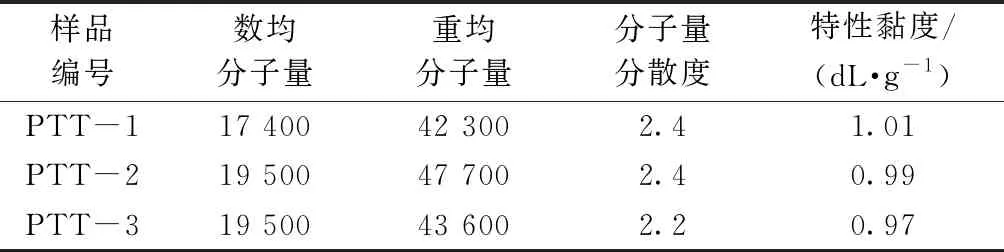
表1 生物基PTT物理性能参数Tab.1 Bio-based PTT polyester physical properties
1.2 生物基PTT纤维的制备
将3种生物基PTT切片进行熔融纺丝,设置喷丝板孔数为36,孔径为0.5 mm,长径比为1.5,纺丝速度为800 m/min,热牵伸倍率为3.5,控制热辊温度为80 ℃,热板温度为160 ℃,牵伸速度为 200 m/min。 控制一区、二区、三区、四区温度分别为270、280、275、275 ℃。将制得的纤维用乙醇洗去表面油剂,干燥后对生物基PTT纤维进行环状低聚物提取。
1.3 生物基PTT粉末的制备
将3种生物基PTT切片置于粉碎机内,以液氮保护,打碎至直径约为10 μm的粉末。
1.4 生物基PTT环状低聚物提取方法
1.4.1 溶解-沉淀法
将约6 g生物基PTT样品(切片、纤维)加入至120 mL的六氟异丙醇(HFIP)和氯仿(CHCl3)的混合溶剂中,二者体积比为1∶3,于50 ℃搅拌0.5 h至聚合物完全溶解后,冷却至室温,加入240 mL甲醇沉降剂,常温搅拌0.5 h后,过滤并将滤液旋干得到白色环状低聚物粉末,进一步于50 ℃真空干燥至质量恒定。
1.4.2 索氏提取法
将约5 g生物基PTT样品(切片、粉末、纤维)置于索氏提取器中。分别以CHCl3、二氧六环及CHCl3/二氧六环(二者体积比为1∶2)混合溶剂为萃取溶剂体系,进行反复回流提取得到环状低聚物粉末,探究不同萃取时间与萃取率的关系。
1.5 生物基PTT提取物表征
1.5.1 化学结构测试
采用Bruker Avance 3HD 600 Hz型核磁共振谱仪对样品的化学结构进行表征,溶剂为含四甲基硅氧烷(TMS)内标物的氘代氯仿(CDCl3),测试温度为25 ℃; 将溶解-沉淀法和索氏萃取法获得的提取物干燥后,分别称取5~10 mg样品溶解在适量CDCl3中,待样品溶解完全进行测试。
采用Nicolet 6700型傅里叶变换红外光谱仪对样品提取进行结构分析,使用ATR附件测试。
1.5.2 热性能测试
采用TAQ-20型差示扫描量热仪表征提取物的热学性能。取5~10 mg样品,测试温度由30 ℃升温至280 ℃,消除热历史后,以10 ℃/min降温速率降温至30 ℃,记录焓值(ΔH)随温度的变化曲线。
采用TA-Q5000IR型热重分析仪对低聚物热稳定性进行分析,称取1~3 mg聚酯粉末置于坩埚内,在氮气气氛(流速为50 mL/min)下,设定初始温度40 ℃,以10 ℃/min的速率升温至600 ℃。
1.5.3 高效液相色谱测试
采用C8-3型液相色谱柱(HPLC)进行测试,流动相溶剂体系为THF、CH3OH和H2O(三者体积比为5∶4∶1),紫外线(UV)检测器波长为254 nm,称取1 mg样品溶解在1 mL四氢呋喃溶液中,待样品完全溶解后,进样体积为10 μL,流速为1 mL/min。
1.5.4 基质辅助激光解吸电离飞行时间质谱测试
采用LDI-1700型激光解吸电离飞行时间质谱仪(MALDI-TOF)进行测试,采用N2激光器,脉冲持续3 ns,激光波长为337 nm,检测电压为-4.75 kV,激光质谱图采集约为200次扫描累加,以正离子谱测定,基质为1,8,9-蒽三酚(DHB),测试时吸取0.5 uL的混合溶液于样品探头靶心上,有机溶剂为二甲基甲酰胺。
2 结果和讨论
2.1 生物基PTT低聚物的提取量分析
2.1.1 溶解-沉淀法提取生物基PTT低聚物
针对生物基PTT切片和纤维样品,本文首先使用沉淀-溶解法对其进行环状低聚物提取。前期实验通过对HFIP和CHCl3混合溶剂体系的溶剂体积比为1∶1、1∶2、1∶3、1∶4、1∶5进行筛选发现,HFIP和CHCl3体积比小于1∶3时,PTT样品能够实现较好溶解,因此,以此溶剂体系作为溶解-沉淀法的溶剂。溶解-沉淀法的总体提取结果如表2所示。可知,生物基PTT纤维的低聚物提取量略高于切片,分别为2.7%~3.6%及2.6%~3.1%。纵向比较3种来源的生物基PTT,其低聚物提取量以PTT-3最高;经过熔融纺丝后低聚物的含量增加明显,高达3.55%。

表2 生物基PTT切片和纤维样品通过 溶解-沉淀法所得提取物含量Tab.2 Extraction content of bio-based PTT polyester chips and fiber samples by dissolution- precipitation method %
2.1.2 索氏提取法提取生物基PTT低聚物
对芳香聚酯环状低聚物进行索氏萃取时,常用的溶剂为氯仿、二氧六环、苯酚、氯苯、二甲苯以及氯仿/二氧六环混合溶剂等。根据相似相容原理,理想的萃取溶剂可在最大程度上将低聚物溶解,而保持对高聚物的低溶解度。根据文献[17]研究结果,较为高效的芳香聚酯环状低聚物提取溶剂为氯仿或氯仿/二氧六环混合溶剂体系。本文分别使用氯仿、二氧六环,以及氯仿/二氧六环(体积比为1∶2)混合溶剂,通过索氏萃取法对不同形态的生物基PTT样品(切片、粉末、纤维)所含低聚物进行定性、定量分析。图1示出以不同溶剂萃取PTT切片、粉末及纤维提取物含量与时间的关系。

图1 不同溶剂萃取PTT切片、粉末及 纤维提取物的质量分数与时间的关系Fig.1 Relationship between mass ratio of oligomer extracted from PTT chip, powder and fiber with different solvent. (a) Chloroform extraction;(b) Dioxane extraction;(c) Chloroform/dioxane extraction
根据图1可知,溶剂体系对萃取平衡时间无明显影响,而主要影响低聚物的萃取率。不同形态的样品在不同溶剂和萃取温度下,总体均可在15~18 h 达到萃取平衡。对比表2和图1结果可以看出,低聚物提取量:溶解-沉淀法<索氏萃取法;切片<粉末<纤维。由于粉末比表面积较大,其与溶剂的接触面积也较大,更有利于低聚物的萃取;溶解-沉淀法可提取所有的低聚物,其提取率理论上应该与多数文献报道的结果一致,即高于萃取法的提取率,然而本文所获得结果与之相反。其原因可能与溶解-沉淀提取过程中提取物的质量损失,以及PTT切片熔融纺丝过程中高温(280 ℃)促进低聚物的形成有关。纤维表面的提取物总含量为2.5%~3.6%。进一步利用扫描电镜(SEM)对PTT-2纤维表面形貌进行表征,结果如图2所示。可以看出,相较于表面粗糙且有附着物的纤维原样,溶剂萃取后的纤维表面更为光滑。

图2 索氏提取前后生物基PTT-2纤维表面 形貌扫描电镜照片Fig.2 Surface SEM images of bio-based PTT-2 polyester fiber before(a)and after (b) Soxhlet extraction
2.2 生物基PTT提取物组分分离结果
为对上述溶解-沉淀法和索氏萃取法提取的产物的组分进行定性定量分析,其高效液相色谱图如图3所示,对应各组分含量如图4所示。可以看出,2种提取方法的提取物呈现相近的HPLC分离结果。提取物在保留时间分别为4.8、5.5、6.8、7.8、9.1、11.1 min时出现6个分离的峰,其中峰1为主要组分,含量高达85%~90%,其他5个峰所代表的组分总含量为10%~15%。

图3 生物基PTT-2切片经溶解-沉淀法和 索氏萃取法获得提取物的HPLC图Fig.3 Liquid chromatographic separation of oligomers extracted from bio-based PTT-2 chips via Soxhlet extraction and dissolution-precipitation methods
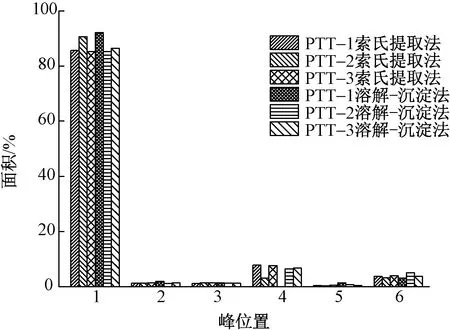
图4 生物基PTT切片提取物6种组分比例图Fig.4 Proportions of 6 extracted components of oligomers extracted from bio-based PTT polyester chips
2.3 环状低聚物组分化学结构分析
2.3.1 提取物的核磁共振谱图分析
对溶解-沉淀法和索氏萃取法提取物进行核磁共振表征,结果如图5所示。可知,2种方法获得的产物呈现较为类似的1HNMR谱图,且与PTT高聚物的谱图较为类似。化学位移δ为2.24~2.31处是1,3-PDO中间亚甲基氢的信号峰,δ在4.51~4.62范围内对应1,3-PDO与氧相连的亚甲基上氢的信号峰,而7.64~8.06处则为苯环上氢的信号峰。由谱图可以看出未出现活泼氢的核磁信号,提取物则较大可能为环状结构,而非直链结构。
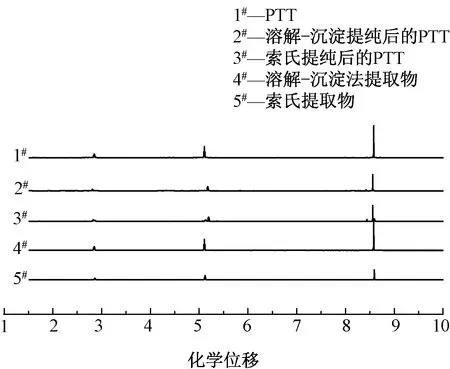
图5 生物基PTT切片提取物的核磁氢谱图Fig.5 1HNMR spectra of oligomers extracted from bio-based PTT polyester chips
2.3.2 提取物的红外谱图分析

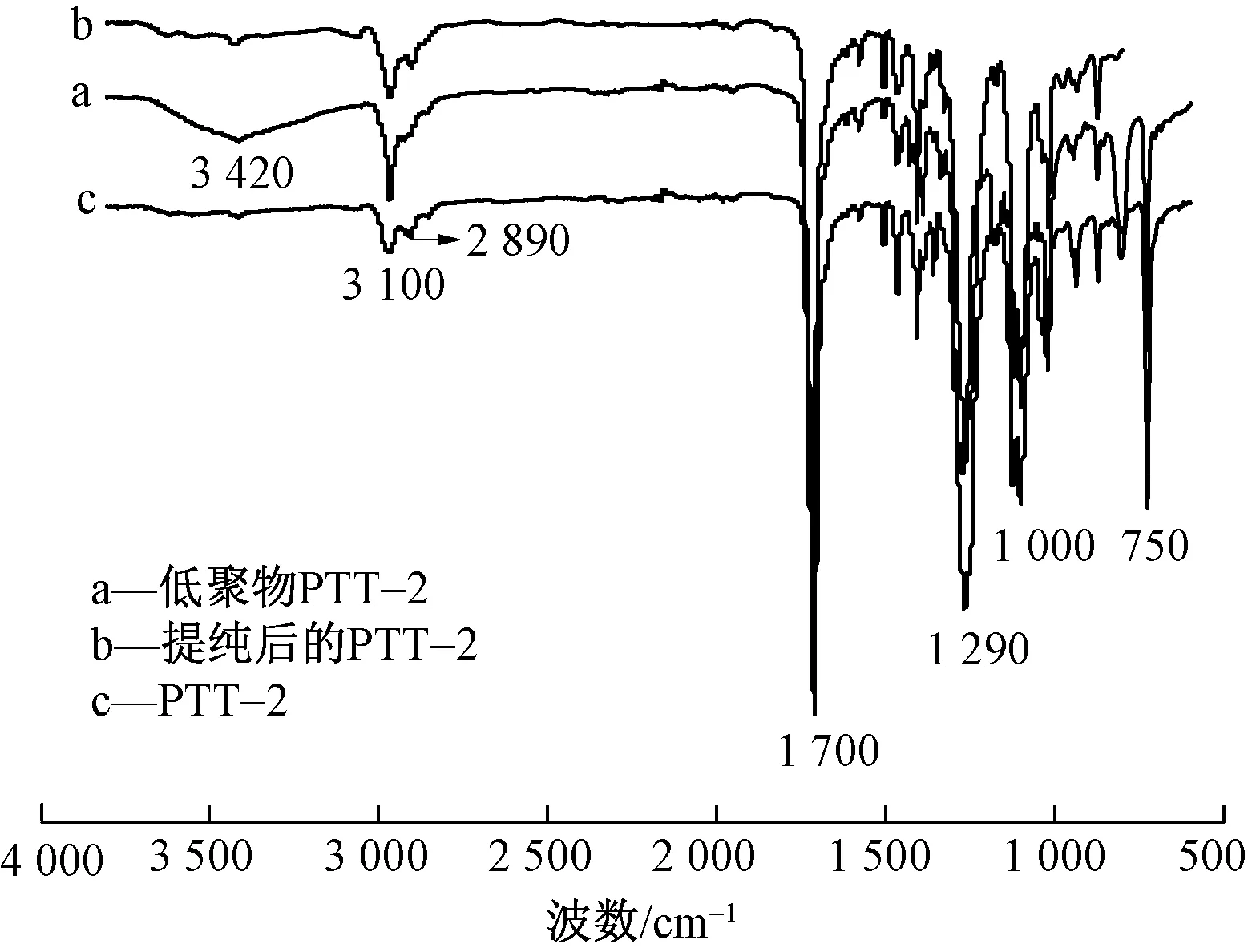
图6 生物基PTT-2切片索氏萃取法提取物的红外谱图Fig.6 Infrared spectra of extracts from bio-based PTT-2 polyester chips by Soxhlet extraction
2.3.3 提取物的MALDI-TOF质谱分析
由于环状低聚物化学结构特殊,其不具有直链低聚物和直链高聚物具有的羟基或羧基官能团,因而可利用质谱对其进行表征。本文以生物基PTT-2 切片经索氏萃取后的低聚物进行MALDI-TOF 分析,结果如图7所示。可知,萃取物中含有PTT环状二聚体(相对分子质量412)、环状三聚体(相对分子质量618)、环状四聚体(相对分子质量824)、环状五聚体(相对分子质量1 030)和环状七聚体(相对分子质量1 442)[24-26]。可能由于环状六聚体含量太低或仪器分辨率不足的原因,检测结果中无法判定其是否存在。尽管根据MALDI-TOF谱图中所有信号的强度无法对每种成分进行准确的定量分析,然而,与前述HPLC分析结果相对应,本文认为PTT提取物中的6种组分很可能包括环状二聚体(C2)、 环状三聚体(C3)、环状四聚体(C4)、环状五聚体(C5)、环状六聚体(C6)和环状七聚体(C7)。

图7 生物基PTT-2切片索氏提取物的 MALDI-TOF图Fig.7 MALDI-TOF plot of Soxhlet extract from bio-based PTT-2 polyester chips
2.4 生物基PTT低聚物的热稳定性分析
PTT主要应用于纤维以及工程塑料等,所以聚酯在加工过程(如纺丝、注塑等)中的热稳定性极其重要。对生物基PTT、提纯后的生物基PTT和提取物的热稳定性进行比较分析,结果如图8所示。可知,提取物的热稳定性明显低于未提纯以及提纯后的生物基PTT-2。提取物质量损失率约为5%时的温度(Td,5%)为287 ℃,而高聚物的Td,5%值高达363 ℃。 未提纯生物基PTT以及提纯后的PTT-2的Td,5%值差别不大,其原因可能是由于环状低聚物含量较少,其对热稳定性的影响并不明显。同时,低聚物呈现2个明显的质量损失台阶(340、396 ℃)。这很大可能与低聚物是由一系列聚合度不同的环聚体组成有关。
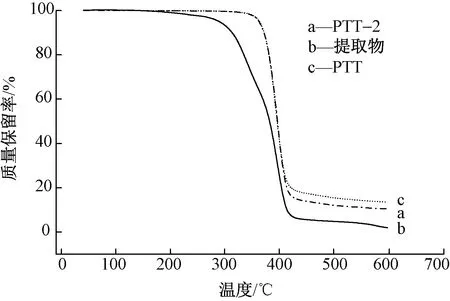
图8 热重分析曲线Fig.8 Thermogravimetric analysis curve
2.5 生物基PTT环状低聚物热学性能分析
生物基PTT环状低聚物的相对分子质量通常在在几百至1 000左右,与高聚物相对分子质量差异较大,其存在也会对聚酯的热力学性能造成一定影响。使用差示扫描量热法可表征环状低聚物的热学性能,从而进一步与PTT进行区分。由于生物基PTT主要的应用领域之一是作为纤维,且目前高低聚物含量的生物基PTT在纺丝过程中出现毛头、断丝现象严重,所以研究环状低聚物在聚酯常规加工过程如挤出、注塑和纺丝等的热学性能显得十分重要。图9示出生物基PTT-2索氏提取物的DSC曲线图。
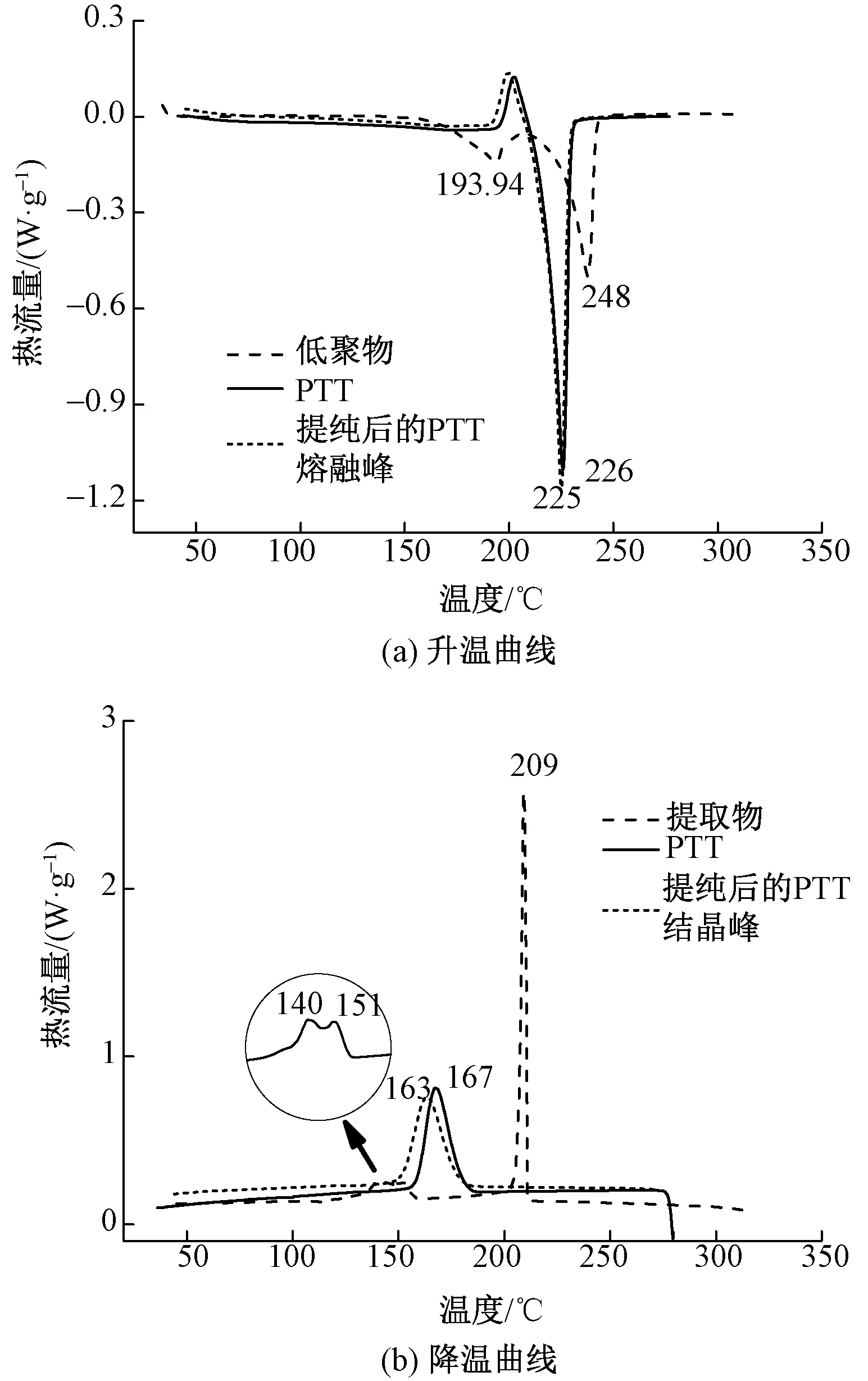
图9 生物基PTT-2索氏提取物的DSC曲线图Fig.9 DSC curves of oligomers extracted from bio-based PTT-2 polyester by Soxhlet extraction. (a) Heating curve; (b) Cooling curve
从图9可以看出,生物基PTT-2切片经索氏萃取后的环状低聚物在升温过程中出现2处明显的熔融峰,熔点分别为194和248 ℃,其中248 ℃为环状二聚体的熔点,与文献报道数据吻合[15],194 ℃熔融峰则推测为其他环状低聚物混合物呈现的熔点。环状二聚体熔点高于生物基PTT-2切片的熔点约20 ℃,熔融焓为67.23 J/g,低于PTT的熔融焓;生物基PTT-2的结晶温度比提取物低约 41 ℃,结晶焓高于提取物;提取物玻璃化转变温度比PTT-2高出20 ℃,高达80 ℃。主要是因为环状二聚体分子仅含有2个链段,分子链柔性较差,空间位阻较大。在结晶峰的曲线上,低聚物也有2处结晶峰,与熔融峰相对应。
3 结 论
本文以生物基PTT为原料,重点研究其所含低聚物的组分及其含量,并对提取的低聚物进行化学结构、热稳定性及热学性能分析,得出以下主要结论。
1)通过溶解-沉淀法和索氏提取法对生物基PTT进行提取发现,生物基PTT的低聚物质量分数约为3%,其中纤维样品的低聚物质量分数(3.6%)高于切片及粉末样品,其原因可能与纺丝高温条件下促进环状低聚物的生成有关。
2)对低聚物进行高效液相色谱分离及激光解吸电离飞行时间质谱分析发现,低聚物的主要组分为环状二聚体,其质量分数约为低聚物总量的 85%~90%; 同时检测出低含量的环状三聚体、环状四聚体、环状五聚体及环状七聚体,几种组分总含量约为10%~15%。而目前检测结果尚不能证实环状六聚体的存在。
3)生物基PTT环状低聚物的稳定性远低于PTT高聚物,其大量存在时可能严重影响高聚物的热稳定性,对PTT产品的品质产生较大影响。通过DSC方法对低聚物进行热学分析发现,环状低聚物具有比高聚物更高的熔融温度,其存在充当成核剂的作用,促进高聚物的结晶。

