Myriocin 抑制脂质诱导的整合应激反应延缓ApoE-/-小鼠动脉粥样硬化进展研究
于泽谋 李永超 郝洪军 黄一宁 彭清
有研究显示,整合应激反应与代谢性疾病和动脉粥样硬化密切相关[1]。整合应激反应系指真核生物受到不同刺激后,触发真核翻译起始因子2 α(eIF2α)在丝氨酸第51 位点磷酸化而介导的细胞适应性反应[2],但持续性整合应激反应或严重应激反应则可诱发细胞凋亡。研究显示,高脂饮食可使细胞摄取过多脂质而致内质网发生应激反应[3],而蛋白激酶R 样内质网激酶(PERK)通过与未折叠蛋白相结合激活eIF2α,进而诱发整合应激反应。在动脉粥样硬化形成的过程中,整合应激反应具有促进炎症小体形成和炎性因子释放的作用[1],且持续存在并贯穿于粥样硬化斑块(以下简称斑块)发生发展之全过程[4],抑制该反应可减少泡沫细胞形成、抑制炎症反应,从而延缓动脉粥样硬化进展[5]。本课题组前期研究显示,丝氨酸棕榈酰转移酶(SPT)抑制剂Myriocin 可以延缓动脉粥样硬化进展,但其潜在作用机制尚未阐明[6]。本研究旨在探索Myriocin对血管整合应激反应的作用。
材料与方法
一、实验材料
1. 实验动物 基因背景为C57BL/6J 雄性无特定病原体(SPF)级载脂蛋白E 基因敲除(ApoE-/-)小鼠共18 只,11 周龄,购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2016-0006],饲养于北京大学第一医院实验动物中心,温度18 ~22 ℃、湿度50%~60%,12 h 昼-12 h 夜循环照明,适应性喂养1 周后予高脂饲料(21%猪油+0.15%胆固醇,4.554 kCal/g,购自北京科奥协力饲料有限公司)喂养。动物实验操作过程严格遵循北京大学第一医院伦理委员会制定的规章制度(决议号:J201818)。
2.试剂与仪器 (1)药品与试剂:Myriocin 和红细胞裂解液购自美国Sigma 公司和Beckman Coulter公司。别藻蓝蛋白(APC)标记的CD115 抗体和藻红蛋白(PE)标记的淋巴细胞抗原6 复合体(Ly⁃6c)抗体(均1 ∶100)由美国Ebioscience 公司提供;TRIzol试剂为美国Life Technologies 公司产品,引物序列由北京天一辉远生物科技有限公司合成,TransScript First⁃Strand cDNA Synthesis SuperMix 和TransStart Top Green qPCR SuperMix 购自北京全式金生物技术有限公司;RIPA 裂解液由北京普利莱基因技术公司提供,二辛可宁酸(BCA)检测试剂盒为美国Thermo Pierce 公司产品,ECL 发光液购自美国Millipore 公司,Ⅰ抗工作液主要包括eIF2α、肌醇依赖酶1α(IRE1α)、活化转录激活因子4(ATF4)、p65核因子⁃κB(p65 NF⁃κB)和磷酸化p65 NF⁃κB 抗体(均1 ∶1000)购自美国CST 公司,磷酸化IRE1α抗体(1 ∶1000)购自美国Thermo 公司,Caspase12 抗体(1 ∶1000)购自英国Abcam 公司,单核细胞趋化蛋白⁃1(MCP⁃1)抗体(1 ∶100)购自美国Proteintech 公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgGⅡ抗(1 ∶5000)由北京中杉金桥生物技术有限公司提供,Alexa Fluor 488 标记的山羊抗兔IgGⅡ抗(1 ∶1000)为美国Jackson Immuno Research 公司产品。(2)设备与仪器:FACSCaliburTM 流式细胞仪购自美国BD 公司,全自动生化分析仪由美国Beckman 公司提供,石蜡切片机为德国Leica 公司产品,聚合酶链反应(PCR)仪购自美国Applied Biosystem 公司,实时荧光定量PCR 系统(CEX Connect Real⁃Time System)由美国Bio⁃Rad 公司提供,GBOX⁃CHEMI⁃XT4 型曝光仪为美国Syngen 公司产品,Eclipse Ti2 型光学显微镜和A1MP 型荧光共聚焦显微镜购自日本Nikon公司。
二、实验方法
1.实验动物分组 18 只ApoE-/-小鼠适应性喂养1 周后,于12 周龄时予高脂饲料和灌胃处理,采用随机数字表法随机分为两组,对照组予以磷酸盐缓冲液+ 5% Tween 80 灌 胃,Myriocin 组 予 以Myriocin 0.30 mg/(kg·d)[7]溶于磷酸盐缓冲液+5% Tween 80灌胃,灌胃容积均为100 μl/d,以免引起小鼠胃部不适或影响进食,持续喂养12 周。
2. 血清脂质测定 高脂饮食和灌胃处理12 周后,摘眼球采血约800 μl,4 ℃静置2 ~3 h,2737×g离心15 min。取上清液约200 μl,由北京大学第一医院检验科完成血清脂质[包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL⁃C)、极低密度脂蛋白胆固醇(VLDL⁃C)和高密度脂蛋白胆固醇(HDL⁃C)]测定。
3.流式细胞术检测单核细胞亚群比例 乙二胺四乙酸(EDTA)包被的EP 管中加入预冷磷酸盐缓冲液400 μl;高脂饮食和灌胃处理8 周后即小鼠20 周龄 时,于 尾 静 脉 采 血 约100 μ l;滴 加APC 标 记 的CD115 抗 体(1 ∶100)和PE 标 记 的Ly⁃6c 抗 体(1 ∶100)各5 μl,设立同型对照管,室温孵育约30 min;1173×g 离心5 min,弃上清液;滴加红细胞裂解液600 μl,振荡混匀,相同条件离心5 min,弃上清液;滴加磷酸盐缓冲液1 ml、振荡重悬,相同条件下离心5 min,弃上清液,重复操作一遍;最后滴加磷酸盐缓冲液200 μl、重悬,1 h 内上机行流式细胞术检测,采用FlowJo 流式细胞分析软件计算Ly⁃6chigh亚型单核细胞比例。
4.HE 染色和免疫荧光染色 以冷生理盐水灌注小鼠心脏,平行左右心耳连线下方约0.50 cm 处切开心脏,将心脏基底部连同升主动脉置于4%多聚甲醛溶液固定24 h;石蜡包埋,对主动脉窦部连续切片,层厚为4 μm,脱蜡、水化。(1)HE 染色:苏木素染细胞核4 min、伊红染色2 min,脱水、透明、封片;采用Image⁃Pro Plus 图像分析软件定量测定主动脉斑块面积,为避免切片角度带来的误差,计算斑块相对面积[斑块相对面积(%)=主动脉斑块面积/主动脉窦管腔面积×100%]。(2)免疫荧光染色:切片置于pH 值为9 的抗原修复液中,94 ℃水浴15 min,10%山羊血清封闭,室温孵育1 h,滴加MCP⁃1 抗体(1 ∶100)200 μl,4 ℃湿盒内过夜孵育,磷酸盐缓 冲 液 冲 洗5 min(×5 次),滴 加Alexa Fluor 488 标 记 的 山 羊 抗 兔IgG Ⅱ抗(1 ∶1000)200 μ l,37 ℃湿 盒 内 孵 育30 min,DEPI 封片液封片,于荧光共聚焦显微镜下观察MCP⁃1 阳性率,呈绿色荧光为MCP⁃1表达阳性。
5.实时荧光定量聚合酶链反应检测炎症反应和整合应激反应相关分子mRNA的表达 冷生理盐水灌注小鼠心脏,剥离主动脉、腹主动脉至髂总动脉,分为两段,将下段血管组织置于不含RNA 酶EP 管中,迅速转移至液氮中,再至⁃80 ℃冰箱保存;冰上匀浆组织,提取总RNA 10 μg,建立逆转录反应体系,获得cDNA;建立荧光定量PCR 反应体系,引物序列见表1,反应总体积20 μl,包括Template 1 μl,10 μ mol/L 正 向 引 物 和 逆 向 引 物 各0.50 μ l,2×TransStart Top Green qPCR SuperMix 10 μl,RNase⁃free Water 8 μl;反应条件为95 ℃预热10 min、94 ℃变 性5 s、60 ℃退 火40 s、65 ℃延 伸5 s,共40 个 循环。以β⁃肌动蛋白(β⁃actin)为内参照物,采用2-△△CT法计算炎症反应和整合应激反应相关分子mRNA相对表达量。炎症反应相关分子包括炎性因子白细胞介素⁃1β和6(IL⁃1β和IL⁃6)、肿瘤坏死因子⁃α(TNF⁃α)、细胞间黏附分子⁃1(ICAM⁃1)、血管细胞黏附分子⁃1(VCAM⁃1)、血管内皮生长因子(VEGF),以及抗炎性因子IL⁃10;整合应激反应相关分子包括葡萄 糖 调 节 蛋 白78(GRP78)、PERK、eIF2 α、ATF4、ATF6、内质网应激相关促凋亡蛋白C/EBP 同源蛋白(CHOP)和Caspase12。
6.Western blotting 法检测整合应激反应相关蛋白表达变化 提取血管组织总蛋白,BCA 法测定蛋白总量;行十二烷基磺酸钠⁃聚丙烯酰胺凝胶电泳(SDS⁃PAGE),电压150 V、持续时间40 min;蛋白质转移至聚偏二氟乙烯(PVDF)膜,恒流200 mA、持续120 min;5%脱脂牛奶,室温封闭1 h;滴加eIF2α、ATF4、IRE1α和磷酸化IRE1α、p65 NF⁃κB 和磷酸化p65 NF⁃κB、Caspase12(均1 ∶1000)5 ml,4 ℃摇床过夜孵育,TBST 缓冲液洗涤5 min(×5 次),滴加辣根过氧化物酶标记的山羊抗兔IgGⅡ抗(1 ∶5000);滴加ECL 发光液,自动曝光成像。以β⁃肌动蛋白或者α⁃微管蛋白(α⁃tubulin)为内参照物,采用Image J 软件计算目的蛋白相对表达量。

表1 实时荧光定量PCR 反应引物序列Table 1. Gene⁃specific primers
三、统计分析方法
采用SPSS 22.0 统计软件进行数据处理与分析。采用Levene 方差齐性检验检测方差齐性,呈正态分布的计量资料以均数±标准差(±s)表示,采用两独立样本的t 检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,采用Mann⁃Whitney U 检验。以P ≤0.05 为差异具有统计学意义。
结 果
经Myriocin 灌胃12 周后,小鼠血清LDL⁃C 水平低于对照组且差异有统计学意义(P = 0.012),而TC、TG、VLDL⁃C 和HDL⁃C 水平与对照组差异无统计学意义(均P >0.05,表2)。
流式细胞术分析,经Myriocin 灌胃8 周后小鼠Ly⁃6chigh亚群单核细胞比例低于对照组且差异有统计学意义(P=0.011,表3)。
HE 染色显示,所有小鼠主动脉窦均发生动脉粥样硬化,但Myriocin 组斑块面积小于对照组(图1)。进一步定量分析,距主动脉瓣200 和300 μm处,Myriocin 组小鼠斑块面积小于对照组且差异有统计学意义(P=0.045,0.003;表4)。脂质坏死核是易损斑块的特征,Myriocin 组小鼠主动脉窦脂质坏死核相对面积小于对照组(P=0.004),表明Myriocin可有效抑制动脉粥样硬化进展(表5)。
表2 Myriocin 组与对照组小鼠血清脂质水平的比较(±s,mmol/L)Table 2. Comparison of serum lipids between Myriocin group and control group (±s, mmol/L)
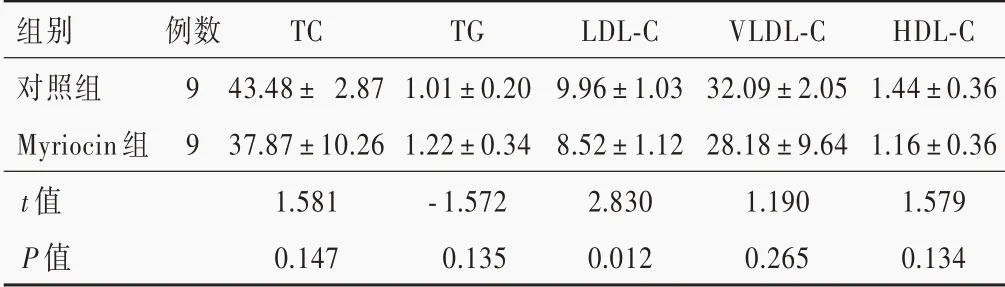
表2 Myriocin 组与对照组小鼠血清脂质水平的比较(±s,mmol/L)Table 2. Comparison of serum lipids between Myriocin group and control group (±s, mmol/L)
TC,total cholesterol,总胆固醇;TG,triglyceride,甘油三酯;LDL⁃C,low density lipoprotein⁃cholesterol,低密度脂蛋白胆固醇;VLDL⁃C,very low density lipoprotein⁃cholesterol,极低密 度 脂 蛋 白胆固醇;HDL⁃C,high density lipoprotein⁃cholesterol,高密度脂蛋白胆固醇
组别对照组Myriocin 组t 值P 值例数9 9 TC 43.48± 2.87 37.87±10.26 1.581 0.147 TG 1.01±0.20 1.22±0.34⁃1.572 0.135 LDL⁃C 9.96±1.03 8.52±1.12 2.830 0.012 VLDL⁃C 32.09±2.05 28.18±9.64 1.190 0.265 HDL⁃C 1.44±0.36 1.16±0.36 1.579 0.134
表3 Myriocin 组与对照组小鼠灌胃8 周后Ly⁃6chigh亚型单核细胞比例的比较(±s,%)Table 3. Comparison of the percentage of Ly⁃6chigh monocytes among total monocytes between Myriocin group and control group(±s, %)
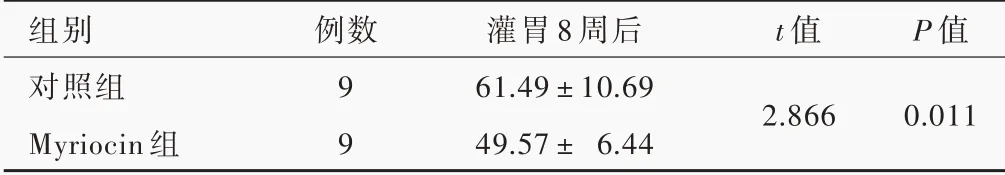
表3 Myriocin 组与对照组小鼠灌胃8 周后Ly⁃6chigh亚型单核细胞比例的比较(±s,%)Table 3. Comparison of the percentage of Ly⁃6chigh monocytes among total monocytes between Myriocin group and control group(±s, %)
组别对照组Myriocin 组例数9 9灌胃8 周后61.49±10.69 49.57± 6.44 t 值2.866 P 值0.011
免疫荧光染色显示,小鼠主动脉窦斑块内均可见绿色荧光标记的MCP⁃1,但Myriocin 组MCP⁃1 表达水平低于对照组(图2)。实时荧光定量PCR 显示,与 对 照 组 相 比,Myriocin 组 小 鼠IL⁃1 β mRNA(P = 0.005)、TNF⁃α mRNA(P = 0.000)、ICAM⁃1 mRNA(P = 0.013)、VCAM⁃1 mRNA(P = 0.001)和VEGF mRNA(P = 0.037)表达水平均降低,IL⁃10 mRNA 表达水平升高(P=0.017),而IL⁃6 mRNA 组间差异无统计学意义(P >0.05),表明Myriocin 可下调炎性因子mRNA 的表达,上调抗炎性因子mRNA的表达(表6)。提示Myriocin 可有效抑制血管组织炎症反应。
Myriocin 组小鼠整合应激反应相关分子PERK mRNA(P = 0.004)、eIF2α mRNA(P = 0.007)、ATF4 mRNA(P = 0.012)、ATF6 mRNA(P = 0.001)和Caspase12 mRNA(P = 0.000)表 达 水 平 降 低,而GRP78 mRNA 和CHOP mRNA 组间差异无统计学意义(均P >0.05,表7)。Western blotting 法显示,与对照组相比,Myriocin 组小鼠eIF2α(P=0.047)、ATF4(P=0.011)和磷酸化p65 NF⁃κB/总p65 NF⁃κB比 值(P = 0.011)下 降,而 磷 酸 化IRE1 α/总IRE1α 比值和活化型Caspase12/总Caspase12比值组间差异未达到统计学意义(均P >0.05;表8,图3 ~7)。表 明Myriocin 可 以 抑 制 由PERK/eIF2α/ATF4 信号转导通路介导的整合应激反应。
讨 论
Myriocin 源自一种传统真菌类中药——冬虫夏草,其作为丝氨酸棕榈酰转移酶抑制剂,可抑制鞘脂合成,从而延缓动脉粥样硬化进展[6⁃8]。内质网应激反应是整合应激反应的中心环节,在动脉粥样硬化的发生发展过程中发挥重要作用[4]。本课题组的前期研究证实Myriocin 可延缓动脉粥样硬化进展[6],本研究进一步探讨Myriocin 作用机制是否与抑制整合应激反应有关。关于Myriocin 的剂量,文献报道其常用剂量为0.30 mg/(kg·d)[7⁃14]。Park 等[10]探讨不同剂量Myriocin[0.10、0.30 和1 mg/(kg·d)]对ApoE-/-小鼠血清脂质水平和动脉粥样硬化进展的影响,其结果显示,Myriocin 治疗12 周后0.30 mg/(kg·d)组小鼠动脉粥样硬化面积减少93%。本研究以Park 等[10]的方案为依据,同样采取Myriocin 0.30 mg/(kg·d)对ApoE-/-小鼠灌胃治疗。
本研究经Myriocin 灌胃治疗12 周后,小鼠血清LDL⁃C 水平较对照组降低。已知Myriocin 药理作用为抑制鞘脂合成,后者是脂蛋白颗粒的组成成分,因此可部分解释Myriocin 组小鼠血清LDL⁃C 水平降低的现象。通过对主动脉窦部进行连续切片,定量分析斑块面积和脂质坏死核面积,结果显示,两组小鼠主动脉窦均发生动脉粥样硬化,但Myriocin 组斑块面积和脂质坏死核面积小于对照组,表明Myriocin 可有效减小斑块和脂质坏死核面积,发挥稳定斑块的作用。
外周血单核细胞在趋化因子的作用下,被募集进入动脉内膜。Raghavan 等[15]研究显示,与Ly⁃6clow表型相比,Ly⁃6chigh表型单核细胞更易形成泡沫细胞。Ly⁃6chigh表型单核细胞亚群为经典炎性细胞,可释放炎性因子,如IL⁃1、IL⁃6、TNF⁃α和MCP⁃1,导致血管功能障碍和泡沫细胞聚集[16]。本研究流式细胞术分析显示,经Myriocin 灌胃8 周后,与对照组相比,Myriocin 组小鼠Ly⁃6chigh亚群单核细胞比例下降约19.39%,表明Myriocin 可有效抑制外周血Ly⁃6chigh表型单核细胞,进而减少泡沫细胞的形成。
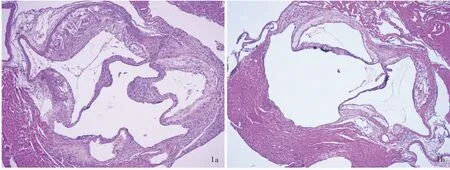
图1 光学显微镜观察所见 HE 染色 ×100 1a 对照组小鼠存在主动脉窦斑块 1b Myriocin 组小鼠主动脉窦斑块面积小于对照组Figure 1 Optical microscopy findings HE staining × 100 Control group mice had atherosclerotic lesions in their arotic sinus(Panel 1a). The lesions were smaller in Myriocin group (Panel 1b).
表4 Myriocin 组与对照组小鼠主动脉窦斑块相对面积的比较(±s,%)Table 4. Comparison of the percentage of plaque area between Myriocin group and control group (±s, %)
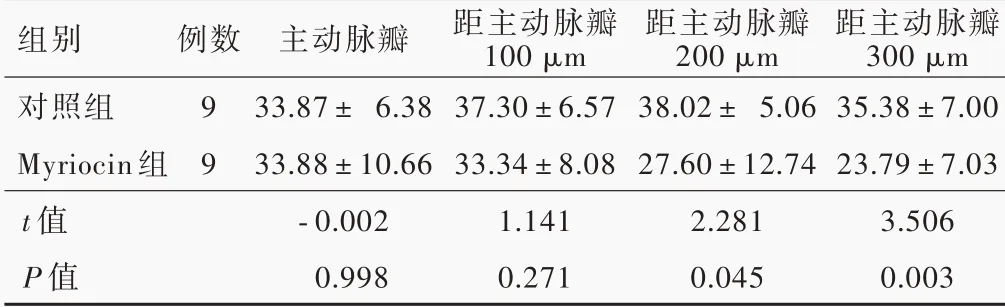
表4 Myriocin 组与对照组小鼠主动脉窦斑块相对面积的比较(±s,%)Table 4. Comparison of the percentage of plaque area between Myriocin group and control group (±s, %)
组别对照组Myriocin 组t 值P 值例数9 9主动脉瓣33.87± 6.38 33.88±10.66⁃0.002 0.998距主动脉瓣100 μm 37.30±6.57 33.34±8.08 1.141 0.271距主动脉瓣200 μm 38.02± 5.06 27.60±12.74 2.281 0.045距主动脉瓣300 μm 35.38±7.00 23.79±7.03 3.506 0.003
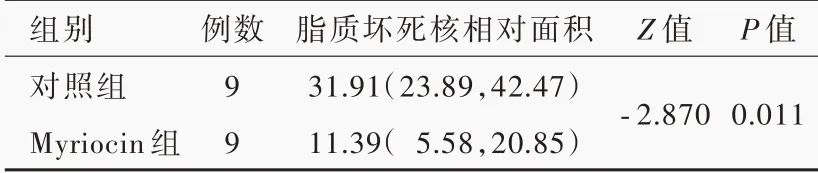
表5 Myriocin 组与对照组小鼠主动脉窦脂质坏死核相对面积的比较[M(P25,P75),%]Table 5. Comparison of the percentage of necrotic core area between Myriocin group and control group[M (P25, P75), %]
已知炎症与动脉粥样硬化过程中的泡沫细胞形成和斑块不稳定密切相关。本研究免疫荧光染色观察两组小鼠主动脉窦斑块内均可见绿色荧光标记的MCP⁃1,但Myriocin 组MCP⁃1 水平低于对照组;实时荧光定量PCR 显示,Myriocin 组小鼠炎性因子IL⁃1 β mRNA、TNF⁃α mRNA、ICAM⁃1 mRNA、VCAM⁃1 和VEGF mRNA 低于对照组,抗炎性因子IL⁃10 mRNA 水平高于对照组,表明Myriocin 具有抑制血管组织炎症反应的作用。
内质网应激反应可上调分子伴侣GRP78 的表达,促使GRP78 与PERK、IRE1α和ATF6 解离,启动未折叠蛋白反应[17];活化的PERK 可使下游底物eIF2α磷酸化,抑制蛋白质合成,同时上调ATF4 的表达[18];长期过度应激反应可上调CHOP 的表达,导致细胞凋亡,进而促进动脉粥样硬化进展[19]。既往研究显示,动脉粥样硬化发展至晚期,凋亡的巨噬细胞不能及时有效清除,继发坏死,进一步加重炎症反应和斑块进展[20]。细胞器应激反应相关信号转导通路与炎症信号转导通路之间存在交叉作用[21⁃22]。一方面,氧化修饰低密度脂蛋白(ox⁃LDL)可引起内质网应激反应,促进炎症反应,抑制血管内皮细胞脂质流出,导致血管内皮损伤[23];另一方面,巨噬细胞线粒体应激反应可促进炎症反应,加重动脉粥样硬化进展[24]。研究显示,PERK 激活eIF2α,既可以全面下调蛋白质合成、上调ATF4 表达、促进细胞凋亡,同时还具有促进NF⁃κB 活化的作用[4,21]。NF⁃κB 信号通路在炎症反应中发挥关键作用。本研究检测整合应激反应相关分子mRNA和蛋白水平,结果显示,Myriocin 组小鼠PERK mRNA、eIF2α mRNA、ATF4 mRNA、ATF6 mRNA 和Caspase12 mRNA,以及eIF2α、ATF4 和磷酸化p65 NF⁃κ B/总p65 NF⁃κ B 比 值 均 低 于 对 照 组,表 明Myriocin 可以抑制PERK/eIF2α/ATF4 通路介导的整合应激反应,以及NF⁃κB 信号转导通路介导的炎症反应。
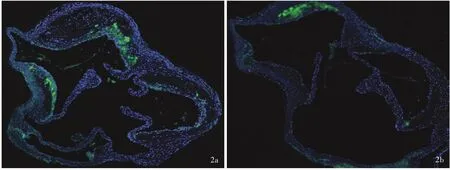
图2 荧光共聚焦显微镜观察所见 免疫荧光染色 ×100 2a 对照组小鼠主动脉窦斑块内可见MCP⁃1 蛋白表达(绿色荧光所示) 2b Myriocin 组小鼠主动脉窦斑块内MCP⁃1 蛋白表达量低于对照组(绿色荧光所示)Figure 2 Fluorescence confocal microscopy findings Immunofluorescence staining × 100 MCP ⁃ 1 was observed in the atherosclerotic lesions of control group (green color indicates, Panel 2a). The expression of MCP⁃1 was decreased in the atherosclerotic lesions of Myriocin group (green color indicates, Panel 2b).
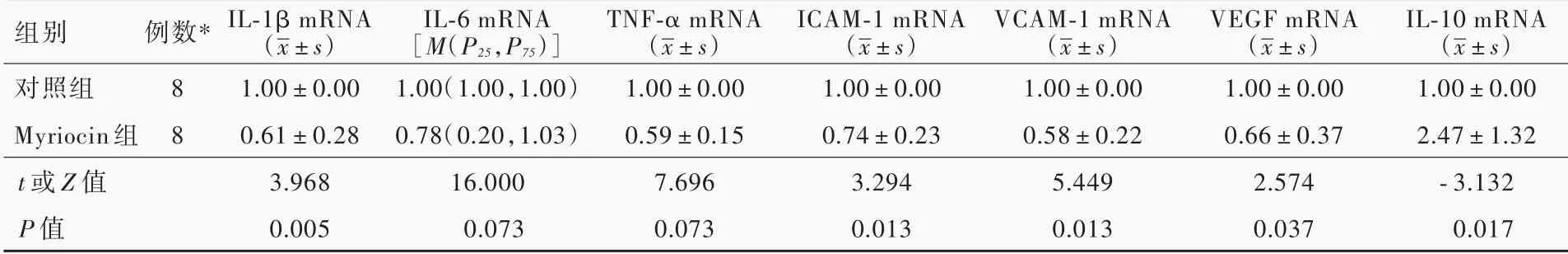
表6 Myriocin 组与对照组小鼠炎症反应相关分子mRNA 相对表达量的比较Table 6. Comparison of the mRNA expression levels of inflammation related molecules between Myriocin group and control group

表7 Myriocin 组与对照组小鼠整合应激反应相关分子mRNA 相对表达量的比较Table 7. Comparison of the mRNA expression levels of integrated stress response related molecules between Myriocin group and control group
综上所述,我们认为Myriocin 延缓ApoE-/-小鼠动脉粥样硬化进展涉及以下机制:(1)调节脂质代谢。(2)抑制血管组织脂质摄取分子的表达,如CD36、凝集素样氧化低密度脂蛋白受体⁃1(LOX⁃1)和清道夫受体A 型(SR⁃A)[6]。(3)抑制炎症反应。(4)抑制整合应激反应。Myriocin 除了抑制动脉粥样硬化进展外,还可改善胰岛素抵抗、稳定糖代谢、缓解肝脂肪变性[25⁃26]。因此我们认为,经对Myriocin 全面系统的药物安全性评价,该药物在预防与治疗动脉粥样硬化性血管病方面将有一定的临床应用前景,可与调脂药联合应用,尤其适用于对调脂药不敏感或无法耐受的患者。本研究仅为动物实验,无细胞实验的支持;而且未设置药物浓度梯度、未监测血药浓度,所检测的指标亦不够全面。进一步研究将在设立药物浓度梯度的基础上,进行细胞水平验证。

表8 Myriocin 组与对照组小鼠整合应激反应相关蛋白相对表达量的比较Table 8. Comparison of the protein expression levels of markers for integrated stress response between Myriocin group and control group

图3 Western blotting 检 测 显 示,Myriocin 组 小鼠eIF2α表达水平低于对照组Figure 3 Western blotting showed compared with control group, Myriocin reduced the expression of eIF2α.
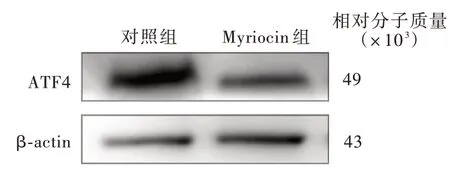
图4 Western blotting 检 测 显 示,Myriocin 组 小鼠ATF4 表达水平低于对照组Figure 4 Western blotting showed compared with control group, Myriocin reduced the expression of ATF4.

图5 Western blotting 检 测 显 示,Myriocin 组 小 鼠IRE1α磷酸化水平与对照组相比无显著降低Figure 5 Western blotting showed the expression of phosphorylation of IRE1 α was not significantly changed.

图6 Western blotting 检测显示,Myriocin 组小鼠磷酸化p65 NF⁃κB 表达水平低于对照组Figure 6 Western blotting showed compared with control group, Myriocin reduced the expression of p65 NF⁃κB.
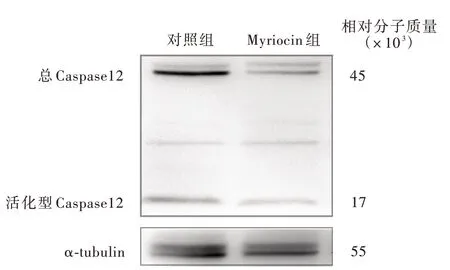
图7 Western blotting 检测显示,Myriocin 组小鼠活化Caspase12 表达水平与对照组相比无显著降低Figure 7 Western blotting showed the expression of phosphorylation of cleaved Caspase12 was not significantly changed.
利益冲突无

