恙虫病东方体感染对内皮细胞Tie2/Akt/Foxo1通路的影响
卫 阳,金迎迎,梁越进,邢 燕,4

恙虫病东方体(Orientiatsutsugamushi)是引起恙虫病的病原微生物,是一种脂多糖(Lipopolysaccharide, LPS)缺乏的革兰氏阴性菌,专性细胞内生存并可在感染的内皮细胞中自由复制[3]。位于组织和循环系统之间的内皮细胞(Endothelial cell,EC)层是炎症细胞运转的关键界面,内皮细胞间连接和血管泄漏密切相关。血管渗透性过高是急性炎症最重要的特征,细胞及体液免疫效应因子可利用血管泄漏进入感染或受损位置,引起宿主器官功能紊乱及休克等不良后果[4-5]。Tie2是一种跨膜内皮细胞酪氨酸激酶受体,是细胞间连接的一个重要分子,可调控血管形成及内皮细胞炎症和通透性。血管生成素(Angiopoietin, Ang)1和2是重要的Tie2的配体[6]。Ang1由内皮旁细胞产生,起激动作用,结合Tie2使其磷酸化,并通过Akt/Foxo1通路以维持血管完整性,抑制血管的泄漏、炎症因子的表达以及白细胞的招募和转移的作用;Ang2由内皮细胞自身产生,与Ang1竞争性地结合Tie2而对Tie2磷酸化起抑制作用,导致损伤和血管泄漏[7]。然而,有研究显示在无菌条件下,Ang2对Tie2信号有激活作用[8]。恙虫病东方体感染对宿主内皮细胞Tie2/Akt/Foxo1信号通路的具体影响尚不清楚。
本研究通过动物及内皮细胞感染实验,检测Tie2/Akt/Foxo1信号通路关键蛋白的表达和磷酸化水平、炎症因子和细胞通透相关蛋白的表达,以分析在恙虫病东方体感染宿主过程中,Tie2信号的变化及影响,为恙虫病的防治提供理论依据。
1 材料与方法
1.1细菌培养及分离 恙虫病东方体Karp株(OrientiatsutsugamushiKarpstrain,OtK)在 Vero E6 细胞(猴肾细胞系)中培养增殖。该实验在UTMB加尔维斯顿国家实验室的动物生物安全3级实验室(ABSL3 facility)进行。34 ℃轻摇2 h,再加入含有1% 胎牛血清(FBS)和1% HEPES 缓冲液的DMEM(Gibco)培养基中培养。通常在14~21 d,细胞变圆或有细胞浮起区域遍布培养瓶时,涂片用Dif-Quik(Fisher Scientific, Kalamazoo, MI)评估感染程度。当有80%-90%的细胞被感染,将这些细菌再次接种到新鲜的单层Vero细胞上。重复6遍后,收集细胞悬液,4 ℃,22 000×g 离心 45 min。将细胞沉淀在蔗糖磷酸-谷氨酸盐(sucrosephosphate-glutamate,SPG)缓冲液中重悬,再转移至50 mL含有5 mL无菌玻璃珠的锥形管中轻柔蜗旋,使释放细胞内细菌。700×g 离心收集含有细菌的上清液,22 000×g离心45 min,即得到无细胞的细菌沉淀。将细菌在SPG缓冲液中重悬,存于-80 °C。用于感染动物或细胞。
1.2斑点形成实验(Focus forming assays,FFA) 斑点形成实验对OtK活细菌数定量[9]。含1% FBS 和1% HEPES的DMEM培养基在37 ℃ 5% CO2孵箱中培养Vero E6细胞过夜,待细胞长汇合后,将连续10倍稀释的OtK菌液(200 μL)种到该细胞单层上。培养2 h后,用热的含钙和镁的Dulbecco’s PBS缓冲液洗培养板以移走细胞外死细菌。再加含1% FBS、0.5% 甲基纤维素和环十二碳三烯的DMEM细胞培养基到孔板上,在34 ℃培养5 d后,用甲醇4 ℃固定细胞。用含1% BSA的PBS室温下封闭培养孔30 min。加多克隆兔抗鼠OtK,室温孵育30 min。再加Alexa-594 山羊抗兔IgG(Invitrogen, Carlsbad CA)孵育30 min。倒置荧光显微镜下检测。取10~100个斑点的OtK感染孔计数,计算斑点形成单位的浓度定量活菌数。
1.3动物感染 C57BL/6J野生雌鼠购买自Jackson实验室,在无特定病原菌条件下饲养。根据美国德克萨斯大学医学分部动物保护和使用委员会批准的实验方法实验。所有小鼠感染研究均在UTMB加尔维斯顿国家实验室的动物生物安全3级实验室(ABSL3 facility)进行;所有组织处理和分析实验在生物安全3级或2级实验室进行。8~12周龄C57BL/6J小鼠经尾静脉注射致死量OtK(4.5×106FFU in 200 mL),对照小鼠注射PBS。感染后第2、6、10 d,收集组织样本,立即对细菌失活处理[5]。
1.4细胞培养和感染 人脐静脉血内皮细胞(HUVEC)培养方法同前[10]。HUVECs在含10%热失活FBS的Pigrow I 培养基、5% CO237 ℃孵箱中传代。所有实验用HUVEC都是第5至第7代细胞。细胞维持用含3% FBS的Prigrow I 培养基。HUVEC长汇合时,收集并接种到24孔板培养。HUVEC再次长汇合,添加Ang1(100 ng/mL)或/及OtK(MOI 10)。感染后24、48和72 h后,收集细胞,用于蛋白检测或RT-PCR检测。
1.5Western blot 将细胞或组织用含有蛋白抑制剂的裂解液裂解,电泳分离后将样本转移到硝酸纤维素膜上,封闭后加兔抗鼠一抗:Ang2抗体(catalog #ab8452)或Tie2(ab137786)、p-Tie2(AF2720)、Akt(9272)、p-Akt(5012)、Foxo1(2880)、p-Foxo1(9461)、GATA2(ab109241)、VEGFR2(ab39256)、VE-Cadherin(ab33168)、HMGB1(ab227168)、β-actin(NB600-532)4°C过夜后,加荧光素标记的山羊抗兔IgG[Goat Anti-Rabbit IgG H&L(HRP),#4050-O5]室温作用1 h,再用ECL(Thermo Scientific, Waltham, MA, USA)显色,ImageJ软件定量并用β-actin的结果作归一化处理。
1.6qRT-PCR 从肺脏组织和细胞样本中提取总RNA,反转录后进行实时定量PCR分析。对照为肺脏正常组织或仅加培养基的细胞。β-actin的引物为5′-CGAGGCCCAGAGCAAGAGAG-3′和 5′-CGGTTGGCCTTAGGGTTCAG-3′,TNF-α为 5′-TGAGCACAGAAAGCATGATCC-3′和 5′-GCC-ATTTGGGAACTTCTCATC-3′,IFN-γ为 5′-AC-TGGCAAAAGGATGGTGAC-3′和 5′-TGAG-CTCATTGAATGCTTGG-3′,IL-6为 5′-GTTCTCTGGGAAATCGTGGA-3′和 5′-GAAATTGGGGT-AGGAAGGA-3′。

2 结 果
2.1OtK感染小鼠肺脏导致Tie2信号紊乱及炎症因子表达 经尾静脉注射小鼠致死剂量细菌或PBS,在感染后第2、6、10 d 收集肺脏组织,Western blot检测发现,第6、10 d Tie2表达明显下降;p-Tie2水平也呈相同趋势(图1A和图1B)。Ang2表达升高,并于第2 d 达到峰值(图1C)。炎症因子HMGB1[11]随着小鼠肺脏感染而表达增加(图1D)。IFN-γ、TNF-α和IL-6的mRNA水平在第6、10 d 表达明显增加(图1E)。提示,OtK感染诱导小鼠肺脏Ang2产生并抑制Tie2信号激活,同时加重炎症反应。

Mice were infected with OtK or PBS(ctrl)for lung tissues collection at indicated days of infection(D2, D6, D10).(A)Lung tissue homogenates(20 μg/lane)were measured by Western blots for the levels of total Tie2 proteins,(B)phospho-Tie2(p-Tie2),(C)Ang2,(D)HMGB1, and compared with the β-actin controls.(E)TNF-α, IFN-γ and IL-6 mRNA levels in mouse lungs were measured via qRT-PCR; data are presented as relative mRNA values normalized to β-actin.Statistically significant values are referred to as *: P<0.05; **: P<0.01; ***: P<0.001, respectively.(compared with lungs without infection).
2.2OtK感染内皮细胞导致Tie2/Akt/Foxol信号紊乱 Otk感染 HUVEC 细胞后(图2),Tie2表达增加,但p-Tie2水平持续降低。感染48 h,Tie2下游Akt表达升高,但p-Akt水平持续降低;感染48 h,Foxo1的磷酸化(p-Foxo1)水平没有显著变化,但Foxo1水平增加,提示Foxo1的去磷酸化增强,细胞核内积累增多,导致Foxo1靶基因的转录增加。Foxo1位于Akt下游,是一种转录因子,调控多种生理病理功能[12-13]。HMGB1是Foxo1的靶基因之一,其表达呈持续增加(图2)。提示,OtK感染HUVEC细胞导致Tie2信号活性减弱和炎症因子表达增强,其结果支持小鼠肺脏感染结果。

(A)HUVEC were measured by Western blots for the levels of total Tie2 proteins, phospho-Tie2(p-Tie2), Akt, p-Akt, Foxo1, p-Foxo1 and HMGB1, and compared with the β-actin controls;(B)relative protein expression normalized to β-actin Statistically significant values are referred to as *: P<0.05; **: P<0.01; ***: P<0.001, respectively.(compared with cells cultured just by medium at same culture time).(the arrow points the location of p-Foxo1).HUVEC were inoculated with MOI 10 OtK or PBS.
2.3Ang1可部分改善OtK感染内皮细胞中Tie2信号的变化 Tie2的另一配体Ang1是由内皮旁细胞表达而不在内皮细胞中表达,因此在HUVEC培养过程加入重组人源Ang1或/并OtK,检测此时Tie2信号变化。如图3所示,感染48 h,Ang2表达明显升高,Tie2和p-Tie2水平没有显著变化;感染72 h,Ang2表达进一步增加,而Tie2和p-Tie2表达显著降低。与不加Ang1的48 h 结果相比较(图2),Ang1可部分改善或者推迟细菌对Tie2信号的抑制作用。

HUVECs were cultured to confluence, and then added Ang1(100 ng/ml)with or without Otk(MOI 10).Cells were collected at(A)48 and(B)72 hours and measured via Western blot.Shown are data from independent Experiment.Values for each protein were normalized to β-actin.n=3; *: P<0.05; **: P<0.01; ***: P<0.001; ns, no significance(compared with Cells cultured just by medium).
2.4OtK感染内皮细胞对通透性蛋白的影响 培养HUVEC细胞长至汇合后,加入Ang1(100 ng/mL)或/并 OtK(MOI 10),48 h后收集细胞做WB检测。结果如图4所示,OtK感染显著降低了血管内皮生长因子受体2(VEGFR2)、血管内皮钙粘蛋白(VE-Cad)和GATA结合蛋白2(GATA2)的表达。提示,OtK感染削弱内皮细胞的稳定性。
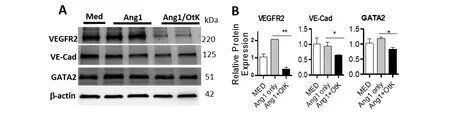
(A)Cells were collected at 48 hours and measured via Western blot.Shown are data from independent Experiment.(B)Values for each protein were normalized to β-actin.n=3; *:P<0.05; **: P<0.01(compared with Cells cultured by Ang1 only).
3 讨 论
尽管恙虫病是一种重要的传染性疾病,可能部分由于细菌培养、基因修饰或宿主-细菌间相互作用的可视化研究困难等因素,使其病理研究相对缺乏。课题组前期研究发现,在严重恙虫病东方体感染肺脏组织中,受体Tie2的转录和功能都显著降低,提示Tie2/Ang媒介的内皮细胞紊乱在严重恙虫病中起重要作用[14],但其分子机制仍需深入研究。本文在此基础上进一步探索了Orientiatsutsugamushi感染对Tie2信号及其下游通路的影响。
Tie2在血管重构和上皮细胞稳定方面起着至关重要的作用,导致胚胎致死性而无法得到Tie2敲除鼠。课题组对模型小鼠肺脏和内皮细胞的Tie2信号活性进行检测,发现Tie2和功能性p-Tie2的水平随着感染发展而持续降低;尽管不清楚是何种因子或网络调控内皮细胞Tie2的活性,但可检测激活内皮细胞的促炎因子IFN-γ、TNF-α和IL-6表达显著升高(图1)。
Tie2及其下游Akt/Foxo1信号对血管成熟和稳定非常关键,而蛋白磷酸化水平代表其活化程度。Orientiatsutsugamushi感染导致Tie2和Akt磷酸化程度降低,而Foxo1去磷酸化提高(图2)。提示,Orientiatsutsugamushi对Tie2/Akt/Foxo1信号起抑制作用。
Ang2是Tie2的一个重要配体。Ang2既有组成型表达,也有诱导型表达,因为不论体内体外实验,感染或未感染样本,Ang2都有表达。随着感染进程的发展,Ang2表达增加,而Tie2和p-Tie2却不断降低,提示Orientiatsutsugamushi感染使Ang2对Tie2有抑制作用,而在未感染时Ang2可能有保持Tie2信号活性的作用(图1和图3)。Tie2的另一个配体Ang1,可部分恢复或者推迟感染对Tie2信号的抑制。
除Tie2信号外,血管内皮生长因子受体(VEGFR2),血管内皮细胞钙粘素(VE-Cad)和GATA结合蛋白2(GATA2)在血管维持与更新中均起重要作用,影响细胞通透性。而Orientiatsutsugamushi的感染导致这几种蛋白表达降低(图4),提示感染可抑制多种内皮细胞间稳定关系,从而增加其通透性。
本研究从一种新视角探索严重恙虫病的致病机制,通过分析Orientiatsutsugamushi对小鼠肺脏及内皮细胞的影响,发现Tie2/Akt/Foxo1信号的失活可能是内皮细胞失稳的重要因素,提示Tie2信号可能是保护严重恙虫病患者血管免受损伤的潜在治疗靶点之一。
利益冲突:无

