2014-2019年阜阳市食品和病人分离单增李斯特菌的分子特征分析
孟昭倩,段 然,吕东月,郭国侠,郭靓子,卜 戈
单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)简称单增李斯特菌,属于李斯特菌属,为革兰阳性短小杆菌,广泛分布于自然界,是重要的食源性人兽共患病原菌之一[1]。可引起人和多种动物的胃肠炎、脑膜炎、败血症、流产等[2]。该菌环境耐受性较强,温度要求不高,0 ℃~45 ℃均能生存和繁殖。研究表明,李斯特菌病散发和暴发的重要原因是食入被Lm污染的食品[3],主要感染者为免疫力低下的人群、孕妇和新生儿[4-5],据报道新生儿感染该菌死亡率最高达56%[6]。为了解Lm的流行病学特性,本研究对阜阳市2014-2019年从食品和病人样本中分离的55株Lm进行毒力基因、MLST和PFGE分型分析,以建立Lm分子特征数据库,为本地单增李斯特菌病的预防控制提供参考依据。
1 材料与方法
1.1 材 料
1.1.1菌株来源 共55株Lm纳入本研究,其中3株病人菌株分别分离自早产孕妇的胎膜(胎死宫内)、早产婴儿的脑脊液、肝硬化败血症病人的血液;52株食品株分离于2014-2019年阜阳市食品安全风险监测样品,样品采集按照安徽省食品安全风险监测工作方案要求,采集于本市几个综合性超市、农贸市场、餐饮店的生畜肉、熟肉、沙拉和豆制品等。
1.1.2主要试剂和仪器 培养基(北京陆桥技术有限责任公司)、DNA提取试剂(江苏百世诺医疗科技有限公司)、限制性内切酶AscI(New England Biolabs)、毒力基因和管家基因引物合成于生工生物工程(上海)股份有限公司。全自动微生物鉴定仪VITEK2(法国梅里埃公司)、全自动核酸提取仪(台湾圆点奈米技术开发有限公司)、凝胶成像及脉冲场凝胶电泳系统(美国Bio-Rad公司)扩增仪、电泳仪(DYY-C6北京市六一仪器厂)。所用培养基和试剂均在有效期内使用。
1.2 方 法
1.2.1菌株复苏和培养 取-80 ℃磁珠冻存管保存的55株Lm,用Lm显色培养基复苏培养。36 ℃培养24 h,菌落为蓝色,周围有白色晕环,镜检为革兰阳性小杆菌,在动力培养基25 ℃培养48 h呈倒伞型,所有菌株均经生化鉴定或全自动微生物鉴定仪VITEK2鉴定确认为Lm。
1.2.2模板制备 将鉴定后的55株Lm接种于脑心浸琼脂平板,36 ℃培养24 h,取2~3个菌落接种于5 mL LB增菌肉汤,36 ℃ 260 r/min过夜震荡培养,按照核酸提取试剂盒说明书提取DNA,即为扩增模板。
1.2.3毒力基因检测 采用PCR方法检测Lm的6个毒力基因prfA、plcB、hly、actA、iap、inlA。扩增条件:94 ℃ 5 min;94 ℃ 50 s,55 ℃ 50 s,72 ℃ 50 s,30个循环;72 ℃ 10 min。取5 μL扩增产物进行电泳,220 V 20 min。Lm的6个毒力基因的检测引物[7-9]及产物大小见表1。
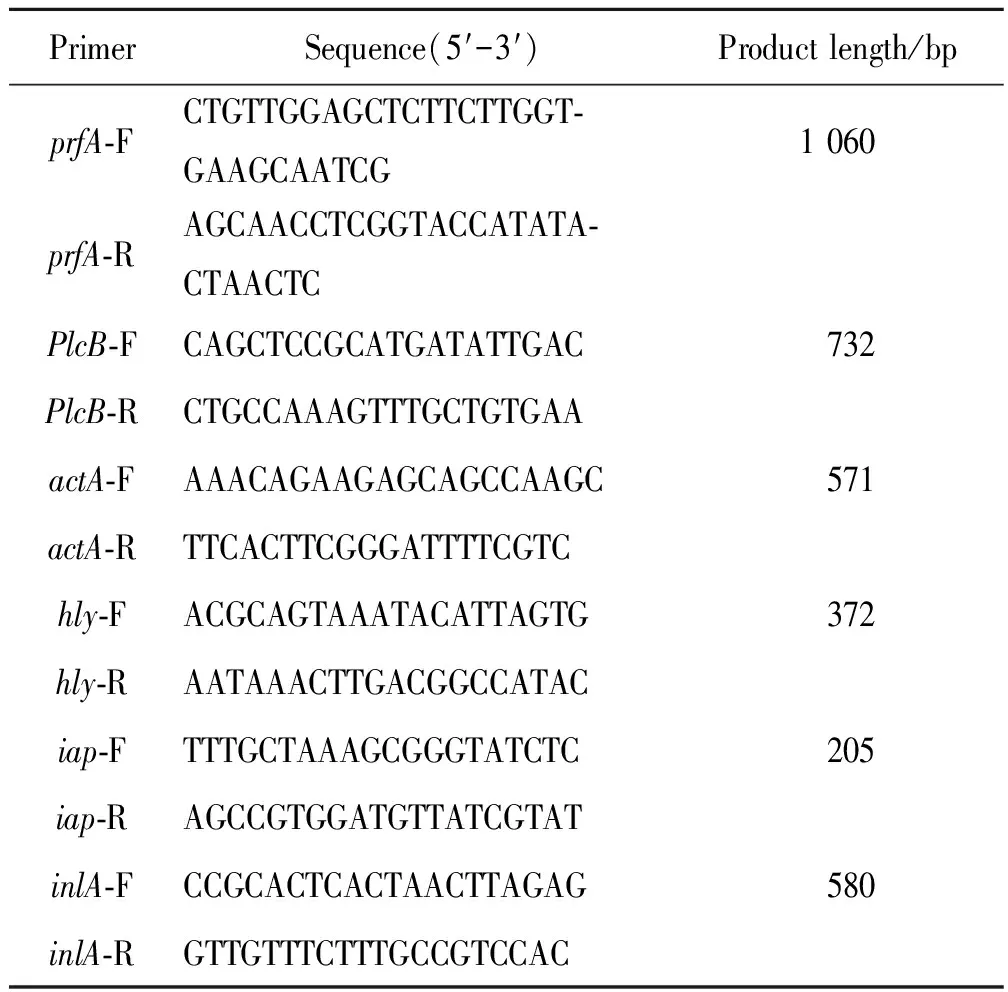
表1 单增李斯特菌毒力基因检测引物序列及产物长度
1.2.4分子分型
1.2.4.1PFGE分型 根据国家致病菌识别网技术规范单增李斯特菌PFGE操作程序,制备55株Lm和沙门菌标准株(H9812)DNA胶块,用限制性内切酶AscI和XbaⅠ分别对Lm和沙门菌标准株(H9812)DNA胶块进行酶切37 ℃ 3 h,电泳19 h,初始转换时间4.0 s,终末转换时间40.0 s,电泳染色后经凝胶成像系统拍照,转化为tif格式,再用BioNumerics7.6软件对获得的PFGE电泳图谱进行聚类分析。
1.2.4.2MLST分型 采用abcZ、bglA、cat、dapE、dat、ldh、lhkA共7对管家基因引物进行扩增,扩增条件:94 ℃ 4 min;94 ℃ 30 s,52 ℃ 30 s(blgA基因退火温度为45 ℃),72 ℃ 2 min,25个循环;72 ℃ 10 min。单增李斯特菌7个管家基因引物序列、产物长度见参考文献[10]、经电泳结果确认后将扩增产物送北京擎科生物科技有限公司进行双向测序。测序结果用Seqman软件检验与拼接,以Mega软件截取比对序列,结果与Lm的 MLST 数据库(http://www.mlst.net)进行比对获得管家基因编号及ST型别的唯一序列号。运用 BioNumerics 7.6软件进行聚类分析。
2 结 果
2.1毒力基因分布 3株病人分离菌株和52株食品分离菌株的6种毒力基因prfA、plcB、hly、actA、iap、inlA全部为阳性。
2.2MLST分型结果 55株Lm共分为14个ST型,其中52株食品株Lm分为13个ST型,包括ST9型(24株)、ST5型(6株)、ST121型(4株)、ST8型(4株)、ST297型(3株)、ST11型(2株)、ST155型(2株)、ST224型(2株)、ST3型(1株)、ST87型(1株)、ST321型(1株)、ST378型(1株)、ST575型(1株)。病人分离的3株Lm分别为ST87型、ST91型和ST224型。ST87型、ST224型为食品和病人菌株共有型别。所有菌株以ST9为优势型别(24/55,43.64%),其次为ST5型(6/55,10.91%)、ST121/ST8(4/55,7.27%),ST224/ST297(3/55,5.45%)(图1)。优势的ST9型菌株在2014-2018年均有出现。
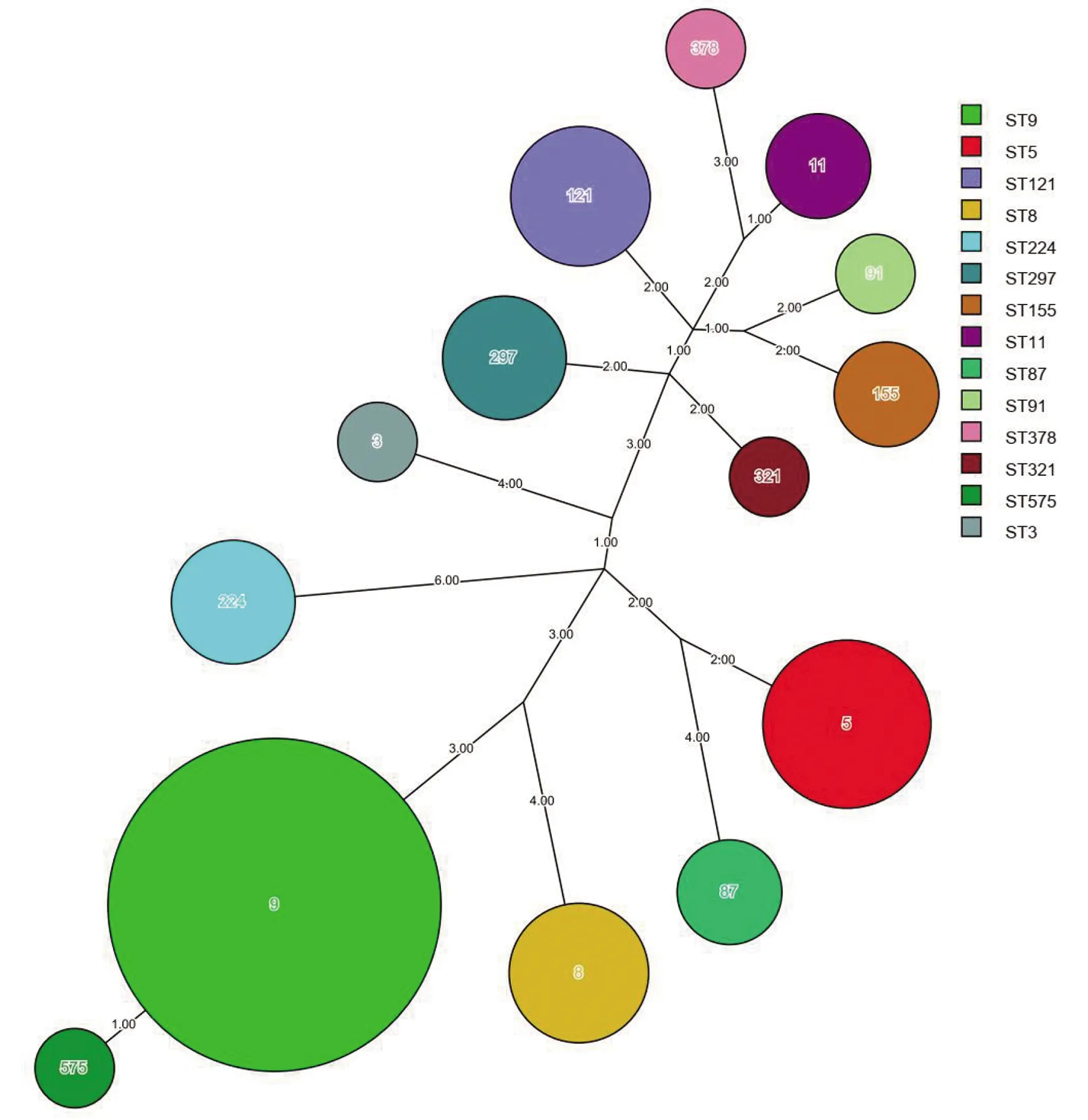
Note: Each circle represents a single ST.The diameter of the circle was proportional to the number of strains.The number of different alleles between STs was on the lines between ST.
2.3PFGE分型结果 55株Lm菌经AscI酶切电泳后共分为21个带型(PT型),相似度60.3%~100%。其中GX6A16.AH0007(19/55)为优势PT型,且均为ST9型菌株。图2的聚类分析显示,52株食品菌株中存在同一年份分离菌株分属于不同分支,而不同年份分离菌株有相同型别的现象。2016和2018年食品分离的3株菌均为GX6A16.AH0006型,其中2株为ST9型,1株为ST575型;2017年在同一超市熟食柜、同时采样的两种凉拌菜分离的菌株其PT型和ST型均不相同,千张豆腐分离菌株FY2017050为GX6A16.AH0007和ST9型,而凉拌豆饼分离菌株FY2017052为GX6A16.AH0001和ST155型别。3株病人分离菌株的PT型和ST型互不相同;2018年病人脑脊液分离菌株FY2018071和2014年食品分离菌株2014151、2014152的PT型和ST型完全一致,分别为GX6A16.AH0014和ST224型;2019年病人胎膜分离的菌株FY2019026和2014年食品分离菌株2014012的PT型和ST型完全一致,分别为GX6A16.AH0015和ST87型;2019年病人血液分离菌株FY2019039为GX6A16.AH0004和ST91型。

图2 55株单增李斯特菌PFGE聚类图、序列型别
3 讨 论
Lm是一种重要的食源性致病菌,在生畜肉、熟肉、沙拉等食品中均可检出。误食了被该菌污染的食物可引起李斯特菌病,尤其对免疫力低下的患者和围产期妇女造成的危害更为严重。近年来报告的李斯特菌病病例逐渐增多[11-15]。
Lm的致病性与其所携带的毒力基因密切相关,目前已发现的毒力基因较多,这6个毒力基因prfA、plcB、hly、actA、iap、inlA功能较为清楚。hly基因编码的溶血素是 Lm 的重要毒力因子,溶血素与Lm的致病性密切相关;iap基因编码的 P60蛋白是Lm的重要抗原,与侵袭性有关;prfA是毒力调控基因,可转录和调控Lm的多种毒力基因;inlA基因编码内化素,介导细菌侵入宿主细胞;actA基因编码肌动蛋白,为细菌运动提供动力;plcB编码磷脂酰胆碱磷脂酶, 与细菌的扩散能力有关[16-18]。本研究从多类食品特别是熟肉、沙拉、凉拌菜等直接食用的食品中分离到的Lm均具有这6种毒力基因,提示这些食源性Lm对人们健康存在潜在威胁,有出现食源性感染性暴发疫情的可能性,应引起卫生监督部门的高度重视。
PFGE技术因分辨率高、分型能力强、重复性好的特点被誉为细菌性传染病病原分子分型的“金标准”[9]。通过对电泳条带的比较分析可以反映出不同菌株的相关性。本次聚类分析结果表现为多样性,55株Lm分为21个PT型。3株病人分离株为不同的PT型,存在病人菌株和食品菌株型别完全一致情况;52株食品株中相同年份有多种带型共存,不同年份菌株存在相同的带型。说明食品销售环境中具有多种型别的Lm持续存在,有可能随着地区间食品运输和销售链进行扩散传播,因此食品安全需要加强对污染食品的监管。
MLST通过比对Lm 7个管家基因的核苷酸序列多样性,进而研究菌株间的遗传相关性和种群结构的一种基因分型方法。本研究中使用MLST将55株Lm分为14个ST型,其中52株食品分离株中优势菌株为ST9型,其次为ST5、ST121、ST8、ST297、ST224,与马爱静,霍哲等的研究结果相似[3,19]。3株病人分离菌株型别各不相同,而有2株病人和食品分离菌株型别相同。2019年分离于早产孕妇胎膜(胎死宫内)的菌株FY2019026和2014年食品分离株2014012的PFGE带型和MLST型别完全相同,为GX6A16.AH0015和ST87型,ST87型菌株为单增李斯特菌病病例样本中多见型别[20];菌株FY2019039分离于肝硬化败血症病人的血液,其PFGE带型和MLST型为GX6A16.AH0004和ST91,暂未发现与其型别相同菌株;菌株FY2018071分离于早产婴儿的脑脊液,和2014年食品分离菌株FY2014151、FY2014152 的PFGE带型和MLST型别完全相同,均为GX6A16.AH0014和ST224型,说明Lm的一些型别菌株可持续多年污染本地的食品并具有致病性,对人群具有较高的感染风险。这种食品株和病人株型别相同的现象在国内其他学者的研究中也有报道[20-21]。
由图2可以看出多数菌株PT型相同ST型相同;有些菌株ST型相同PT型不同,有些菌株PT型相同ST型不同,如FY2016038、FY2018004、FY2018021的PT型相同均为GX6A16.AH0006,而MLST型菌株FY2016038为ST575型、菌株FY2018004和FY2018021为ST9型。PFGE可分析细菌之间的相关性,追溯感染来源,MLST通过分析每个管家基因的核苷酸序列特征,反映菌株间的遗传相关性、克隆性。对ST型、PT型均一致的食品和病人菌株进行基因组测序分析,可进一步确定是否为相同或相近克隆来源菌株等。同一超市熟食柜、同时采样的两种凉拌菜,PT型和ST型均不相同,PT型为GX6A16.AH0007和GX6A16.AH0001,ST型为ST9和ST155。说明该熟食柜同时存在多种型别的Lm污染,并且携带毒力基因,说明我市具有食源性李斯特菌病散发和暴发的潜在危险。应加强食源性Lm的病原监测、感染风险评估、食品卫生监管措施等。
本研究采用分子分型技术对阜阳市2014-2019年病人和食品样本中分离的55株Lm进行分子分型分析,同时检测其毒力基因,建立了Lm分子特征数据库,为本市李斯特菌病的预防控制提供了参考依据。
利益冲突:无

