VPS4B 调控Notch 通路对促进牙髓干细胞成牙本质分化的机制研究
李坤阳陈 栋左春然刘爱群朱兰省牛 兵
(1.河南省中医院(河南中医药大学第二附属医院)口腔科,郑州 450001; 2.郑州大学第一附属医院·河南省口腔医院口腔科,郑州 450052)
人牙髓干细胞(human dental pulp stem cells,hDPSCs)是从牙齿上分离出的成体间充质干细胞,具有高度增殖能力,且具有多向分化潜能,是牙齿再生的重要细胞[1]。 因此hDPSCs 的定向分化对于牙齿再生至关重要。 细胞液泡分选蛋白 4B(vacuolar protein sorting 4B,VPS4B)在 hDPSCs 中高表达,可促进向成牙本质分化,但机制尚不明确[2]。Notch 通路与细胞增殖、分化等关系密切,并且几乎涉及机体所有器官、组织和细胞,在牙齿发育和再生过程中发挥重要作用[3-4]。 Notch 受体释放其胞内结构域(Notch intracellular domain,NICD)作为Notch 通路激活金标准,过表达 NICD 可以抑制hDPSCs 分化[5]。 推测 VPS4B 可能调控 Notch 通路影响hDPSCs 成牙本质分化。 因此,本研究采用矿化液和干扰VPS4B 同时处理hDPSCs,探讨其对成牙本质分化的影响,并初步探讨其机制。
1 材料和方法
1.1 实验材料
收集本院18 ~30 岁因正畸或阻生齿拔除的健康完整恒牙,无菌工作台上取出牙髓,分离纯化和鉴定得hDPSCs[6]。 经核实,所有操作经患者知情同意并签订知情同意书,本研究经本院伦理协会审核并通过(20190014)。
1.2 主要试剂与仪器
地塞米松、维生素、β-甘油磷酸钠、茜素红(德国 Sigma 公 司, 批 号 分 别 为: 170412、 181113、171207、180415);脂质体 Lipofectamine 2000 转染试剂盒(赛默飞世尔公司,批号:20170418);一抗VPS4B、NICD、hairy 相关转录因子 1(hairy and enhancer of split-related with YRPW motif1,Hey1)、GAPDH、钙浓度检测试剂盒(美国abcam 公司,批号分 别 为: ab224736、 ab83232、 ab22614、 ab181602、ab102505);VPS4B-siRNA、阴性对照 siRNA、Runt 相关转录因子2 (runt-related transcription factor2,Runx2)、骨桥蛋白(osteopontin,OPN)、牙本质涎磷蛋白(dentin sialophosphoproprotein,DSPP)引物序列均由生工生物工程股份有限公司合成。 CO2培养箱(深圳瑞沃德公司,型号:D180-P);酶标仪、实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(赛默飞世尔公司,型号分别为:Multiskan Sky、7500);凝胶成像系统(上海天能公司,型号:4800)。
1.3 实验方法
1.3.1 实验分组及处理
参考文献[7]设计VPS4B-siRNA,VPS4B-siRNA-1 ∶5’-UUCUCCGAACGUGUCACGUTT-3’、VPS4B-siRNA-2 ∶ 5 ’-AACATTTGAGAAACGAATT-3 ’、VPS4B-siRNA-3 ∶5’-TGATCCTAACCATCTTGTA-3’,最终三者 1 ∶1 ∶1混合为 VPS4B-siRNA。 阴性对照siRNA: 5 ’-UUCUCCGAACGUGUCACGUTT-3 ’。VPS4B-siRNA 及阴性对照 siRNA 均用 50 μL 无血清 MEM 稀 释 成 20 μmol/L; 2 μL 脂 质 体Lipofectamine 2000 用 50 μL DMEM 培养液稀释,轻轻混匀后室温孵育5 min,上述稀释的siRNA 与稀释的脂质体Lipofectamine 2000 轻轻混合后室温孵育20 min,现配现用。
10% FBS+90% DMEM 培养液制成完全培养液培养hDPSCs,采用生长良好的第3 代hDPSCs 进行后续实验,实验分为正常组、矿化组、阴性对照组、VPS4B-siRNA 组。 正常组正常培养相同时间,其余组添加矿化液(0.785 g/L 地塞米松、0.05 g/L 维生素、2.16 g/L β-甘油磷酸钠),在添加矿化液基础上阴性对照组(添加脂质体Lipofectamine 2000+阴性对 照 siRNA)、 VPS4B-siRNA 组 (添 加 脂 质 体Lipofectamine 2000+VPS4B-siRNA),6 h 后弃去培养液再添加含矿化液完全培养液培养,其余2 d 换一次液,置于37℃ 5% CO2培养箱培养14 d。
1.3.2 蛋白免疫印迹检测细胞中VPS4B、NICD、Hey1 蛋白水平
按1.3.1 对细胞处理后,蛋白裂解液冰上裂解细胞20 min,4℃ 12000 r/min 离心20 min,上清为总蛋白,凝胶电泳分离蛋白,PVDF 转膜,分别加入一抗 VPS4B、NICD、Hey1、GAPDH 置于 4℃孵育过夜,添加对应二抗,室温孵育1 h。 凝胶成像系统拍照并分析条带灰度。 目的蛋白相对表达=目的蛋白条带灰度/GAPDH 条带灰度。
1.3.3 CCK8 检测细胞增殖情况
每孔3×104个细胞接种至96 孔板中,添加200 μL 培养液培养细胞,待细胞贴壁后添加CCK8 试剂,继续培养2 h,酶标仪检测各组细胞光密度OD450(optic density,OD)。
1.3.4 茜素红染色观察细胞分化情况
按1.3.1 处理各组细胞,弃去培养液,40 g/L 多聚甲醛固定,茜素红染液染色,肉眼及倒置显微镜下观察矿化结节情况。 Image-J 软件定量分析,每个样品显微镜视野下计数5 个孔,求平均值,每个视野下矿化结节数量为矿化结节相对数量。
1.3.5 钙浓度检测试剂盒检测细胞钙水平
按1.3.1 处理细胞后按照钙浓度检测试剂盒说明书配置 MTB 试剂和碱性溶液,钙标准液 2.5 mmol/L,4℃避光保存。 100 μL MTB+200 μL 碱性溶液+各10 μL(待测样品、钙标准液、ddH2O),混匀后置于1 cm 比色皿,ddH2O 用于调零,测定OD610。待测样品钙浓度=OD测定管/OD标准管×2.5。
1.3.6 qRT-PCR 检测细胞中 Runx2、OPN、DSPP mRNA 水平
按1.3.1 方法处理细胞后,RNA 提取试剂盒提取总RNA,逆转录 cDNA 试剂盒合成 cDNA,qRTPCR 仪检测细胞中 Runx2、OPN、DSPP mRNA 水平。引 物 序 列 Runx2-F: 5 ’-CCATAACCGTCTTCAC AAATCC-3’、R:5’-GCGGGACACCTACTCTCATACT-3’,OPN-F:5’-ACACATATGATGGCCGAGGTG-3’、R:5’-GTGTGAGGTGATGTCCTCGTCTGTA-3,DSPPF: 5 ’-CCATTCCCACGGACTCCCA-3 ’、 R: 5 ’-TGGCGATGCAGGTCACAAT-3’,20 μL 反应体系:2×mix 10 μL,ddH2O 7.8 μL,50 ng/μL cDNA 1 μL,(F/R)(0.6/0.6)μL。 反应条件:94℃、90 s;94℃、60 s,61℃、60 s,40 个循环。 2-ΔΔCt法计算 Runx2、OPN、DSPP mRNA 相对表达水平。 8 个平行。
1.4 统计学方法
采用SPSS 24.0 软件对数据进行统计学分析,计量数据均采用平均数±标准差(±s)表示,多组间比较行单因素方差分析,进一步两两比较行SNK-q检验。P<0.05,差异有统计学意义。
2 结果
2.1 干扰VPS4B 对hDPSCs VPS4B 蛋白的影响
与正常组相比,矿化组、阴性对照组VPS4B 蛋白水平升高(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组VPS4B 蛋白水平降低(P<0.05)。 见图1、表1。
2.2 干扰VPS4B 对hDPSCs 增殖的影响
与正常组相比,矿化组、阴性对照组、VPS4B-siRNA 组OD450水平降低(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组OD450水平降低(P<0.05)。 见表2。

图1 4 组细胞中VPS4B 蛋白表达情况Figure 1 Expression of VPS4B protein in 4 groups of cells
2.3 干扰VPS4B 对hDPSCs 成牙本质分化的影响
正常组茜素红染色较浅,面积较小。 与正常组相比,矿化组、阴性对照组、VPS4B-siRNA 组染色较深,且面积较大,矿化结节相对数量升高(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组染色颜色有所减轻,面积减少,矿化结节相对数量降低(P<0.05)。 见图2、表3。
2.4 干扰VPS4B 对hDPSCs 钙化的影响
与正常组相比,矿化组、阴性对照组钙浓度升高(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组钙浓度降低(P<0.05)。 见表4。
表1 4 组细胞VPS4B 蛋白水平比较( ±s,n=8)Table 1 Comparison of VPS4B protein levels in 4 groups of cells
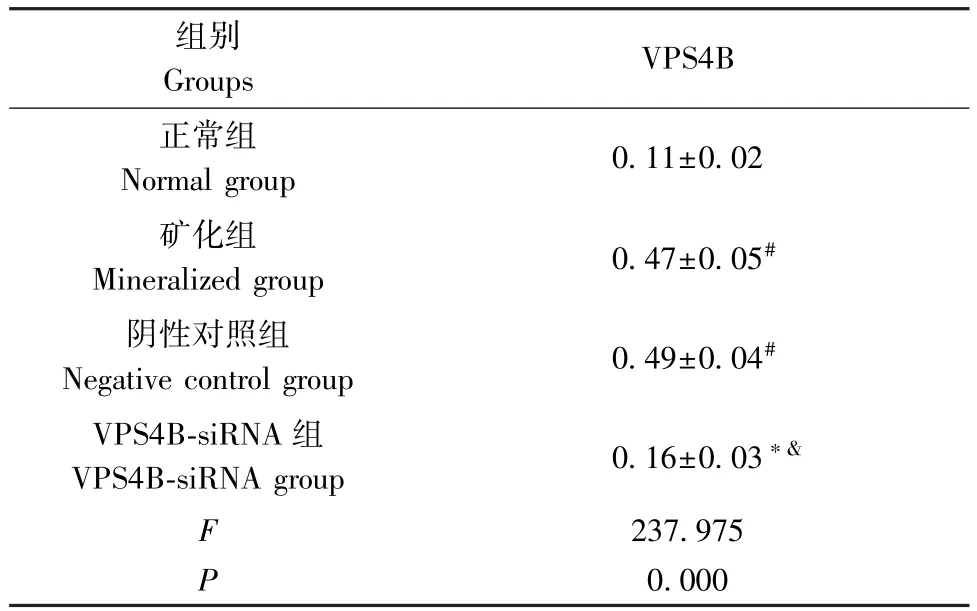
表1 4 组细胞VPS4B 蛋白水平比较( ±s,n=8)Table 1 Comparison of VPS4B protein levels in 4 groups of cells
注:与正常组相比,#P<0.05;与矿化组相比,∗P<0.05;与阴性对照组相比,&P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the mineralized group, ∗P<0.05.Compared with the negative control group,&P<0.05.
组别Groups VPS4B正常组Normal group 0.11±0.02矿化组Mineralized group 0.47±0.05#阴性对照组Negative control group 0.49±0.04#VPS4B-siRNA 组VPS4B-siRNA group 0.16±0.03∗&F 237.975 P 0.000
表2 4 组细胞OD450比较( ±s,n=8)Table 2 Comparison of OD450 in 4 groups of cells

表2 4 组细胞OD450比较( ±s,n=8)Table 2 Comparison of OD450 in 4 groups of cells
注:与正常组相比,#P<0.05;与矿化组相比,∗P<0.05;与阴性对照组相比,&P<0.05。Note.Compared with the normal group, #P < 0.05.Compared with the mineralized group, ∗P<0.05.Compared with the negative control group,&P<0.05.
组别Groups OD450正常组Normal group 2.14±0.05矿化组Mineralized group 1.24±0.15#阴性对照组Negative control group 1.28±0.12#VPS4B-siRNA 组VPS4B-siRNA group 0.87±0.05#∗&F 220.786 P 0.000

图2 4 组细胞茜素红染色结果Figure 2 Results of alizarin red staining in 4 groups of cells
表3 4 组细胞矿化结节相对数量比较( ±s,n=8)Table 3 Comparison of relative number of mineralized nodules in 4 groups of cells

表3 4 组细胞矿化结节相对数量比较( ±s,n=8)Table 3 Comparison of relative number of mineralized nodules in 4 groups of cells
注:与正常组相比,#P<0.05;与矿化组相比,∗P<0.05;与阴性对照组相比,&P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the mineralized group, ∗P<0.05.Compared with the negative control group,&P<0.05.
组别Groups矿化结节相对数量(n)Relative number of mineralized nodules正常组Normal group 13.45±3.56矿化组Mineralized group 73.58±6.89#阴性对照组Negative control group 71.74±5.47#VPS4B-siRNA 组VPS4B-siRNA group 48.98±5.18#∗&F 214.482 P 0.000
表4 4 组细胞钙浓度比较( ±s,n=8)Table 4 Comparison of calcium concentration in 4 groups of cells

表4 4 组细胞钙浓度比较( ±s,n=8)Table 4 Comparison of calcium concentration in 4 groups of cells
注:与正常组相比,#P<0.05;与矿化组相比,∗P<0.05;与阴性对照组相比,&P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the mineralized group, ∗P<0.05.Compared with the negative control group,&P<0.05.
组别Groups钙浓度(mmol/L)Calcium concentration正常组Normal group 1.53±0.18矿化组Mineralized group 2.48±0.45#阴性对照组Negative control group 2.50±0.43#VPS4B-siRNA 组VPS4B-siRNA group 1.95±0.25∗&F 14.395 P 0.000
2.5 干扰 VPS4B 对 hDPSCs 中 Runx2、OPN、DSPP mRNA 水平的影响
与正常组相比,矿化组、阴性对照组 Runx2、OPN、DSPP mRNA 水 平 升 高, VPS4B-siRNA 组OPN、DSPP mRNA 水平升高(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组Runx2、OPN、DSPP mRNA 水平降低(P<0.05)。 见图3。
2.6 干扰VPS4B 对hDPSCs 中Notch 通路蛋白的影响
与正常组相比,矿化组、阴性对照组、VPS4B-siRNA 组细胞中 NICD、Hey1 蛋白水平降低(P<0.05);分别与矿化组、阴性对照组相比,VPS4B-siRNA 组 NICD、Hey1 蛋白水平升高(P<0.05)。 见图4、表5。
3 讨论
hDPSCs 具有多向分化和自我更新能力,牙髓损伤可促使hDPSCs 迁移至受损部位定向分化,从而修复损伤,检测未分化和分化后基因表达差异对于维持hDPSCs 定向分化具有重要意义[8]。 VPS4B 作为AAA-ATPase 家族成员,VPS4B 的破坏可能导致某些功能改变,主要表现为改变VPS4B 二级结构,导致其功能降低或丧失;VPS4B 基因突变已成为牙本质异常的致病基因[9-10]。 但具体机制尚不清楚,因此研究VPS4B 在hDPSCs 成牙本质分化的机制对于治疗疾病意义重大。 本研究发现,与正常组相比,矿化组VPS4B 蛋白水平升高;提示矿化hDPSCs可促进 VPS4B 蛋白的表达。 与矿化组相比,VPS4B-siRNA 组 VPS4B 蛋白水平降低;说明干扰VPS4B 后矿化hDPSCs 细胞中蛋白水平下降,干扰成功。 与正常组相比,矿化组OD450下降,矿化结节相对数量、钙浓度升高,提示矿化 hDPSCs 促进VPS4B 表达,可抑制细胞增殖、促进成牙本质分化。与矿化组相比,VPS4B-siRNA 组茜素红染色颜色有所减轻,面积减少,OD450、矿化结节相对数量、钙浓度降低;提示干扰VPS4B 后进一步抑制细胞增殖、hDPSCs 成牙本质分化。
Runx2 具有多个结合位点,可以结合在靶基因的启动子上从而调控众多成骨相关的靶基因,如骨钙素、OPN 等,影响细胞分化;增强Runx2 表达可促进hDPSCs 分化为成牙本质细胞[11-12]。 OPN 可结合羟基磷灰石晶体从而参与钙离子信号传导过程,在初期矿化中起重要作用;DSPP 作为牙本质特异性蛋白,其水平反映 hDPSCs 成牙本质分化水平[13-14]。 本研究发现,与正常组相比,矿化组Runx2、OPN、DSPP mRNA 水平升高,提示 Runx2 促进参与矿化过程中的OPN 和形成牙本质的相关基因水平升高,促进hDPSCs 牙本质分化。 与矿化组相比,VPS4B-siRNA 组 Runx2、OPN、DSPP mRNA 水平降低,提示干扰 VPS4B 后 Runx2 水平降低,对OPN 的促进作用减弱,导致牙本质分化相关基因如DSPP 等水平降低,hDPSCs 牙本质分化能力减弱。
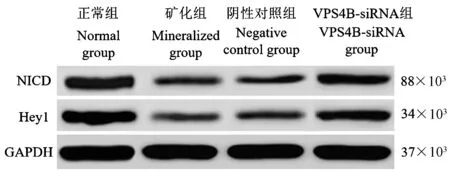
图4 4 组细胞中NICD、Hey1 蛋白表达情况Figure 4 Expression of NICD and Hey1 protein in 4 groups of cells
表5 4 组细胞NICD、Hey1 蛋白水平比较( ±s,n=8)Table 5 Comparison of NICD and Hey1 protein levels in 4 groups of cells
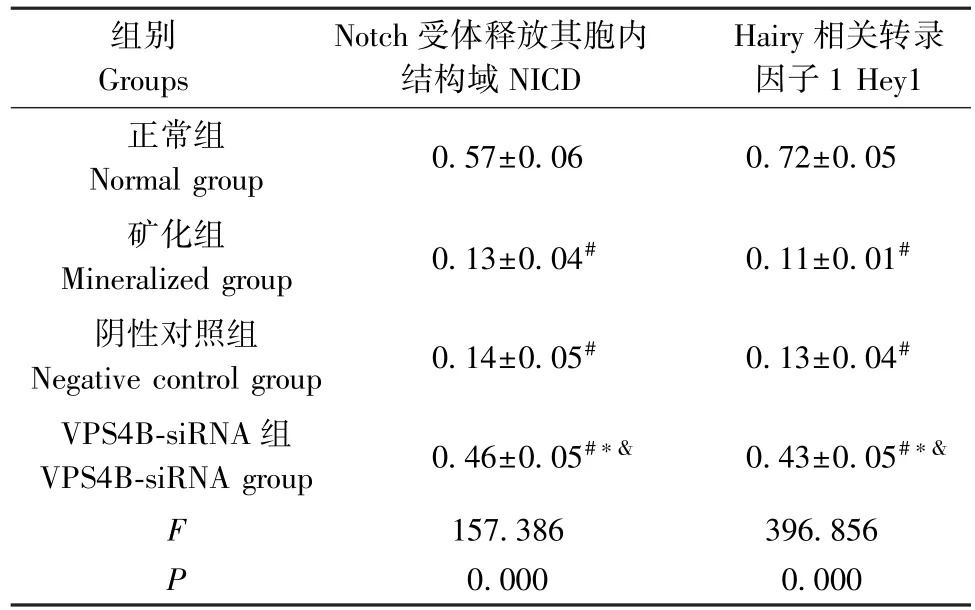
表5 4 组细胞NICD、Hey1 蛋白水平比较( ±s,n=8)Table 5 Comparison of NICD and Hey1 protein levels in 4 groups of cells
注:与正常组相比,#P<0.05;与矿化组相比,∗P<0.05;与阴性对照组相比,&P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the mineralized group, ∗P<0.05.Compared with the negative control group,&P<0.05.
组别Groups Notch 受体释放其胞内结构域NICD Hairy 相关转录因子1 Hey1正常组Normal group 0.57±0.06 0.72±0.05矿化组Mineralized group 0.13±0.04# 0.11±0.01#阴性对照组Negative control group 0.14±0.05# 0.13±0.04#VPS4B-siRNA 组VPS4B-siRNA group 0.46±0.05#∗& 0.43±0.05#∗&F 157.386 396.856 P 0.000 0.000
活化Notch 信号通路可暴露出NICD,活化的NICD 可与DNA 结合蛋白结合,从而活化 Notch 靶基因, Hey1 作为 Notch 靶基因可受 NICD 调控[15-17]。 Hey1 可与DNA 蛋白结合从而发挥作用,被认为转录抑制物,可与Runt 结构家族羧基端结合从而发挥作用[18-19]。 同时发现高表达NICD 可直接抑制Runx2 的表达从而抑制成骨分化[20]。 本研究发现,与正常组相比,矿化组细胞中NICD、Hey1 蛋白水平降低,提示 hDPSCs 成牙本质分化过程中NICD 受到抑制,调控Hey1 的作用减弱,从而导致Hey1 对Runx2 的转录抑制作用减弱,促进hDPSCs成牙本质分化。 与矿化组相比,VPS4B-siRNA 组NICD、Hey1 蛋白水平升高,提示干扰 VPS4B 后VPS4B 二级结构改变,而改变ATP 的结合结构,导致ATP 功能改变,经过一系列影响,激活 NICD,NICD 调控 Hey1 水平升高,Hey1 对 Runx2 的抑制作用加强,Runx2 水平降低调控 OPN、DSPP 能力降低,hDPSCs 分化能力降低,导致疾病发生。
综上所述,干扰VPS4B 后可抑制hDPSCs 牙本质分化,可能是通过激活 Notch 通路实现的。 但VPS4B 与Notch 之间的作用结合部位尚未发现,仍需深入探究分析。

