血浆外泌体miR-125a在多发性骨髓瘤辅助诊断中的价值研究*
张 艳 ,袁 杰 ,申娴娟 ,鞠少卿
(南通大学附属医院1医学检验中心;2临床医学研究中心,江苏226001)
多发性骨髓瘤(multiple myeloma,MM)是源于B细胞系的血液系统恶性肿瘤,其特征为骨髓中浆细胞异常增殖,伴有单克隆免疫球蛋白或轻链过度生成,引起骨质破坏、骨髓功能衰竭以及肝、脾、淋巴结和肾脏等器官或组织损伤[1]。MM起病隐匿,患者多因骨痛、肝脾肿大、肾功能损害等症状就诊,极易漏诊、误诊,迄今化疗、免疫治疗及造血干细胞移植等方法仍无法根治。骨髓组织活检是临床诊断MM的金标准,但患者依从性差,检查结果滞后,辅助诊断包括血、尿免疫球蛋白及轻链、血清M蛋白检测等,但操作繁琐,敏感性及特异度不够[2]。
外泌体是由不同类型细胞释放的膜性囊泡,直径 50~140 nm,能通过 mRNAs、miRNAs和蛋白质等的传递介导细胞间相互作用[3]。肿瘤细胞在生长过程中不断释放外泌体,不同肿瘤来源的外泌体含有的miRNA分子具有异质性。外泌体源性miRNA的种类及数量可能与肿瘤大小、恶性程度、侵袭转移、分期分级密切相关。Taylor等[4]首先发现从血清中分离出肿瘤来源外泌体中的miRNA,与卵巢癌组织中miRNA具有很好的相关性,而与对照组miRNA有明显差异,可用于卵巢癌诊断。Liu等[5]发现结直肠癌患者外泌体miR-139-3p表达水平显著下调,可能作为结直肠癌早期诊断和转移监测的生物标志物。Cai等[6]发现膀胱癌患者血清外泌体miR-133b水平显著降低,与TCGA数据库中较差的总生存率相关。外泌体分泌到细胞外基质后,被受体细胞识别并内在化,调节受体细胞行为[7]。
我们前期利用基因芯片筛选MM细胞株与骨髓基质细胞共培养前后变化的miRNA分子,发现miR-125a、miR-30a、miR-29b 等表达上调,miR-630、miR-130b、miR-205等表达下调,推测miRNA分子经由外泌体释放并摄取。本研究选取变化最为显著的miR-125a,通过检测65例MM患者血浆外泌体miR-125a表达量,评价其作为MM生物学标志物的可行性,为临床MM辅助诊断提供实验依据。
1 资料与方法
1.1 一般资料 选择2017年10月—2019年4月我院诊断的65例多发性骨髓瘤未接受治疗患者,其中男性29例,女性36例;年龄16~85岁,平均65±11岁。MM诊断、分期及风险状态按照《美国国家综合癌症网络指南(2017年第3版)》。选择同期45例健康者作为对照组,其中男性21例,女性24例;年龄20~78岁,平均58±8岁。本研究经医院伦理委员会批准,所有受试者均知情同意。本实验所用MM细胞株(U266、RPMI 8226、H929)均购自于中国科学院上海生物研究所细胞库,使用1640完全培养基,于37℃、5%CO2培养箱进行培养。
1.2 CD138+浆细胞分选 无菌采集患者骨髓于EDTA抗凝管,室温3 000 r/min离心取上清,加入等量PBS吹打混匀,加入3 mL Ficoll分离液,2000 r/min离心20 min,吸取中间雾状细胞层。PBS重悬洗涤细胞2次,1 000 r/min离心5 min,弃上清。每1×107个细胞用磁珠分选缓冲液100 μL重悬,加入20 μL CD138+标记磁珠,混匀,4℃避光孵育15 min。将分选柱置磁力架,在孵育后的细胞悬液中加入500 μL缓冲液,充分混匀,加入分选柱,收集洗脱,获得CD138+浆细胞。
1.3 血浆外泌体的提取和鉴定 收集受试者血浆标本,以1 000 g离心10 min,将上层血浆分装于无酶离心管中。1 550 g离心30 min,取上清;16 500 g离心 45 min,取上清;150 000 g离心 120 min,弃上清,加入100 μL PBS重悬外泌体沉淀。取新鲜提取的外泌体悬液20 μL,滴加在孔径为2 nm的载样铜网上,室温静置3 min,滴加20 μL 1%磷钨酸溶液,室温复染5 min,透射电镜下观察并拍照。Western Blot检测外泌体相关标记蛋白的表达。
1.4 外泌体总RNA的提取 外泌体悬液加入适量Trizol混匀,冰上吹打裂解15 min,每管加入适量氯仿,充分震荡混匀,冰上静置5 min,4℃,12 000 g离心15 min。吸取上层无色水相,加入适量异丙醇,充分震荡混匀,冰上静置10 min,4℃,12 000 g离心10 min,弃上清。用预冷的含75%乙醇的DEPC水洗涤RNA沉淀,4℃,7 500 g离心10 min,弃上清。烘箱65℃干燥5~10 min,加入20 μL DEPC水溶解RNA沉淀,紫外分光光度法测定RNA浓度和纯度。
1.5 cDNA合成 使用美国Thermo Fisher Scientific公司逆转录试剂盒,按照操作说明书对提取的RNA进行逆转录。体系为:RNA 300 ng,5×反应缓冲液4μL,反转录引物 1 μL,脱氧核糖核苷酸 2 μL,核糖核酸酶抑制剂1 μL,反转录酶1 μL,无核酸酶纯水补足至 20 μL;反应条件:42 ℃ 60 min,70 ℃ 5 min。合成的cDNA置于-20℃保存备用。
1.6 荧光定量PCR 采用美国ABI公司7500 PCR仪进行检测,miR-125a和内参U6上下游引物由广州锐博生物公司合成。miR-125a正向引物:5′-ACACTCCAGCTGGGGTGCATTGTAGTTGCA-3′;反向引物:5′-TGGTGTCGTGGAGTCG-3′。U6 正向引物:5’-CTCGCTTCGGCAGCACA-3’;反向引物:5’-AACGCTTCACGAATTTGCGT-3’。反应体系:SYBR GreenⅠmix 10 μL,cDNA 3 μL,上游引物 1 μL,下游引物 1 μL,无酶水 5 μL,总体积 20 μL。反应条件:95 ℃,5 min,1 个循环;95 ℃,15 s;60 ℃,30 s;72 ℃,30 s,共40个循环。每个样本设3个复孔,结果取其均值。2-△△Ct表示miR-125a相对表达量,ΔΔCt(cycle threshold,Ct)=实验组(CTmiR-125a-CTU6)-对照组(CTmiR-125a-CTU6)。
1.7 统计学处理 采用SPSS 18.0统计学软件进行数据分析,Graphpad Prism 6.0软件进行绘图。血浆外泌体miR-125a相对表达量以中位数(下四分位数,上四分位数)表示,组间比较采用Mann-Whitney检验;诊断效能评估采用受试者工作曲线(ROC)和曲线下面积(AUC);相关分析采用Spearman系数。P<0.05为差异有统计学意义。
2 结 果
2.1 血浆外泌体表征 通过超速离心提取法获得MM患者血浆外泌体,透射电子显微镜下观察发现外泌体是一群大小均一、直径为100 nm左右的圆形膜性小囊泡(图1A)。Western Blot检测外泌体表面标志分子(图1B),以上结果表明成功提取血浆外泌体。
2.2 MM血浆及MM细胞株中外泌体miR-125a表达水平 荧光定量PCR检测显示,MM组血浆外泌体 miR-125a 表达水平 2.357(1.876,2.772),高于对照组的 1.154(0.959,1.341),差异有统计学意义(P<0.0001)(图 2A)。MM 细胞株 H929、U266、RPMI8226培养上清中外泌体miR-125a表达水平高于正常浆细胞,差异均有统计学意义(P<0.05)(图 2B)。

图1 MM血浆外泌体表征
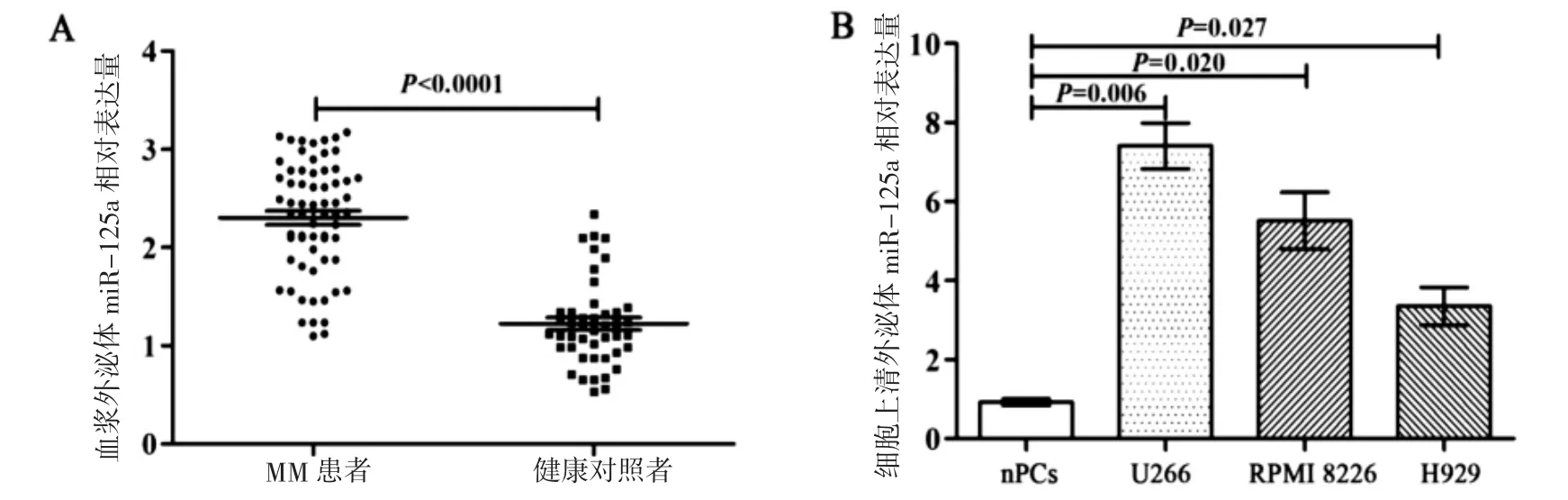
图2 外泌体miR-125a表达水平检测
2.3 MM血浆外泌体miR-125a水平与临床分期的关系 根据Durie-Salmon(DS),国际分期系统(ISS)和修订的国际分期系统(R-ISS)对65例MM患者进行疾病分期,比较不同疾病分期患者血浆外泌体miR-125a水平,发现与DS-I期相比,DS-II期和DS-III期患者血浆外泌体miR-125a水平升高,差异均有统计学意义(P<0.05),而 DS-II期与 DS-III期间的差异无统计学意义(P>0.05)(图 3A)。ISS-II期和ISS-III期患者血浆外泌体miR-125a水平高于ISS-I期,差异均有统计学意义(P<0.05),ISS-II期与ISS-III期间差异无统计学意义(P>0.05)(图 3B)。RISS-III期患者血浆外泌体miR-125a水平也高于R-ISS-I期,差异有统计学意义(P<0.05),而 R-ISSI期与R-ISS-II期,R-ISS-II期与R-ISS-III间的差异均无统计学意义(P>0.05)(图 3C)。
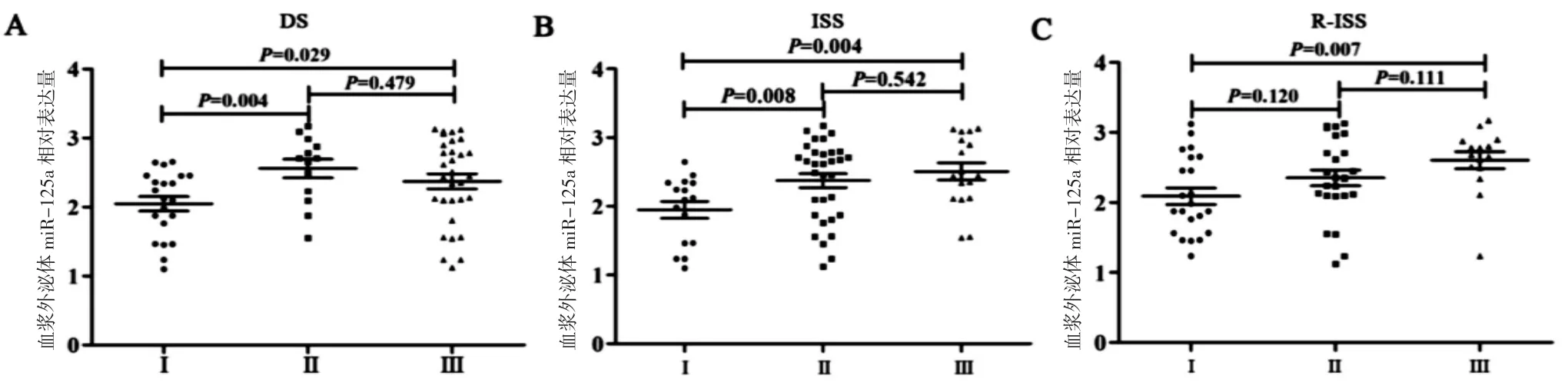
图3 血浆外泌体miR-125a水平与MM临床分期的关系
2.4 MM血浆外泌体miR-125a水平与临床病理特征的关系 血浆外泌体miR-125a表达水平与总蛋白(P=0.037)相关,而性别、年龄、M 蛋白、β2微球蛋白(β2M)、轻链和乳酸脱氢酶(LDH)与血浆外泌体miR-125a表达水平无关(P>0.05)。见表 1。
2.5 MM血浆外泌体miR-125a与β2M、轻链、LDH水平相关性分析 血浆外泌体miR-125a表达水平与β2M、κ轻链、λ轻链及LDH浓度无相关性(图4A-D)。

表1 血浆外泌体miR-125a水平与MM患者临床病理特征的关系
2.6 血浆外泌体miR-125a对MM诊断效能评价 根据65例MM患者和45例健康对照者血浆外泌体miR-125a、β2M、λ轻链和κ轻链表达水平,绘制ROC曲线,并以AUC评价诊断效能。结果显示,血浆外泌体 miR-125a的 AUC为 0.923(95%CI:0.876~0.971)高于 β2M(AUC0.864,95%CI:0.795~0.934)、λ 轻链(AUC0.817,95%CI:0.740~0.895)和 κ轻链(AUC0.742,95%CI:0.645~0.839),提示血浆外泌体miR-125a作为MM辅助诊断标志物具有较好的诊断效能(图5)。

图4 血浆外泌体miR-125a与临床检验指标相关性

图5 ROC曲线评价各指标诊断效能
2.7 联合检测血浆外泌体miR-125a、β2M和轻链诊断效能 血浆外泌体miR-125a诊断MM的灵敏度最高(92.3%),而λ轻链的特异性最高(93.3%)。血浆外泌体miR-125a分别与β2M、λ轻链、κ轻链联合检测可进一步提高诊断MM的灵敏度,其中以miR-125a与β2M联合检测的灵敏度最高(98.5%),表明血浆外泌体miR-125a与λ轻链、β2M单独或者联合检测可用于MM辅助诊断。见表2。

表2 血浆外泌体miR-125a、β2M、λ轻链及κ轻链联合检测诊断效能
3 讨 论
液体活检技术是指以非侵入性诊断方法全面及时获得肿瘤细胞或组织的生物信息,从而对疾病进行分析诊断,其最大特点是非侵入性样本来源,如血液、唾液、尿液等,与传统组织活检相比具有检测迅速、损伤小、可重复抽取样本等优点。目前液体活检对象主要包括循环肿瘤DNA、循环肿瘤细胞和外泌体[8-9]。外泌体中含有与肿瘤相关的脂质、蛋白质、RNA、DNA等物质,能反映母细胞特性,是液体活检理想的检测物[7]。Boyiadzis等[10]介绍各种血液肿瘤患者血清中外泌体表达水平,发现MM患者外泌体浓度显著升高,可用于血液肿瘤的鉴别诊断。Manier等[11]发现血液外泌体let-7b和miR-18a与MM患者不良无进展生存期和总体生存期相关。Zhang等[12]研究显示,血清外泌体 miR-20a-5p、miR-103a-3p、miR-4505在MM患者和健康对照者之间存在显著差异,提示血清外泌体miRNAs可单独作为MM血清生物标志物。
外周血中miRNA主要来源于外泌体,而外泌体可以保护循环miRNA免受RNA酶的降解,外泌体miRNA作为肿瘤诊断标志物相对于体液中游离miRNA具有独特优势。我们在前期研究的基础上,选取变化最显著的miR-125a进行研究,发现miR-125a在MM患者血浆及细胞培养上清中表达上调,而有文献报道MM患者骨髓组织及MM细胞系中miR-125a表达下调。有研究发现,外泌体可将ncRNA,特别是miRNAs和lncRNA从一个细胞或细胞系转移到另一个细胞或细胞系,调节许多复杂疾病的进展。供体细胞可能是肿瘤细胞、基质细胞或肿瘤干细胞[13]。鉴于上述理论,我们推测miR-125a以外泌体形式存在,MM患者血浆外泌体高表达的miR-125a可能是MM细胞与基质细胞共同作用的结果。本研究对血浆外泌体miR-125a与MM临床分期进行相关性分析,发现无论采用哪种分期方法,较高级别MM患者血浆外泌体miR-125a表达水平相对较高,提示miR-125a表达与MM恶性进程有一定关系。此外,高表达miR-125a还与血浆总蛋白有关。ROC分析发现血浆外泌体miR-125a的AUC大于β2M、λ轻链和κ轻链,且诊断灵敏度最高,提示血浆外泌体miR-125a可能是辅助诊断MM的潜在标志物。本研究样本量较小,且来自单中心,MM血浆外泌体miR-125a的作用机制仍需进一步探索。
综上所述,血浆外泌体miR-125a在MM患者中的表达高于健康人群,与疾病临床分期有关,其诊断价值优于β2M、λ轻链和κ轻链,多指标联合检测可提高MM诊断效能,提示血浆外泌体miR-125a可能是辅助诊断MM的潜在生物标志物。

