抗生素使用影响免疫检查点抑制剂治疗晚期实体肿瘤效果的临床研究
杨梦雪 严雪冰 王颖 陶明阳 童建东
扬州大学附属医院肿瘤科 225000
近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICI)在改善晚期实体肿瘤预后方面取得令人满意的成绩,然而仍有许多患者未能从中获益。因此,寻找影响ICI 治疗效果的因素显得尤为重要。最新研究表明肠道菌群能够增强多种ICI 药物(如细胞毒性T 淋巴细胞相关抗原4/程序性死亡受体1/程序性死亡配体1抑制剂)的抗肿瘤效果并减轻相关毒副反应[1-2]。在临床实践中,抗生素(antibiotics,ATB)使用会影响肠道菌群,进而可能降低ICI的治疗效果[3]。因此,本研究对136 例接受ICI 治疗的晚期实体肿瘤患者进行回顾性分析,明确ATB对ICI抗肿瘤治疗效果的影响,为进一步优化ICI治疗策略提供理论参考。
1 资料与方法
1.1 一般资料 选取2018 年1 月至2020 年1 月在本院肿瘤科进行抗ICI 治疗的136 例晚期实体肿瘤患者。通过电子病历及随访记录收集相关临床信息,主要包括年龄、性别、肿瘤类型、ECOG评分、免疫治疗策略、ATB使用、总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)等。在136 例患者中男67 例,女69 例;年龄≤65 岁62 例,年龄>65 岁74 例;肺癌63 例,食管癌30 例,其他肿瘤43 例。所有患者均接受抗ICI 单药治疗或联合化疗、放疗或抗血管生成治疗。根据ICI 治疗前后3 个月是否使用ATB,分为ATB 组(n=41)和Non-ATB 组(n=95)。使用ATB 的原因是:尿路感染(n=12),肺炎(n=19),细菌性腹膜炎(n=5)和不明原因的发热(n=5)。ATB 的使用时间均为7~14 d。β-内酰胺类ATB 为最常用(n=26),其次是喹诺酮类ATB(n=15)。
1.2 随访 通过电话或门诊的形式随访所有患者的生存状态及疾病进展情况,最后随访日期为2020 年5 月1 日。肿瘤预后评估指标包括OS 及PFS,其中OS 定义为从初次使用ICI 的日期到患者因任何原因死亡或随访截止日期,PFS 定义为初次ICI 给药的日期到临床疾病进展或者随访截止日期。
1.3 统计学方法 采用SPSS21.0 统计软件分析数据,卡方检验分析ATB 使用与临床参数的相关性,Kaplan-Meier 生存模型分析ATB 使用对肿瘤患者OS及PFS的影响,ATB 使用组与未使用组间比较使用对数秩检验,基于Cox 比例风险模型的单因素及多因素分析明确ATB 使用是否为影响OS 及PFS 的独立预后因素,P<0.05 为差异有统计学意义。
2 结果
2.1 抗生素使用与肿瘤患者临床参数之间的关系在136 例接受ICI 治疗的晚期实体肿瘤患者中,ATB 使用与临床参数之间的关系如表1 所示,ATB 使用与性别、年龄、肿瘤类型、ECOG 评分及治疗策略均无显著相关性(均P>0.05)。
2.2 抗生素使用对接受ICI 治疗的晚期实体肿瘤患者预后影响 在136 例接受ICI 治疗的晚期实体肿瘤患者中,ATB 使用组较ATB 未使用组有着更差的OS(P=0.007),见图1A;单因素分析表明ATB 使用风险比(hazard ratio,HR)=1.747,95% CI:1.138~2.683,P=0.011)和年龄(HR=2.300,95% CI:1.411~3.749,P=0.001)与OS 显著相关,详见表2;多因素分析表明两者均为影响OS 的独立预后因素(ATB 使用:HR=1.827,95% CI:1.179~2.834,P=0.007;年龄:HR=2.295,95% CI:1.369~3.848,P=0.002),详见表3。如图1B所示,在136 例接受ICI 治疗的晚期实体肿瘤患者中,ATB使用组较ATB 未使用组有着更差的PFS(P=0.000 2);单因素分析表明ATB 使用(HR=2.156,95% CI:1.417~3.283,P<0.001)和ICI 使用策略(HR=1.618,95% CI:1.082~2.420,P=0.019)与PFS 显著相关,详见表2;多因素分析表明只有ATB 使用为影响PFS 的独立预后因素(HR=1.935,95% CI:1.236~3.029,P=0.004),详见表3。
2.3 亚组分析 在136 例晚期实体肿瘤患者中,肺癌患者为63 例(46.32%),因此我们进一步探究ATB 使用对接受ICI 治疗的肺癌患者预后影响。如图2A 所示,在63 例接受ICI治疗的肺癌患者中,ATB使用组较ATB未使用组有着更差的OS(P=0.007);单因素分析表明ATB 使用(HR=2.398,95% CI:1.227~4.684,P=0.010)和年龄(HR=2.064,95% CI:1.038~4.104,P=0.039)与肺癌患者OS 显著相关,详见表4;多因素分析表明两者为影响肺癌患者OS 的独立预后因素(ATB 使用:HR=3.628,95% CI:1.686~7.808,P=0.001;年龄:HR=2.939,95% CI:1.295~6.669,P=0.010),详见表5。如图2B 所示,在63 例接受ICI 治疗的肺癌患者中,ATB 使用组较ATB 未使用组有着更差的PFS(P=0.003),单因素分析和多因素分析表明只有ATB使用是影响肺癌患者PFS 的独立预后因素(单因素HR=2.578,95% CI:1.332~4.989,P=0.005;多因素HR=2.663,95%CI:1.323~5.360,P=0.006),详见表4~5。
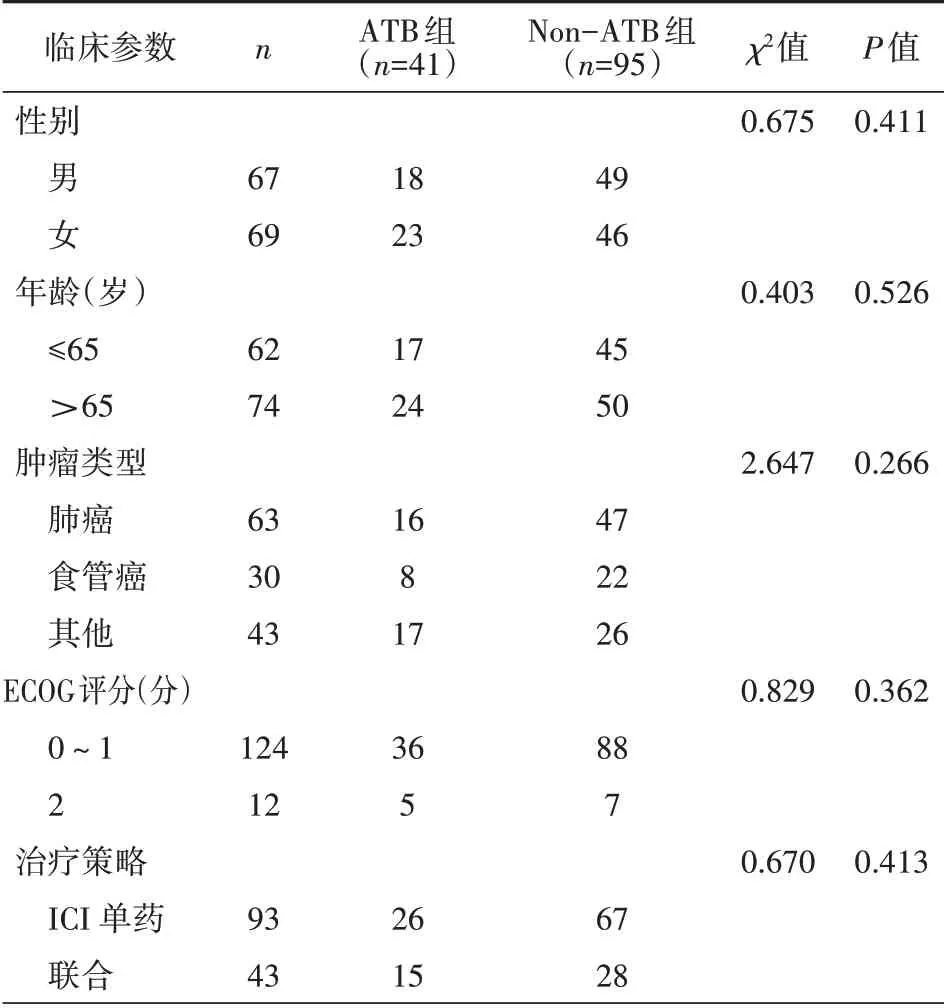
表1 抗生素使用与临床参数的关系分析(n)
3 讨论
最新研究表明,肠道菌群不仅可以促进/抑制ICI 药物的抗肿瘤临床效果,而且影响该类药物相关的不良反应[4]。例如,研究者发现长双歧杆菌可以通过增强宿主记忆T 细胞和自然杀伤细胞信号以增强免疫治疗效果,而嗜黏蛋白阿克曼氏菌则可诱导抗原特异性T 细胞反应发挥类似作用[5-6]。Song 等[7]在我国非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中发现,肠道微生物组β 多样性与抗PD-1 免疫治疗效果呈正相关,进一步研究提示Parabacteroides 和Methanobrevibacter 菌群显著富集于PFS获益的患者粪便中。类似的,Gopalakrishnan等[8]发现,梭状芽孢杆菌及Faecalibacterium 的丰度与抗PD-1 治疗效果呈正相关。Routy 等[3]发现,抗生素介导的菌群失调可降低PD-1 抑制剂的抗肿瘤效果,而口服Akkermansia Muciniphila 则可逆转上述效应,其机制为该细菌可募集T淋巴细胞迁移至肿瘤部位。此外,研究还发现肠道菌群可以改善免疫治疗相关不良反应。例如罗伊氏乳杆菌可通过减少3 型天然淋巴细胞分布进而抑制ICI 相关结肠炎的发生[9]。由此可见,肠道菌群是影响肿瘤免疫治疗临床效果的关键因素之一。
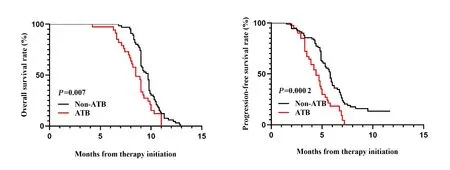
图1 ATB使用对136名ICI治疗的晚期实体肿瘤患者预后的影响
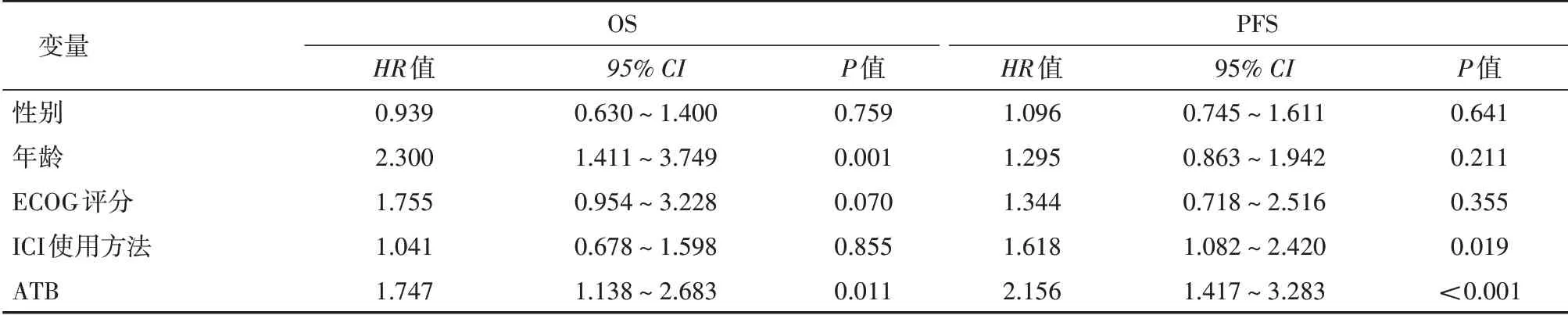
表2 单因素Cox回归模型分析ATB使用对接受ICI治疗的患者OS和PFS的影响

表3 多因素Cox回归模型分析ATB使用对接受ICI治疗的患者OS和PFS的影响
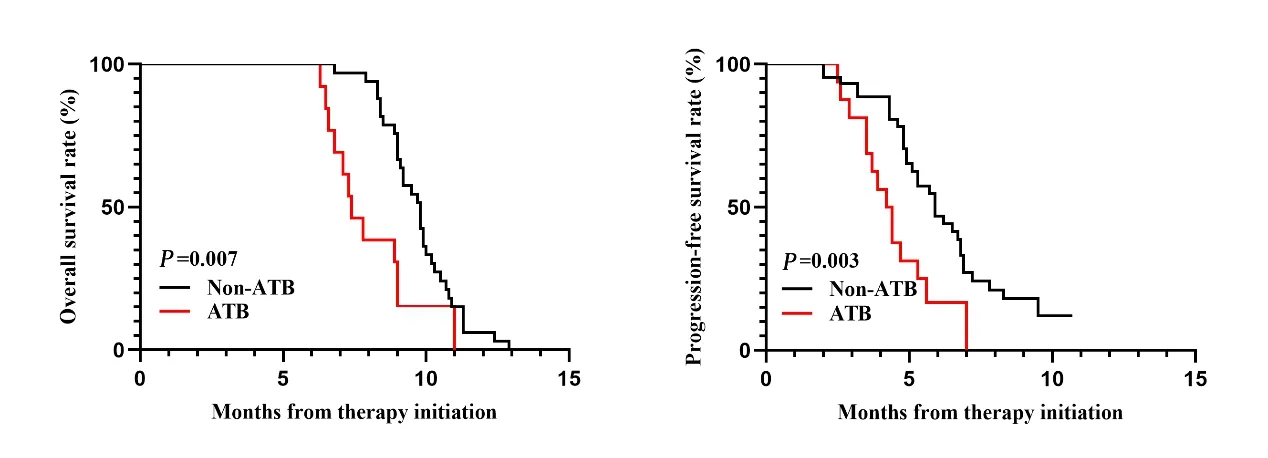
图2 63例免疫治疗的肺癌患者总生存曲线和无进展生存曲线

表4 单因素Cox回归模型分析抗生素使用对接受ICI治疗的肺癌患者OS和PFS的影响
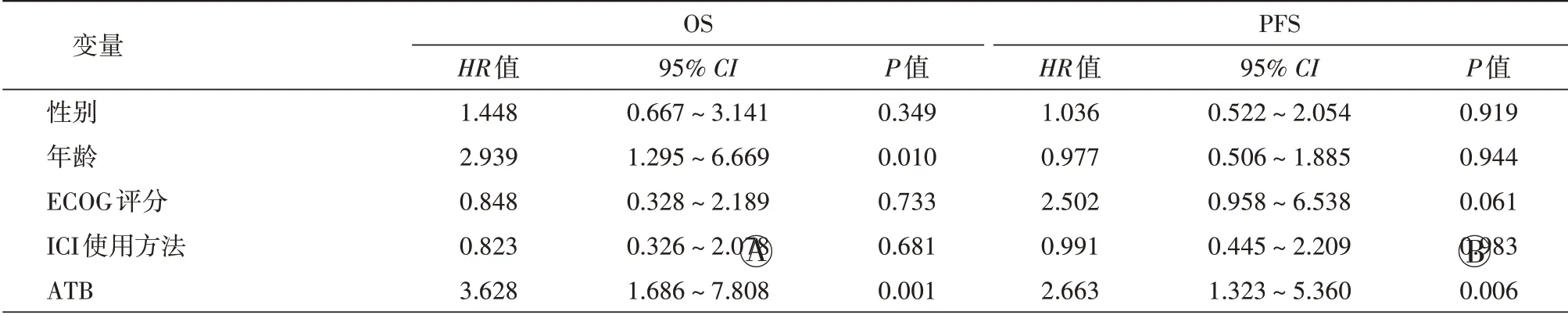
表5 多因素Cox回归模型分析抗生素使用对接受ICI治疗的肺癌患者OS和PFS的影响
临床实践中,ATB 使用通常会影响患者的肠道菌群,因而研究者开始探究ATB使用是否能够影响ICI的治疗效果。Derosa 等[10]发现与未使用ATB 患者相比,使用ATB 的晚期肾癌患者的疾病进展风险显著增加(75%比22%)、PFS(1.9 个月比7.4 个月)以及OS 显著降低(17.3 个月比30.6 个月)。此外,Elkrief 等[11]发现,ATB 治疗的患者较非ATB 治疗的患者有更差的客观反应率(0%比34%)及更短的无进展生存期(2.4 个月比7.3 个月)。然而,Kaderbhai 等[12]在接受ICI 治疗的NSCLC 患者中发现,ATB 组与非ATB 在反应率(P=0.75)及PFS(P=0.72)上无显著差异。Kulkarni 等[13]研究发现ATB 使用显著延长了进展期NSCLC 的PFS(5.0 个月比2.5个月)和OS(13.0个月比8.0个月)。由此可见,目前关于ATB使用对ICI临床疗效影响仍存在争议,因而亟需更多临床研究来进一步明确。
在本研究中,我们发现ATB使用为影响ICI临床治疗效果的不良因素,与既往部分研究结果相符。例如,Tinsley等[14]研究发现累积使用ATB 的患者中位OS 仅为6.3 个月,而未使用ATB 的患者中位OS 可达21.7 个月。Kim 等[15]发现ATB 使用是影响ICI 治疗的患者不良预后的重要因素(PFS:HR=1.715,P=0.001;OS:HR=1.785,P=0.001)。因此,根据既往研究结果,我们推测ATB 使用可能通过减少肠道菌群丰度进而降低ICI 的抗肿瘤效果[16-17]。亚组分析中,ATB 应用同样为肺癌患者OS 和PFS 的独立不良预后因素。既往研究中,Zhao 等[18]通过研究也发现ATB 使用缩短了患者OS(P=0.002 1)和PFS(P<0.000 1)。然而,Kaderbhai等[12]研究结果是阴性的。我们推测上述差异研究结果可能由于不同研究中抗生素类型、使用时间窗、使用周期不同而造成。
本临床研究存在如下局限性:首先样本量有限(n=136)且为单中心回顾性研究,因而ATB使用与ICI疗效的临床相关性尚需在大样本的多中心临床研究中进一步验证;其次,本研究纳入的肿瘤类型多为肺癌和食管癌,因而今后研究应更多关注于ATB使用在其他ICI治疗的晚期实体肿瘤(如泌尿系和胃肠道肿瘤等)中的影响;再次,ATB 使用是否对ICI相关的毒副反应产生影响有待后续研究进一步确证;最后,本研究尚未比较ATB组与非ATB组肠道菌群的变化,将有待基于宏基因组测序的后续研究来阐明。
本研究通过回顾性分析136 例晚期实体肿瘤病例初步证实ATB使用可降低ICI的抗肿瘤效果。因此,对于晚期实体肿瘤患者,ICI 治疗期间应谨慎使用ATB。由于本研究尚存在局限性,多中心大样本的临床验证仍十分必要。同时,基于测序技术及动物模型的机制研究也有助进一步明确ATB影响ICI治疗效果的具体机理。

