唾液腺干燥综合征继发黏膜相关淋巴组织淋巴瘤的临床病理分析
池彦廷,张延平,张秋露,刘翠苓,李斌斌△
[1.北京大学口腔医学院·口腔医院,病理科 国家口腔疾病临床医学研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室,北京 100081; 2. 中国医学科学院口腔颌面部肿瘤精准病理诊断创新单元(2019RU034),北京 100081; 3.郑州大学第一附属医院病理科,郑州 450052; 4.四川大学华西临床医学院,成都 610041; 5.北京大学基础医学院病理学系,北京 100191; 6.北京大学第三医院病理科,北京100191]
黏膜相关淋巴组织(mucosa associated lymphoid tissue,MALT)淋巴瘤的概念首先由Isaacson等[1]于1983年提出,是一种发生在淋巴结外黏膜相关淋巴组织的B细胞淋巴瘤,属于非霍奇金淋巴瘤的一类。其发病率较高,约占B细胞性淋巴瘤的7%~8%[2]。MALT淋巴瘤的病因不明,目前普遍认为该肿瘤的形成可能与反复感染和自身免疫性疾病相关,如慢性胃炎(幽门螺杆菌感染)、桥本甲状腺炎和干燥综合征(Sjögren’s syndrome,SS)等[3-4]。目前,胃MALT淋巴瘤作为MALT淋巴瘤中最常见的类型,临床研究较多,其诊断主要依据临床表现、组织学形态、免疫表型、基因重排和分子病理学特征,一些特征性的病理表型可以为该疾病的临床治疗和预后评估提供一定参考依据。
SS是一种病因不明的自身免疫性疾病,主要发生于唾液腺、泪腺等外分泌腺组织。唾液腺SS患病率较低,一般为良性临床过程,但部分患者有恶变为淋巴瘤的风险,最常见的恶变类型为MALT淋巴瘤,约占46%~56%[5]。唾液腺SS继发MALT 淋巴瘤(以下称SS-MALT淋巴瘤)的临床经过和生物学行为呈惰性,预后较好,但也有高级别恶性淋巴瘤转化的风险,预后转差[6-7]。唾液腺SS-MALT淋巴瘤发病率低,临床上患者病例数较少,对其病理表型上的认识较为有限。由于缺乏特异性的临床表现和组织形态特点,仅凭临床特点和病理形态可能会导致诊断上的漏诊,以致于低估SS-MALT淋巴瘤的发病率,甚至可能会延误对其进行针对性治疗并进而影响预后的评估。
本研究将唾液腺SS-MALT淋巴瘤和无SS病史的MALT淋巴瘤(以下称非SS-MALT淋巴瘤)进行对比,分析唾液腺SS-MALT淋巴瘤的临床病理特点,并探索联合应用组织病理形态、蛋白表达和分子表型检测在唾液腺SS-MALT淋巴瘤病理诊断和预后评估中的应用价值。
1 资料与方法
1.1 研究对象
收集1997年1月至2016年12月期间就诊于北京大学口腔医院并被确诊为SS的患者,从中筛选出恶变为唾液腺MALT淋巴瘤的病例;另选取同期12例唾液腺非SS-MALT淋巴瘤患者作为对照。纳入标准:(1)SS诊断符合国际诊断标准[8];(2)MALT淋巴瘤诊断符合2017年WHO淋巴瘤诊断标准;(3)所有患者经病理活检确诊并至少由两位专业病理医师审核。排除标准:(1)病史不明确;(2)病理诊断不明确。本研究已获得北京大学口腔医院生物医学伦理委员会批准(PKUSSIRB-201949125)。
1.2 方法
1.2.1临床情况分析 通过查阅患者的病历,获得性别、年龄、发病部位、临床表现、治疗方法等临床资料,并通过电话随访。
1.2.2苏木精-伊红染色 所有标本取自于患者原发病灶,经甲醛溶液固定、石蜡包埋、切片、苏木精-伊红(hematoxylin-eosin,HE)染色。
1.2.3免疫组织化学标记 采用EnVision法,抗体CD20、CD3ε、CD138、AE1/AE3、Pax5、Ki-67、κ轻链和λ轻链均购自丹麦DAKO公司。每次均设有阳性对照,以磷酸盐缓冲液(phosphate-buffered saline,PBS)替代一抗作为阴性空白对照。
1.2.4免疫球蛋白基因重排分析 石蜡包埋组织 DNA 提取试剂盒购自德国QIAGEN公司,按照试剂盒说明书进行操作。免疫球蛋白(immunoglobulin,Ig)基因重排克隆性分析采用BIOMED-2方案[免疫球蛋白重链(immunoglobulin heavy chain,IgH)-FR1、IgH-FR2、IgH-FR3、免疫球蛋白κ链(immunoglobulin kappa chain,IgK)-A、IgK-B],使用ABI3500基因分析仪进行毛细管电泳,结果使用GeneMapper软件进行分析。毛细管电泳基因扩增的结果在目标片段范围内见明显的尖锐扩增峰,可判读为阳性,即存在单克隆性重排;若呈现连续的波浪小峰或数个低矮杂乱峰,甚至无峰出现则判读为阴性。
1.2.5MALT1、IGH和BCL6基因断裂的检测 应用间期荧光原位杂交技术(fluorescenceinsituhybridization,FISH)在3~4 μm厚的石蜡切片上进行,操作步骤按照说明书进行。MALT1双色分离探针、IGH双色分离探针、BCL6双色分离探针均购自美国Vysis公司。封片后在荧光显微镜下观察,计数200个肿瘤细胞核,超过15%的细胞核内出现红色和绿色分开(分开距离应大于点信号直径的两倍)的信号,判读为阳性;或者出现3个或3个以上的红色和绿色融合形成的黄色信号,亦判读为阳性;否则为阴性。
1.3 统计学方法
采用SPSS 24.0 软件进行统计学分析,采用χ2检验、Fisher 精确检验法进行阳性率比较,检验水准α= 0.05,P<0.05为差异有统计学意义。
2 结果
2.1 临床情况
本研究共收集260例SS患者,其中男性19例,女性241 例(男 ∶女=1 ∶12.68), 发病年龄为6~83岁(平均年龄为58.92岁)。SS患者中有16例恶变为MALT淋巴瘤,其恶变率约为 6.15%,恶变时间为3~240个月。SS-MALT淋巴瘤组包括2例男性和14例女性(男 ∶女=1 ∶7),年龄范围在 30~83岁(平均年龄为57.25 岁); 肿瘤发生于腮腺者13例(81.25%),舌下腺者2例(12.5%),腭腺者1例(6.25%)。所有患者均行肿瘤切除术,截至2019年12月20日电话随访时,SS-MALT淋巴瘤组有2例患者因发生高级别转化,进展为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)而死亡。
2.2 组织形态、蛋白表达和分子表型特点
2.2.1HE染色镜下表现 SS-MALT淋巴瘤镜下表现为腺泡不同程度萎缩破坏;部分病例可见腺腔囊性扩张;淋巴细胞弥漫浸润,主要为中心细胞样细胞(细胞小到中等、胞浆少、核形不规则且核仁不明显、染色质致密)、单核样B细胞(细胞中等大小、胞浆淡染、核圆或稍有凹陷、有小核仁)和小淋巴细胞,可出现少量浆细胞和免疫母细胞;形成反应性淋巴滤泡,肿瘤细胞可浸润淋巴滤泡形成滤泡植入;腺上皮破坏,可见淋巴上皮病变(图1)。非SS-MALT淋巴瘤与SS-MALT淋巴瘤组织形态表现类似。
2.2.2免疫表型特点 SS-MALT淋巴瘤组与非SS-MALT淋巴瘤组CD20和Pax5均为阳性,阳性率100%(图2)。对于Ki-67阳性率,SS-MALT淋巴瘤组≤10%者占50%(8/16),>10%者占50%(8/16);非SS-MALT淋巴瘤组≤10%者占66.7%(8/12), >10%者占33.3%(4/12)。SS-MALT淋巴瘤组中37.5%(6/16)有κ及λ轻链限制性表达,非SS-MALT淋巴瘤组表达率为16.7%(2/12)。AE1/AE3染色显示,两组分别有93.75%(15/16)、83.3%(10/12)残存腺上皮。全部病例肿瘤细胞CD3ε均为阴性,CD138染色显示有1%~3%的浆细胞。
2.2.3PCR基因重排结果 应用IgH-FR1、IgH-FR2、IgH-FR3及IgK-A和IgK-B五组引物进行克隆性分析,15例(1例因蜡块质量差而排除)SS-MALT淋巴瘤病例中,14例检测出单克隆性重排,灵敏度为93.3%。9例(3例因蜡块质量差而排除)非SS-MALT淋巴瘤患者有8例检测出克隆性重排,其灵敏度为 88.9%。SS-MALT淋巴瘤组中IgH-FR1、IgH-FR2、IgH-FR3阳性检出率分别为 33.3%、53.3%和33.3%(图3A);IgH三管联合应用,检出率为80%。IgK-A阳性检出率为20%(图3B), IgK-B阳性率为26.7%,IgK两管联合应用阳性检出率为40%。联合应用IgH和IgK阳性检出率达93.3%。非SS-MALT淋巴瘤组中IgH-FR1、IgH-FR2、IgH-FR3阳性检出率分别为44.4%、44.4%和44.4%;三管联合应用阳性检出率为55.6%。IgK-A阳性检出率为 55.6%,IgK-B阳性检出率为11.1%;两管联合应用检出率为55.6%。联合应用IgH和IgK阳性检出率可达88.9%。
2.2.4FISH分子表型 本研究选取11例SS-MALT淋巴瘤患者进行分子遗传学研究,其中MALT1双色分离探针阳性者4例(36.4%), 2例为基因断裂(图4A),2例为3基因拷贝,阴性者7例(63.6%);IGH双色分离探针阳性者3例(27.3%), 3例均为基因断裂,阴性者8例(72.7%);BCL6双色分离探针阳性者3例(27.3%),其中1例为基因断裂(图4B),2例为3基因拷贝,阴性者8例(72.7%), 三种探针共同检出率为72.7%。
3 讨论
SS-MALT淋巴瘤是由SS恶变而来的一种低度恶性B细胞淋巴瘤。SS首先由瑞典眼科学家Sjögren于1933年首次报道,提出眼干、口干为该疾病的主要临床特征,其特征性病理学改变为腺体组织被密集淋巴细胞取代,形成淋巴滤泡以及上皮肌上皮岛。SS发病率为 0.1%~4.8%,常发生于40岁以上的中老年女性,男女发病率之比为1 ∶9。SS一般临床预后良好,但约有5%~10%恶变为淋巴瘤。报道显示,从SS恶变为淋巴瘤的中位时间为7.5年,恶变危险性较普通人群增加44倍,其发病率最高的为MALT淋巴瘤[5]。本研究中,260例SS患者有16例恶变为SS-MALT淋巴瘤,其恶变率约为6.15%,恶变时间为3~240个月,与以往报道相符。MALT多发于中老年人,女性略多于男性,男女比约为1 ∶1.2[9],而本研究SS-MALT淋巴瘤组男女比例为1 ∶7,女性发病率远高于男性,这种差异可能与SS好发于女性相关。另外,本研究中有81.25% SS-MALT淋巴瘤患者的发病部位为腮腺,证实腮腺是SS-MALT淋巴瘤的最常见发病部位。
研究显示,SS-MALT 淋巴瘤没有特异的免疫组织化学标记物,其蛋白表达与边缘区B淋巴细胞基本相同[10],但需要和其他小 B 细胞淋巴瘤相鉴别:如套细胞淋巴瘤表达CD5、cyclinD1;淋巴浆细胞淋巴瘤表达CD138;滤泡性淋巴瘤表达CD5、CD10;小淋巴细胞性淋巴瘤表达CD5、CD23等[11]。临床诊断工作中,Pax-5常作为B细胞的一种核标记物,与CD20共同使用,用于B细胞淋巴瘤的诊断和鉴别诊断。本研究中,SS-MALT淋巴瘤组与非SS-MALT淋巴组CD20和Pax-5阳性率均达100%。CD20的弥漫性阳性提示为B细胞淋巴瘤。Pax5基因是Pax基因家族的成员之一,具有编码B细胞特异转录因子、抑制非B系细胞基因、调控B 细胞定向分化[12]和调节 IgH基因VJ-DJ 重排的功能[13]。在免疫表型方面,SS-MALT淋巴瘤与非SS-MALT淋巴瘤基本相似,与其他部位MALT淋巴瘤相同,无明显特异性。
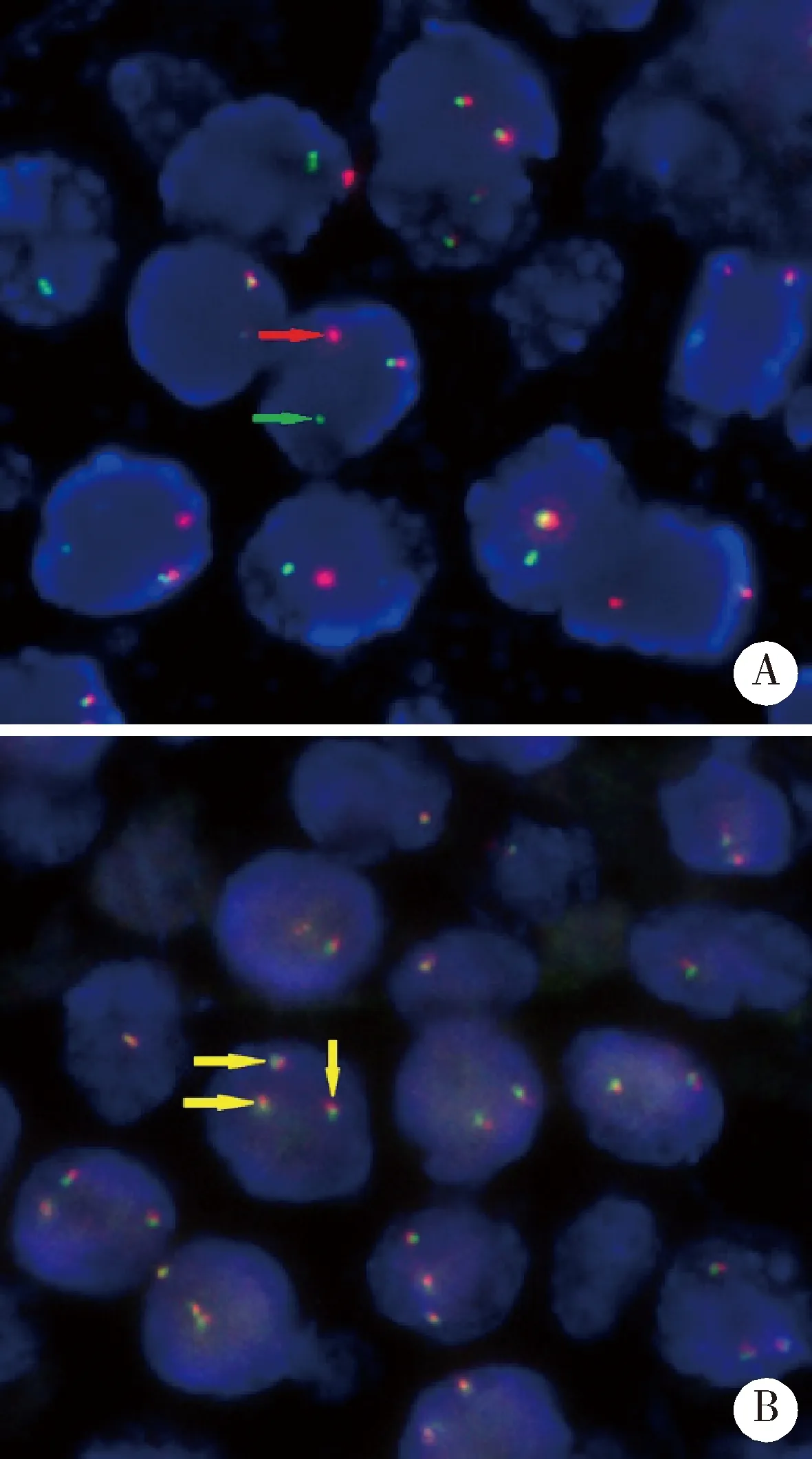
A, FISH with a MALT1 dual-color break-apart probe. Arrows pointed to the separated red and the green signals (split signals) in a lymphoma cell nucleus, indicating a break of the region within the MALT1 gene (18q21.1). B, FISH with BCL6 dual-color break-apart probe. Arrows pointed to three fusion signals in a lymphoma cell nucleus, suggesting an intact BCL6 gene (3q27) with 3 copies (one extra copy).
B淋巴细胞分化中DNA发生特异性变化,造成Ig基因重排。当发生淋巴瘤时,B淋巴细胞表现为单克隆性增生,单克隆性的基因重排可以通过免疫组化、Ig基因扩增或者核酸分子杂交的方法检测出来[14]。MALT淋巴瘤可用免疫球蛋白κ和λ轻链的限制性表达来评估B淋巴细胞克隆性增生的程度,是B淋巴细胞单克隆性增生的标志[15]。本研究对SS-MALT淋巴瘤组和非SS-MALT淋巴瘤组进行κ和λ限制性表达的检测,其阳性率分别为37.5%和 16.7%,SS-MAT淋巴瘤组检出率高于非SS-MALT淋巴瘤组,但两者之间差异无统计学意义。通过PCR技术进行Ig基因重排的检测,其阳性检出率高于免疫组织化学法[16]。应用IgH-FR1、IgH-FR2、IgH-FR3三个框架区引物进行基因重排的检测,SS-MALT淋巴瘤组的阳性检出率分别为33.3%、53.3%、33.3%,FR2区引物检出率高于FR1区和FR3区,但差异无统计学意义;三管联合应用,阳性检出率达80%。非SS-MALT淋巴瘤组三个框架区引物阳性检出率均为44.4%,三管联合应用检出率达55.6%。IgH在SS-MALT淋巴瘤组阳性检出率高于非SS-MALT淋巴瘤组,但差异无统计学意义。此外, 在B细胞淋巴瘤中有时会出现IgK基因的单克隆重排[17]。本研究中,SS-MALT淋巴瘤组与非SS-MALT淋巴瘤组IgK-A的阳性检出率为20.0%和 55.6%,IgK-B阳性检出率为 26.7%和11.1%。两管联合应用SS-MALT淋巴瘤组(40%)低于非SS-MALT淋巴瘤组(55.6%),但差异无统计学意义。本研究中IgH和IgK基因重排在两组的阳性检出率差异无统计学意义;但IgH和IgK联合应用,SS-MALT淋巴瘤组阳性检出率高,可达93.3%,非SS-MALT淋巴瘤组达88.9%,明显提高了石蜡组织标本Ig基因单克隆重排的检出率,增加了疾病诊断的精准性。
染色体易位及基因异常与MALT淋巴瘤的诊断、治疗和预后等相关,不同分子遗传特征的MALT淋巴瘤在临床分期和预后有一定差异。现已证实的MALT淋巴瘤分子遗传学改变有:t(11;18)(q21;q21)/API2-MALT1、t(14;18)(q32;q21)/IGH-MALT1、t(1;14)(p22;q32)/IGH-BCL10、t(3;14)(p14;q32)/IGH-FOXP1[18-19]和BCL6基因染色体易位[20]。研究表明,胃MALT淋巴瘤若伴有t(11;18)(q21;q21),其临床分期晚,侵袭性强,易向高级别转化,且耐受幽门螺旋杆菌根除的标准治疗方法,预后较差[21-22]。目前,有关染色体和基因异常在唾液腺SS-MALT淋巴瘤中的研究尚少。FISH作为检测细胞染色体结构及基因异常的一种分子细胞遗传学技术,能准确地检测淋巴瘤相关基因并显示出拷贝数,具有快速、安全、敏感性强、特异性高的优点[21]。本研究中MALT1双色分离探针、IGH双色分离探针、BCL6双色分离探针的阳性检出率分别为36.4%、27.3%和27.3%;三者联合应用,基因异常检出率为 72.7%,既包括基因断裂,亦包括基因的多拷贝。因此,FISH技术的应用可进一步提高SS-MALT淋巴瘤诊断的精确性和特异性。
大部分SS-MALT淋巴瘤预后良好,多数患者临床表现和生物学行为呈惰性,但也有少部分SS-MALT淋巴瘤转化为高度恶性的DLBCL。本研究中,2例患者因肿瘤高级别转化为DLBCL而死亡,其中1例患者的Ki-67高达50%,另1例患者κ及λ轻链限制性表达(κ ∶λ>10 ∶1)。这些表现可能对SS-MALT淋巴瘤高级别转化有提示意义,但由于本研究病例过少,需在增加病例数后进一步验证。因此,SS-MALT淋巴瘤应定期复诊和长期随访,及早发现复发和高级别转化的线索,做到早发现、早治疗,提高患者的生存率。
综上所述,唾液腺SS-MALT淋巴瘤作为非霍奇金淋巴瘤中的一种低度恶性肿瘤,总体预后较好,但由于缺乏特异性的临床表现及组织学形态特点,病理诊断过程中联合应用组织形态观察、免疫组织化学、PCR和FISH技术,将有助于该疾病的精准病理诊断,为唾液腺SS-MALT淋巴瘤的临床规范化治疗和预后评估提供参考依据。

