少汗性外胚层发育不良患者EDA基因突变检测及表型分析
吴君怡, 余 淼, 孙仕晨, 樊壮壮, 郑静蕾, 张刘陶, 冯海兰, 刘 洋△, 韩 冬△
(1. 北京大学口腔医学院·口腔医院,修复科 国家口腔疾病临床研究中心 口腔数字化医疗技术和材料国家工程实验室 口腔数字医学北京市重点实验室,北京 100081; 2. 深圳市口腔医院种植修复科,深圳 518001; 3. 北京医院口腔科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100010)
外胚层发育不良(ectodermal dysplasia, ED)是一类涉及两种和两种以上外胚层来源器官发育异常的疾病,可造成全身多个系统的缺陷,至今已报道170余种病理损害,具有显著的遗传性[1-2],其中最常见的是少汗性外胚层发育不良(hypohidrotic ectodermal dysplasia, HED)。HED是一种罕见的先天遗传性疾病,新生儿发病率约为十万分之七[3]。HED患者的典型临床表现为“三联征”,包括汗腺发育异常、毛发稀疏和牙齿发育异常,具体表现为汗腺分泌功能低下甚至丧失导致的少汗或无汗,皮肤薄且干燥,常有湿疹;毛发卷曲且稀少;多数乳恒牙甚至全部乳恒牙先天缺失,余留牙为锥形牙或过小牙[2]。此外,患者常伴有特殊面容,如:前额突出,眼周色素沉着,眼周皮肤多皱,鞍状鼻,上颌发育不足,上、下唇外翻等[4]。目前, HED已明确的遗传方式有3种:常染色体显性、常染色体隐性以及X连锁遗传。65%~75%的HED病例为X连锁遗传,主要与定位于人类染色体Xq12-13.1的ectodysplasinA(EDA)基因突变相关,而常染色体显性或隐性遗传的HED多与ectodysplasinAreceptor(EDAR,定位于2q11-13)基因及EDARassociateddeathdomain(EDARADD,定位于1q42.3-43)基因的突变相关[5-6]。
EDA基因属于肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员,共有9个外显子,约95%的基因变异发生在第1、3、5、8、9外显子上[7-8]。EDA蛋白是Ⅱ型跨膜蛋白,包含一个短的胞内区、单一跨膜区和一个长的胞外区[9]。EDA蛋白有4个重要的功能结构域,分别为:(1)跨膜域:由第1外显子参与编码,负责跨膜运输;(2)前体蛋白加工酶furin识别序列:由第3外显子参与编码,是EDA前体蛋白发生裂解的识别位点;(3)胶原样结构域:由第5~6外显子参与编码,负责维持TNF结构域正常折叠构象的形成,促进TNF结构域的多聚化;(4)TNF结构域:由第7~9外显子参与编码,是EDA与下游受体EDAR结合的重要区域[10]。研究报道显示,EDA基因变异中37.8%的变异位点位于TNF结构域,22.0%的变异位点位于胶原样结构域,7.3%的变异位点位于跨膜域, 7.3%的变异位点位于前体蛋白加工酶furin识别序列[11]。
小鼠模型研究发现,在胚胎发育第14天,可在上皮基底层检测到Eda的表达;在胚胎发育第15天,可在蕾状期牙胚上皮中检测到Eda的表达,随后,Eda可在牙胚间充质中持续性表达至帽状期末期[12]。此外,EDA在人体多种组织均有表达,包括毛囊、神经外皮、胸腺、骨和上皮等,可参与人类牙齿、毛发、皮肤等组织器官的形成[8, 13-14]。EDA基因突变除与HED相关外,还可导致单纯型先天缺牙[3, 15]。
截至目前,人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)已收录300余种EDA基因突变类型。尽管已明确的与HED有关的EDA基因突变超过140余种,约50%是错义突变[11, 16],但是新的EDA基因突变仍有待发现,与牙齿缺失位点有关的基因型-表型相关性分析仍有待完善。本研究拟对近年来临床收集到的HED患者进行EDA基因致病突变的筛查,旨在发现新检出的突变,并对HED患者的临床表型及缺失牙位进行基因型-表型相关性分析。
1 资料与方法
1.1 病例收集
在就诊于北京大学口腔医院修复科的先天缺牙患者中,收集临床表现为毛发稀少、汗腺功能异常、X线检查证实缺牙区无恒牙胚的患者。本试验获得北京大学口腔医院伦理委员会批准(批准号:PKUSSIRB-201736082), 研究对象包括患者和健康人均签署知情同意书。
1.2 基因组DNA提取
提取患者及家系成员的外周静脉血,经乙二胺四乙酸抗凝剂抗凝后,使用全血基因组DNA提取试剂盒(康为世纪生物科技有限公司,中国), 按照操作说明提取基因组DNA。对于不便获取外周静脉血的患者及家系成员,使用GeneFiXTM唾液收集装置(Isohelix公司,英国)采集唾液,使用GeneFiXTM唾液DNA分离试剂盒提取基因组DNA。提取完成的基因组DNA置于-20 ℃保存。
1.3 聚合酶链式反应、Sanger测序及单克隆测序
使用引物设计网站(www.ncbi.nlm.nih.gov/tools/primer-blast)设计涵盖EDA基因编码区外显子的8对引物,使用DNA聚合酶(博迈德公司,中国)对先证者DNA进行聚合酶链式反应(polymerase chain reaction,PCR), 扩增产物经琼脂糖凝胶电泳鉴定后进行Sanger测序(睿博兴科生物公司,中国)。使用DNA序列分析软件Chromas2.6对DNA序列峰图进行分析,使用NCBI数据库BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)与正常人群的EDA基因序列(NM_001399.5)进行比对。对于在女性携带者中检测出的EDA杂合突变,利用CloneSmarter-TOPO载体克隆试剂盒(CloneSmarter公司,美国)对PCR扩增产物进行单克隆测序进一步验证变异(睿博兴科生物公司,中国)。
1.4 突变蛋白功能预测及致病性分级
在人类基因组整合数据库(https://gnomad.broadinstitute.org/)中检索检测出的EDA基因突变位点,去除最小等位基因频率(minor allele frequency, MAF)大于0.01的单核苷酸多态性(single nucleotide polymorphism, SNP)位点,使用在线软件Polyphen 2(http://genetics.bwh.harvard.edu/pph2/)、MutationTaster(http://www.mutationtaster.org/)和Provean(http://provean.jcvi.org/index.php)分别对检测出的EDA基因错义突变进行蛋白质功能预测。使用《美国医学遗传学和基因组学会遗传变异致病性分级指南》对检测出的突变进行致病性评估。
1.5 保守性分析及蛋白二级、三级结构预测
通过Uniprot数据库(http://www.uniprot.org/)获取不同物种的EDA蛋白序列,下载FASTA格式数据,使用T-coffee数据库(http://www.ebi.ac.uk/Tools/msa/tcoffee)对检测出的EDA蛋白突变位点进行保守性分析。
通过Swiss-model数据库(https://swissmodel.expasy.org/)进行EDA蛋白同源建模,对突变蛋白三维结构进行预测。获取EDA-A1剪切体模板(第233~391位氨基酸),将模板导入到PyMOL 2.4.0软件中,通过修改突变位点的氨基酸,对突变EDA蛋白的三维结构进行预测分析。对于突变位点位于第233位氨基酸前的突变,通过MutationTaster数据库(http://www.mutationtaster.org/)获取突变后的氨基酸序列,使用Psipred 4.0软件对突变EDA蛋白进行二级结构预测分析。
1.6 EDA基因突变相关的HED患者恒牙缺失牙位统计分析
根据临床和X线检查结果,对检测出EDA基因突变的HED患者的缺失恒牙进行汇总和统计分析。计量资料以均数±标准差表示,左、右侧同名牙位缺失牙数目的对比使用配对数据t检验。分别计算不同牙位缺牙率(该牙位缺失牙数目/该牙位牙总数), 采用PRISM 8软件分别对不同牙位缺牙率进行卡方检验,并绘制缺牙率图,P<0.05为差异有统计学意义。
2 结果
2.1 变异检测及功能预测
本研究在12个HED家系中发现8个家系的9例HED男性患者分别携带8个EDA基因突变,检出率为66.67%(图1), 分别是:移码突变c.619delG(p.Gly207Profs*73),无义突变c.676C>T(p.Gln226*),错义突变c.164T>C(p.Leu55Pro)、c.457C>T(p.Arg153Cys)、c.466C>T(p.Arg156Cys)、c.584G>A(p.Gly195Glu)、c.673C>T(p.Pro225Ser)和c.905T>G(p.Phe302Cys),其中,#632先证者和#688先证者(图1A、B)携带相同的EDA基因突变c.457C>T(p.Arg153Cys);#362先证者(图1E)携带2个不同的EDA基因突变c.673C>T(p.Pro225Ser)和c.676C>T(p.Gln226*)。在检出的8个EDA基因突变中,c.619delG(p.Gly207Profs*73)、c.676C>T(p.Gln226*)、c.164T>C(p.Leu55Pro)、c.673C>T(p.Pro225Ser)和c.905T>G(p.Phe302Cys)是未报道过的新检出的突变。
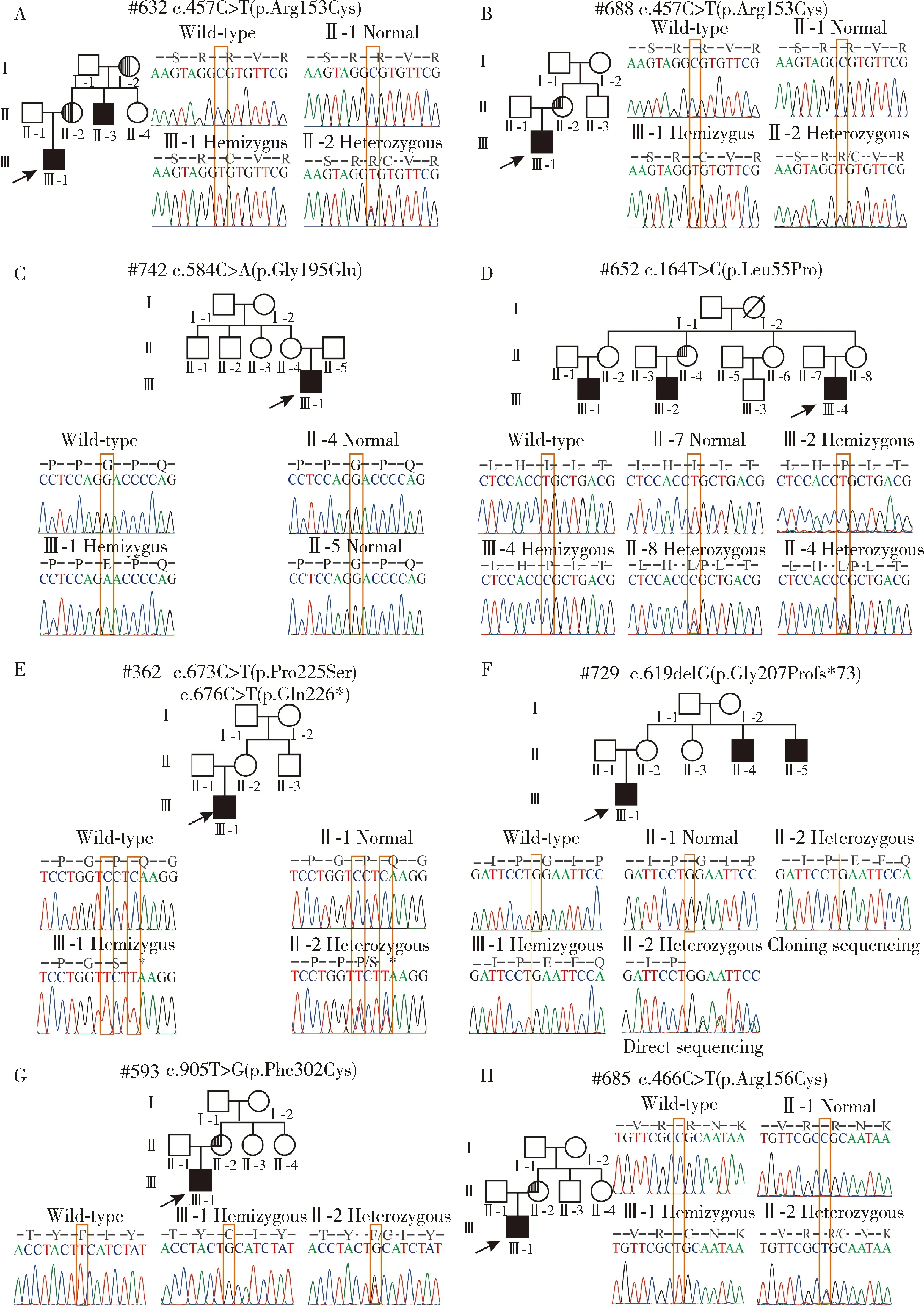
A-H, pedigree and EDA gene sequencing chromatograms, semicircle shade indicates female carrier with hypodontia and hypotrichosis, quarter-circle shades indicate female carriers with hypodontia.
检出的8个EDA基因突变在人类基因组整合数据库中均未检索到,综合使用在线软件Polyphen-2、Mutation Taster以及Provean预测变异蛋白的功能影响,根据《美国医学遗传学和基因组学会遗传变异致病性分级指南》,发现这些突变表现为不同程度的致病性(表1)。对8个家系可获得的家系成员进行EDA基因突变检测,#742先证者的母亲(图1C)未检测到EDA基因突变,证明#742先证者携带的EDA基因突变是新发突变(denovomutation);其余7个家系中先证者的母亲均可检测到与先证者一致的EDA基因突变,证明这些家系中先证者的EDA基因突变均分别遗传自其母亲。
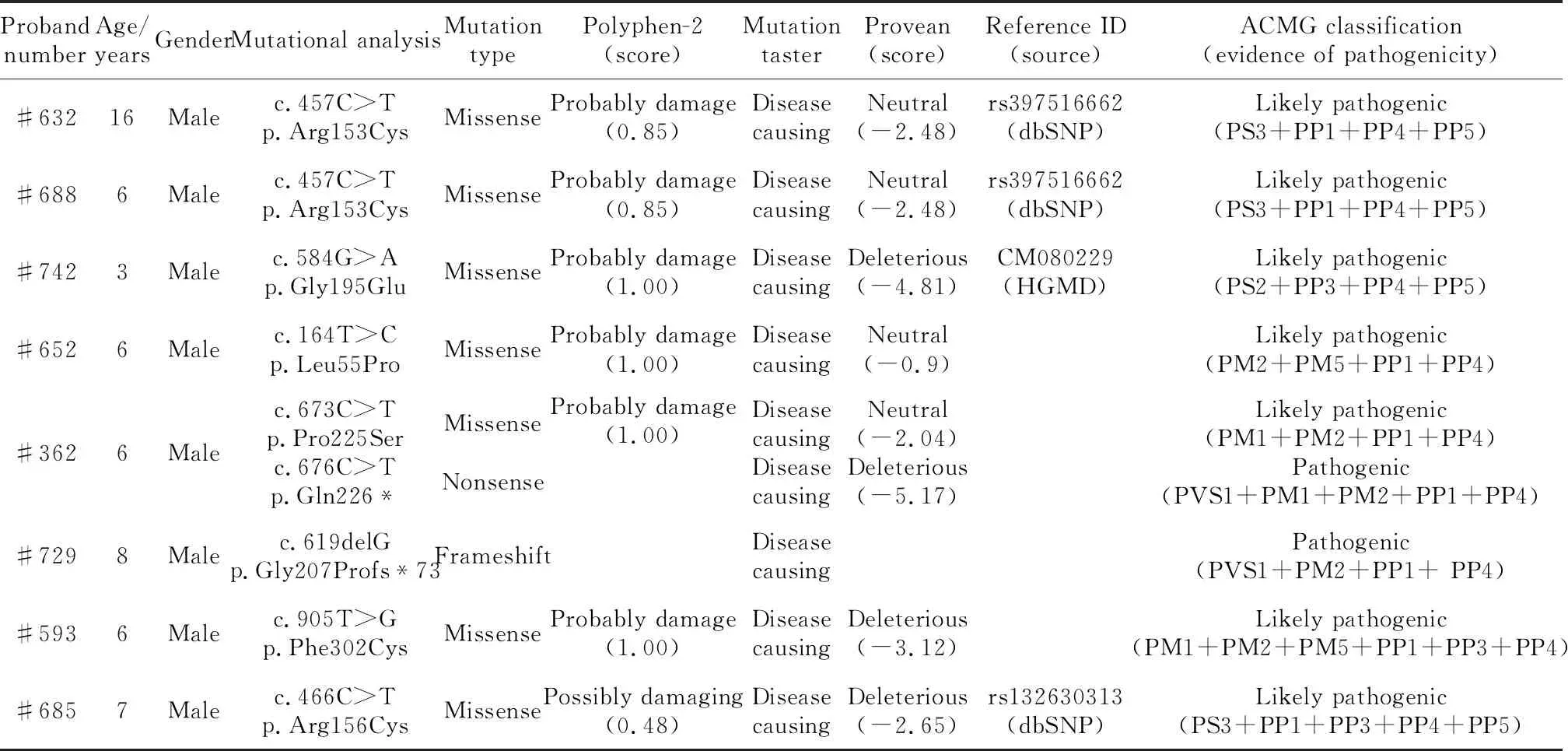
表1 本研究中检测出的EDA基因突变
2.2 HED 患者的临床表型
本研究在8个家系中共筛查出9例携带EDA基因突变的男性HED患者(图2),均有毛发稀疏、皮肤干燥、汗腺功能减退以及HED相关特殊面容(图2A、D、H、O)。口腔表型也十分典型,均表现为多数牙乳恒牙先天缺失,余留前牙呈锥形或过小牙(图2B、C、F、I、J、L~N、P~V)。值得注意的是,#688先证者除典型的毛发稀疏,汗腺功能减退以及多数牙缺失外,还表现出先天性乳头乳晕缺如(图2K), 这一表型在EDA基因突变的HED患者中尚未见报道。
2.3 保守性分析及变异蛋白结构预测
对检测出的EDA基因的6个错义突变位点进行保守性分析,发现这些突变位点在不同物种间均高度保守(图3)。对错义突变p.Phe302Cys进行EDA突变蛋白三维结构预测分析,发现第302位氨基酸由含有苯环结构的苯丙氨酸替换为含有二硫键的半胱氨酸,使蛋白构象发生改变(图4A~D)。对错义突变p.Leu55Pro、p.Arg153Cys、p.Arg156Cys、p.Gly195Glu、p.Pro225Ser、p.Gln226* 和p.Gly207Profs*73进行EDA蛋白二级结构预测,发现p.Leu55Pro、p.Arg153Cys、p.Arg156Cys和p.Gly195Glu导致EDA蛋白二级结构中的α-螺旋和β-折叠发生改变(图4E~I);无义突变p.Gln226*导致EDA蛋白第266位氨基酸后的结构缺失,蛋白显著截短(图4J);移码突变p.Gly207Profs*73导致EDA蛋白自207位氨基酸开始发生序列改变,在之后的73个氨基酸位置发生翻译提前中止,使蛋白长度显著截短(图4K)。
2.4 EDA突变相关的HED患者恒牙缺牙数目和缺失牙位的统计分析
对检测出的9例携带EDA基因突变的男性HED患者的恒牙缺牙数目及缺失牙位进行统计分析(表2),分别记录不同患者上颌右侧、上颌左侧、下颌右侧、下颌左侧缺失牙数目情况。经统计分析后得到如下结果:(1)患者缺失牙位呈左、右对称分布,左、右侧同名牙之间差异无统计学意义(P>0.05),因此后续将左、右侧缺失牙数目进行合并统计;(2)患者平均缺失牙数目为(13.86±4.49)颗,其中上颌平均缺失牙数目为(13.14±5.76)颗,缺失率为73.02%,下颌平均缺失牙数目为(14.57±3.05)颗,缺失率为80.95%,上、下颌缺失牙数目差异无统计学意义(P>0.05);(3)在上颌牙列中,侧切牙和第二前磨牙缺失率最高,为100%(18/18),而上颌中切牙缺失率最低,为11.11%(2/18),其次为上颌第一磨牙,缺失率为55.56%(10/18,图5A),上颌这四个牙位缺牙率对比平均缺牙率76.98%(194/252)差异均有统计学意义(P<0.05);(4)在下颌牙列中,侧切牙缺失率最高,为100%(18/18),而下颌第一磨牙缺失率最低,为55.56%(10/18)(图5B),下颌这两个牙位缺牙率对比平均缺牙率76.98%(194/252)差异均有统计学意义(P<0.05)。
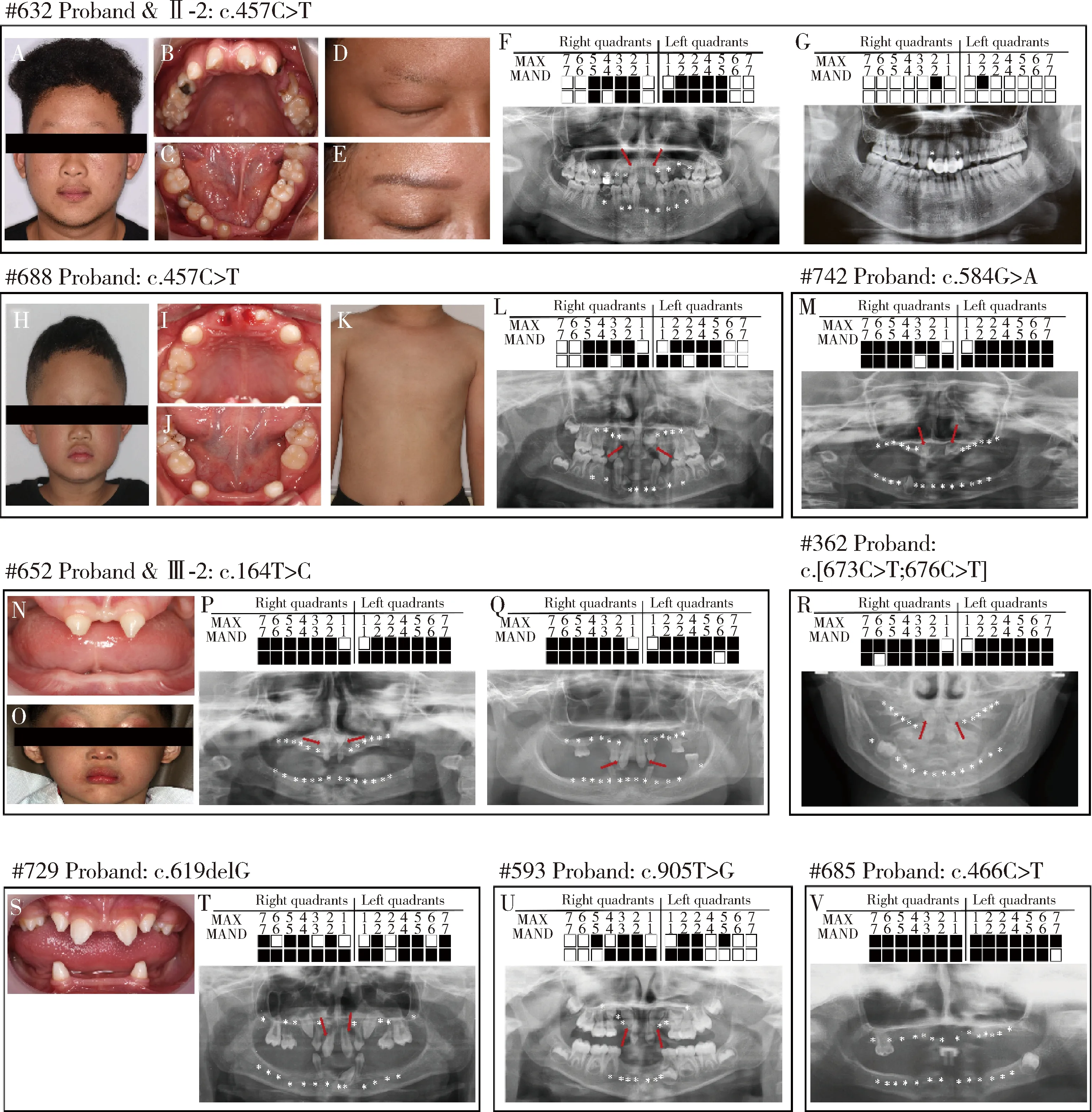
A, the face photograph of #632 proband; B-C, the intraoral photographs of #632 proband; D-E, the detailed photographs show sparse eyebrows of #632 proband and his mother; F-G, the panoramic radiographs of #632 proband and his mother; H, the face photograph of #688 proband; I-J, the intraoral photographs of #688 proband; K, the photograph shows absent nipple and areola of #688 proband; L-M, the panoramic radiographs of #688 proband and #742 proband; N, the intraoral photograph of #652 proband; O, the face photograph of #652 proband; P-Q, the panoramic radiographs of #652 proband and his cousin; R, the cephalometric radiograph of #362 proband; S, the intraoral photograph of #729 proband; T-V, the panoramic radiographs of #729 proband, #593 proband and #685 proband. The black block represents the missing tooth, the red arrow refers to the tapered tooth. MAX, maxillary dental arch; MAND, mandibular dental arch.
3 讨论
自1996年Srivastava等[8]成功克隆并定位EDA基因以来,不断有研究从遗传学和分子生物学的角度对EDA基因突变与HED相关性进行探索。目前已证实EDA基因突变可以导致X连锁遗传的HED的发生,其新检出的突变类型持续被报道。本研究在8个家系的9个男性HED患者中检测出8个EDA基因突变:c.164T>C(p.Leu55Pro)、c.457C>T(p.Arg153Cys)、c.466C>T(p.Arg156Cys)、c.584G>A(p.Gly195Glu)、c.619delG(p.Gly207Profs*73)、c.673C>T(p.Pro225Ser)、c.676C>T(p.Gln226*)以及c.905T>G(p.Phe302Cys),其中,c.619delG(p.Gly207Profs*73)、c.676C>T(p.Gln226*)、c.164T>C(p.Leu55Pro)、c.673C>T(p.Pro225Ser)和c.905T>G(p.Phe302Cys)是新检出的突变。检测出的8个突变中,有5个突变为C>T(G>A)突变,可能由细胞中常见的胞嘧啶自动脱氨基作用所致。
以上8个突变中,p.Leu55Pro 位于EDA蛋白的跨膜域内,由于该结构域与蛋白极性密切相关[17],因此我们推测该突变引起的跨膜结构改变,可能影响EDA的正常表达。研究发现EDA前体蛋白须在细胞膜上裂解并形成水溶性的信号分子后,方能与下游受体结合发挥作用,而furin识别序列结构域正是EDA前体蛋白发生裂解的识别位点[17],因此,位于furin识别序列结构域内的p.Arg153Cys和p.Arg156Cys,极有可能导致EDA前体蛋白裂解障碍,无法形成正常的水溶性的信号分子,进而影响其与下游受体的结合,妨碍EDA蛋白的正常功能[10];p.Gly195Glu、p.Gly207Profs*73、p.Pro225Ser和p.Gln226* 位于胶原样结构域内,该结构域主要是负责维持肿瘤坏死因子(tumor necrosis factor, TNF)结构域形成正常折叠构象,促进TNF结构域形成三聚体[17-18],该结构域内的移码突变p.Gly207Profs*73和无义突变p.Gln226*导致EDA蛋白截短,产生严重的功能影响。尽管功能预测结果表明,p.Pro225Ser为可能致病的突变,但先证者同一条X染色体同时携带错义突变 p.Pro225Ser和无义突变p.Gln226*,可能通过协同作用严重影响EDA蛋白的功能;p.Phe302Cys位于EDA蛋白的TNF结构域内,研究证明此高保守的结构域以同源三聚体的形式与受体EDAR结合,由此推测,p.Phe302Cys导致的TNF结构域的构象改变,可能影响EDA与EDAR的结合,进而导致下游核转录因子kappa-B(nuclear factor kappa-B, NF-κB)信号通路激活受阻[17, 19]。NF-κB信号通路参与胚胎发育早期的外胚间充质转化,决定着牙齿、毛发和皮肤等多种组织和器官的形态发生[20],因此,本研究所报道的EDA基因突变,为EDA-EDAR-NF-κB级联通路障碍在外胚层器官发育异常中的致病作用提供了新的理论证据。

A, location of EDA mutations identified in this study, reported mutations are in black, novel mutations are in red; B, schematic diagram of the EDA gene; C, conservation analysis of affected amino acids in the EDA protein among 8 different species. TM, transmembrane domain; TNF, tumor necrosis factor.
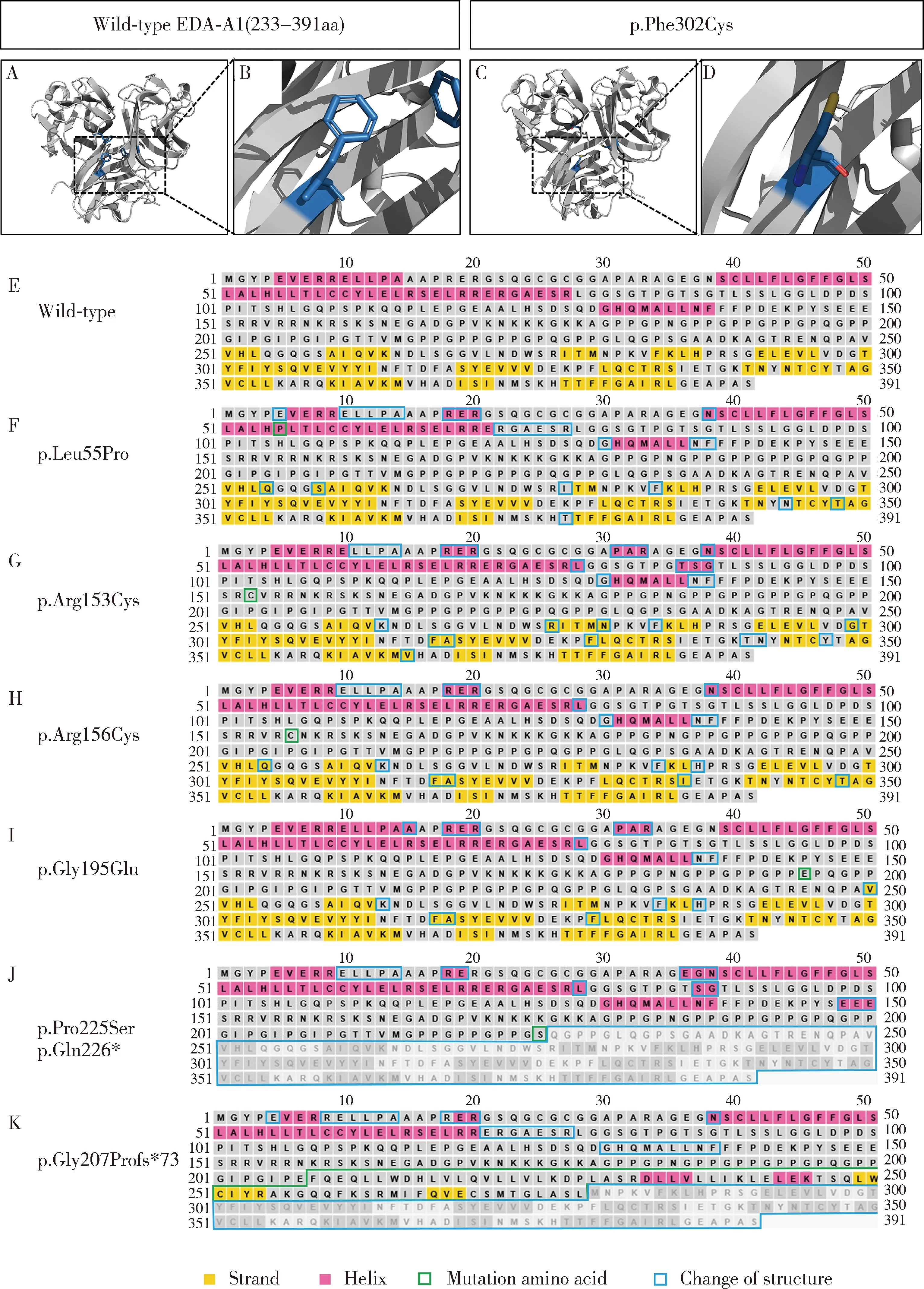
A-B, the tertiary structure of wild-type EDA-A1; C-D, the tertiary structure of the p.Phe302Cys mutant; E, the secondary structure of wild-type EDA protein; F-K, the secondary structure of the p.Leu55Pro, p.Arg153Cys, p.Arg156Cys, p.Gly195Glu, p.[pro225ser; Gln226*] and p.Gly207Profs*73 mutants.
本研究检测出的9例EDA基因突变的男性HED患者均表现为汗腺发育异常、毛发稀疏、牙齿发育不全的三联征。#688先证者除具有典型的HED表型外,还表现出乳头和乳晕的先天缺如,这一乳腺相关的严重表型在男性HED患者中尚未见报道。对HED疾病模型小鼠Tabby的相关研究发现,Tabby鼠表现出乳头小且平,乳腺分泌功能障碍[21]。同时,有学者曾对EDA基因杂合突变的女性携带者的胸部发育进行研究,发现39%的患者表现出乳头扁平,10%的患者出现多乳头症状,67%的患者存在哺乳功能障碍[22]。以上研究均显示,EDA基因对乳腺发育的调控具有重要的作用,因此,#688先证者的乳头和乳晕先天缺如的表型可能与EDA基因突变密切相关,有待后续研究进一步明确证实其致病机制。
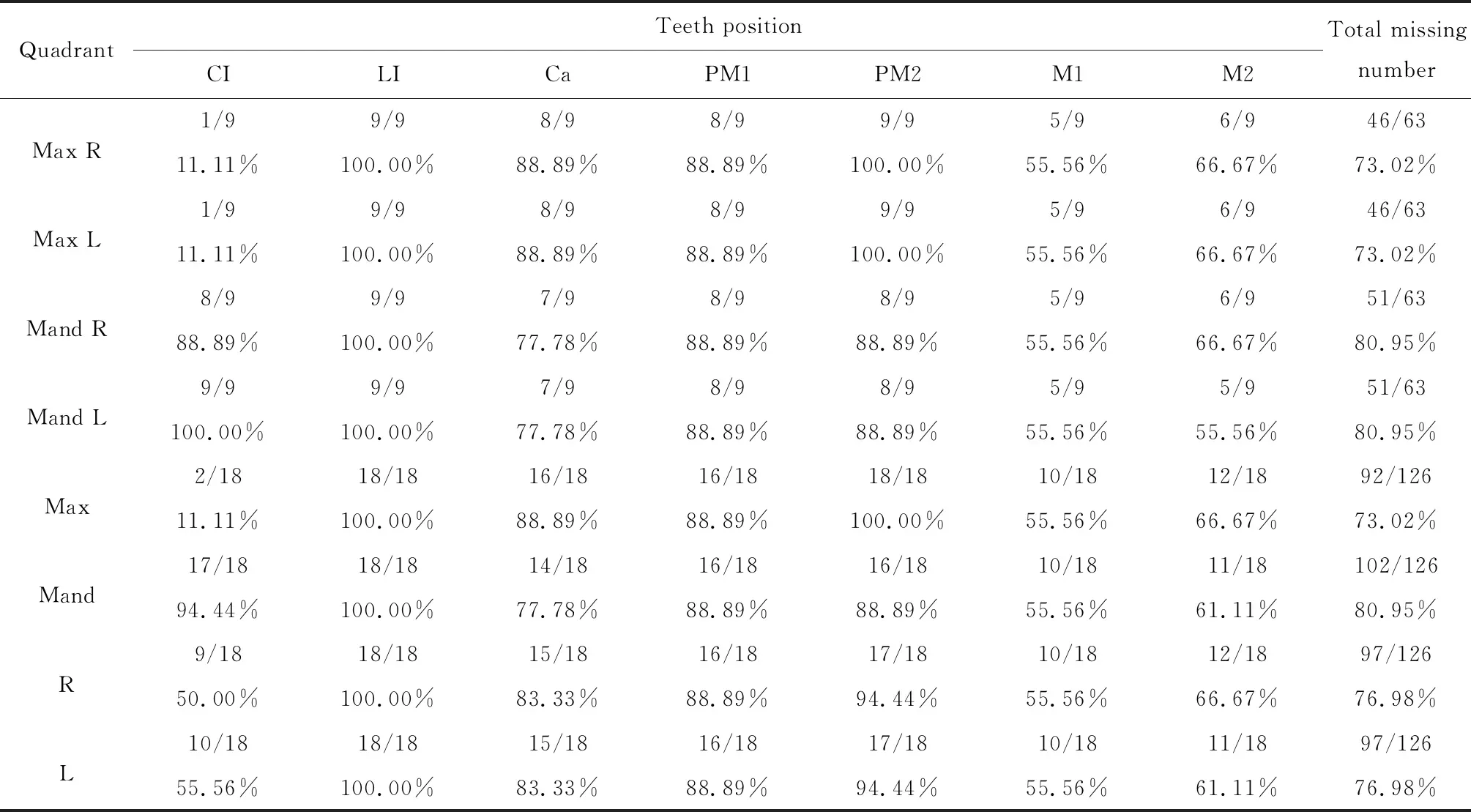
表2 EDA基因突变的HED患者缺牙数目和缺失牙位
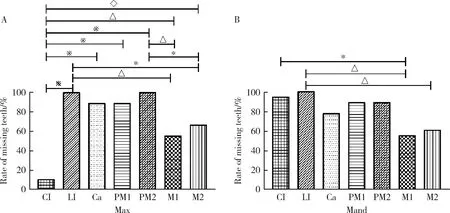
A and B, percentage of missing tooth positions at each maxillary and mandibular dentition in HED patients with EDA mutations. Max, maxillary; Mand, mandibular; CI, central incisor; LI, lateral incisor; Ca, canine; PM1, first premolar; PM2, second premolar; M1, first molar; M2, second molar. Statistical significant P-value is marked with *P< 0.05, △P < 0.01, ◇P < 0.001, and ※P < 0.000 1; HED, hypohidrotic ectodermal dysplasia.
值得关注的是,同一家系中携带相同致病突变的男性HED患者(#652先证者与其表兄)缺牙表型有所差异, #652先证者恒牙列仅余留2颗上颌中切牙,而其表兄恒牙列余留2颗上颌中切牙和1颗下颌磨牙。相同的致病突变,缺牙表型却存在差异,可能存在如下原因:(1)不同患者对相同的基因突变的敏感度有所差异,导致EDA基因突变在不同个体中的表现度不同,进而导致临床表型的轻重不一;(2)在遗传过程中,DNA甲基化、组蛋白修饰、基因组印记的变化都能造成临床表型不同的变化[23]。
本研究进一步汇总了这9例EDA基因突变的男性HED患者的恒牙牙位缺失情况,并归纳了缺失牙位的特点,研究发现上颌最易缺失牙位是侧切牙和第二前磨牙,下颌最易缺失牙位是侧切牙,这说明在牙胚发育过程中,上颌侧切牙、第二前磨牙和下颌侧切牙的牙胚对EDA基因的敏感性最高;而上颌中切牙、上颌第一磨牙和下颌第一磨牙较少发生缺失,说明上颌中切牙、上颌第一磨牙和下颌第一磨牙的牙胚发育对EDA基因的敏感性较低,这一结果与以往研究基本一致[24]。此外,本研究中EDA基因突变的男性HED患者的余留前牙呈锥形或过小牙。对Tabby鼠的研究也发现其前牙近远中径变小、呈锥形牙冠的形态[25],这均提示我们EDA基因可能与前牙形态发生有关,其具体发挥的功能及影响值得进一步研究。
综上,本研究在12个HED家系中共筛查出8例家系患者分别携带8个不同类型的EDA基因突变,其中5个突变为未曾报道的新检出的突变。有文献报道,约60%的HED患者携带EDA基因突变,未检出EDA基因突变的HED患者可能携带HED已知致病基因EDAR(HED患者中占比16%, 后同)、EDARADD(2%)、Wntfamilymember10A(WNT10A,16%)基因突变,还有8%的HED患者可能携带其他未知基因突变[26]。对缺牙表型的分析是研究牙发育相关基因功能的关键环节,也有利于临床医生预测先天缺牙患者可能的致病基因,从而有的放矢地进行遗传学检测。本研究通过分析得出EDA基因突变与上颌侧切牙、第二前磨牙和下颌侧切牙缺失的相关性最高,与上颌中切牙、上颌第一磨牙和下颌第一磨牙缺失的相关性最低,这不仅丰富了EDA的基因型-表型谱,更为遗传咨询和产前诊断提供了强有力的临床证据。

