大花序桉基因组SSR的分布特征及序列分析
邱炳发 梁馨元 王建忠 白天道 蒋维昕

摘要:【目的】分析大花序桉基因組SSR的分布特征及序列分析,为大规模开发大花序桉分子标记辅助育种的SSR标记提供理论依据。【方法】通过高通量测序获得大花序桉基因组序列信息,经严格过滤、拼接和组装后获得scaffolds,利用MISA网站对Scaffolds进行SSR位点检索及分析,并利用Primer 5.0对具有较大多态性开发潜力(二基元重复次数≥10、三基元重复次数≥7)的SSR标记进行引物设计,随机挑选48对基因组SSR引物进行有效性检测及有效扩增引物筛选。【结果】大花序桉基因组共含有177750个SSR位点,包括171530个SSR独立位点和6220个复合型SSR位点;SSR发生频率为17.86%,分布密度为1/3.13 kb。大花序桉基因组SSR基元类型较丰富,以单核苷酸重复基元类型数量最多,占基因组总SSR数量的69.33%,其次为二、三核苷酸重复基元类型,分别占基因组SSR数量的21.01%和7.58%,四、五、六核苷酸的重复基元类型所占比例均相对较低,三者的比例含量总和为2.08%。SSR基元类型以AG/CT占绝对优势(16812个),其次为AT/AT(8193个)和AAG/CTT(4404个)。从48对SSR标记引物中筛选出31对引物能有效扩增出清晰、明亮条带且大小与预期相符,其中有14对在6个大花序桉样本中均呈现多态性,多态百分率为29.17%。【结论】大花序桉基因组SSR位点发生频率高,基元类型较丰富,SSR多态性标记开发潜力大。该研究结果为进一步大花序桉SSR引物开发和筛选,以及开展大花序桉及其他桉树遗传多样性分析和遗传图谱构建提供依据。
关键词:大花序桉;基因组;SSR;重复基元;多态性
中图分类号:S792.39;S718.46 文献标志码: A 文章编号:2095-1191(2021)10-2744-07
Abstract:【Objective】 The distribution patterns and sequence characterstics of simple sequence repeat (SSR) in Eucalyptus cloeziana genome were analyzed in order to lay the foundation for developing SSR markers in molecular marker-assisted breeding of E. cloeziana. 【Method】 The genome sequence information of E. cloeziana was obtained based on high-throughput sequencing. Scaffold sequences were identified after rigorous filtration, splicing and assembly. The SSR loci from Scaffolds were searched and analyzed by using MicroSAtellite (MISA). Primer 5.0 software was used to design the SSR sequences with high potential for polymorphism development (the repetitions of dinucleotide ≥10, the repetitions of trinucleotides ≥7). Forty-eight genomic SSR primer pairs were randomly selected for validity detection and screening of primers successfully amplicated. 【Result】 The genome of E. cloeziana contained 177750 SSR loci, including 171530 single SSRs and 6220 compound-loci SSRs. The SSR occurrence frequency was 17.86% and the distribution density was 1/3.13 kb. There were abundant SSR motifs in E. cloeziana genome, and among them, the mononucleotide repeats were the most abundant types, accounting for 69.33% of the total genomic SSRs, followed by dinucleotide and trinucleotide repeats, accounting for 21.01% and 7.58%, respectively. The proportions of tetra-, penta- and hexa-nucleotide repeats were relatively low, and the total proportion of the three nucleotides was 2.08%. For the SSR motifs, AG/CT were the dominant primitive types (16812),followed by AT/AT (8193), AAG/CTT (4404). A total of 48 SSR marker pairs were randomly selected for initial screening test. Thirty-one primers pairs could effectively amplify clear and bright bands matching the expected size, and 14 of them showed polymorphism across six samples of E. cloeziana. The percentage of polymorphic loci was 29.17%. 【Conclusion】 The SSR loci in the genome of E. cloeziana occur in high frequency and abundant motifs, and exhibit great potential for developing polymorphic SSR markers. Therefore, the results provide a basis for further SSR development and screening,genetic diversity analysis and genetic mapping of E. cloeziana and other Eucalyptus trees.
Key words:Eucalyptus cloeziana; genome; SSR; repeat motif; polymorphism
Foundation item: Key Research and Development Project of Guangxi(2018AB44025); Guangxi Forestry Science and Technology Project (Guilinkezi 〔2016〕 2);Science Research Foundation of Guangxi University (20180493)
0 引言
【研究意义】大花序桉(Eucalyptus cloeziana F. Muell)为桃金娘科(Myrtaceae)桉属(Eucalyptus)昆士兰桉亚属的大型乔木,天然分布于海拔25~ 950 m的澳大利亚昆士兰州中和北部区域(144°44′~152°52′E,15°45′~26°41′S)(祁述雄,2002)。该树种材干通直、木材硬度高、尖削度低,自然整枝良好,木材的花纹美观,纹理和结构均匀,耐久性沉重,锯材性能优良,是一种用于制作高档实木家具的优良材料,且在轮伐期具有较强的木材生长潜力和材质特性,成熟阶段材积生长显著(祁述雄,2002;李昌荣等,2012),其经济价值远高于短轮伐期的普通桉树,目前已被纳入我国珍贵用材树种之一(黄振等,2018)。利用高通量测序技术平台获得大花序桉全基因组数据,挖掘其SSR位点,分析其分布特征,并开发SSR引物,对大花序桉遗传结构分析、指纹图谱构建、分子标记辅助选育等均具有重要意义。【前人研究进展】合理选择遗传标记是群体遗传学及分子标记辅助育种研究的重要保证。SSR标记为共显性标记,具有扩增稳定、数量丰富、多态性高及特异性强等优势,广泛应用于桉树遗传多样性评价、无性系指纹图谱构建、遗传作图、物种鉴定、亲本指派及QTLs定位等研究(Kirst et al.,2005;Shepherd and Raymond,2010;Subashini et al.,2014;Lv et al.,2020)。基于基因组开发的SSR(gSSR)标记相对转录组开发的SSR(EST-SSR)具有较高的多态性(Liu et al.,2018)。gSSR为中性标记,与任何特定的性状均无关联,但最能反映出一个野生种群所潜在的全部遗传多样性(Zonneveld et al.,2012)。不同桉树基因组中SSR分布特征有所不同,对NCBI、FORESTS等公共数据库内蓝桉(E. globulus)、尾叶桉(E. urophylla)和巨桉(E. grandis)等重要桉树的基因组或转录组SSR序列分析结果表明,桉树SSR发生频率通常为12.3%~25.5%,以AG/TC和CCG/GGC分别为二、三基元重复优势类型(Ceresini et al.,2005; Yasodha et al.,2008;Sumathi and Yasodha,2014;Liu et al.,2018);而在苹果桉(E. gunnii)(Rengel et al.,2009)和赤桉(E. camaldulensis)(Hirakawa et al.,2011)的基因组SSR三基元类型中,则以AAG/CTT最为丰富。部分学者也利用NCBI数据库开发出大量桉树SSR标记,但这些SSR标记在大花序桉中表现出较低的通用率(Nevill et al.,2008; Zhou et al.,2014)。近年来,研究人员基于巨桉、赤桉、尾叶桉等重要近源桉树开发的SSR标记开展了大花序桉遗传变异的研究(邓紫宇等,2019;Lv et al.,2020)。【本研究切入点】根据已有的桉属树种系统进化分析结果表明,大花序桉与同属其他桉树存在较远的亲缘关系,为独立的亚属分支(Steane et al.,2011),因而针对该树种的基因组或转录组进行SSR标记研究将有助于进一步探究其分子遗传学特性。但迄今為止,鲜见大花序桉SSR分布特征及标记开发的研究报道。【拟解决的关键问题】通过高通量测序获得大花序桉基因组序列信息,经严格过滤、拼接和组装后获得scaffolds,利用MISA网站对Scaffolds进行SSR位点检索及分析,并利用Primer 5.0对具有较大多态性开发潜力(二基元重复次数≥10、三基元重复次数≥7)的SSR序列进行引物设计,随机挑选48对基因组SSR引物进行有效性检测及有效扩增引物筛选,以期开发大花序桉SSR标记,为大花序桉种质资源鉴定、遗传多样性及分子标记辅助育种打下基础。
1 材料与方法
1. 1 试验材料
高通量测序所用材料为2年生大花序桉顶芽,采集自广西崇左市扶绥县国有东门林场大花序桉种源试验林基地(107°14′108.00″E,22°17′22.30″N)。样品采集后迅速投入液氮速冻保存,由上海欧易生物医学科技有限公司提取其基因组DNA并建库,通过Illumina HiSeq X Ten高通量测序平台进行双端测序。后续SSR引物扩增所用样本为6株大花序桉新鲜叶片,随机采自广西东门林场以实生苗营造的3年生大花序桉子代试验林。该试验林种子来自澳大利亚昆士兰州的大花序桉天然母树林。采集后于干冰保存带回实验室-80 ℃保存。基因组DNA快速提取试剂盒及PCR Mix均购自北京擎科新业生物技术有限公司。
1. 2 基因组SSR标记开发及引物设计
采用Trimmomati对高通量测序的原始数据进行严格过滤和质量评估(Bolger et al.,2014),获得高质量的clean reads,将clean reads之间重叠区域拼接形成contigs,再根据序列信息将contigs组装成更长的scaffolds(Xie et al.,2014)。基于MISA(http://pgrc. ipk-gatersleben.de/misa/)网站对大花序桉全部scaffolds进行SSR位点检索及分析。SSR搜索参数设置标准如下:重复基元1~6 bp,分别代表单核苷酸~六核苷酸,各核苷酸类型最小重复次数分别为10、6、5、5、5和5次,复合型SSR的检索条件是2个SSR片段间的距离低于100 bp。利用Primer 5.0对含有SSR且位点上、下游序列≥100 bp 的二基元(重复次数≥10次)、三基元(重复次数≥7次)核苷酸重复序列进行引物批量设计。参数设置为:SSR引物长度为18~22 bp;退火温度(Tm)为58~62 ℃,且上、下游引物相差的退火温度<2 ℃;PCR产物片段长度为100~350 bp,G+C含量为50%~55%;避免引物二级结构。
1. 3 PCR扩增及SSR引物有效性验证
随机挑选48对基因组SSR引物,由生工生物工程(上海)股份有限公司合成。利用基因组DNA快速提取试剂盒提取6株大花序桉新鲜叶片的基因组DNA,以其为模板进行PCR扩增。反应体系10.0 μL:10×Buffer 1.0 μL,dNTPs终浓度200 μmol/L,正、反向引物终浓度0.40 μmol/L,Taq DNA聚合酶1 U,DNA模板5 ng,ddH2O定容至10.0 μL。扩增程序:95 ℃预变性6 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,进行35个循环;72 ℃延伸 5 min,最后4 ℃保存。扩增产物采用8%非变性聚丙烯酰胺凝胶电泳分离,银染显色,拍照保存,统计其中能够稳定扩增、条带明亮且符合预期目的片段大小。
2 结果与分析
2. 1 大花序桉基因组SSR的重复基元类型
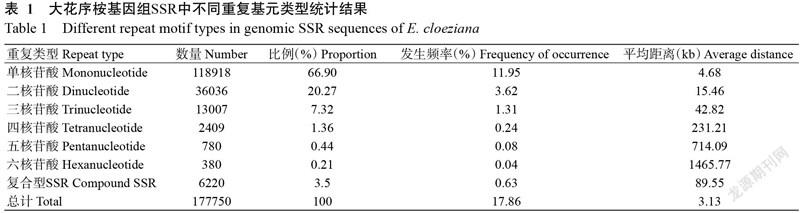
对大花序桉进行基因组测序,经拼接、组装后获得995093条Scaffolds,总长度556992 kb。通过MISA网站对全部Scaffolds进行SSR位点检索,共获得177750个SSR位点,包括171530个SSR独立位点和6220个复合型SSR位点(表1)。由表1可知,大花序桉基因组SSR发生频率为17.86%,SSR位点分布密度为1/3.13 kb;大花序桉基因组重复基元类型较丰富,以单核苷酸的重复基元类型数量最多,分别占基因组SSR数量69.33%(118918个SSR位点),其次为二、三核苷酸的重复基元类型,占基因组SSR数量的21.01%(36036个SSR位点)和7.58%(13007个SSR位点);四、五、六核苷酸的重复基元类型所占比例均相对较低,三者的比例含量总和为2.08%(共3569个SSR位点)。总整来看,含SSR位点的序列数量随核苷酸基元碱基数的增加逐渐减小。
2. 2 大花序桉基因组SSR的重复基元碱基构成
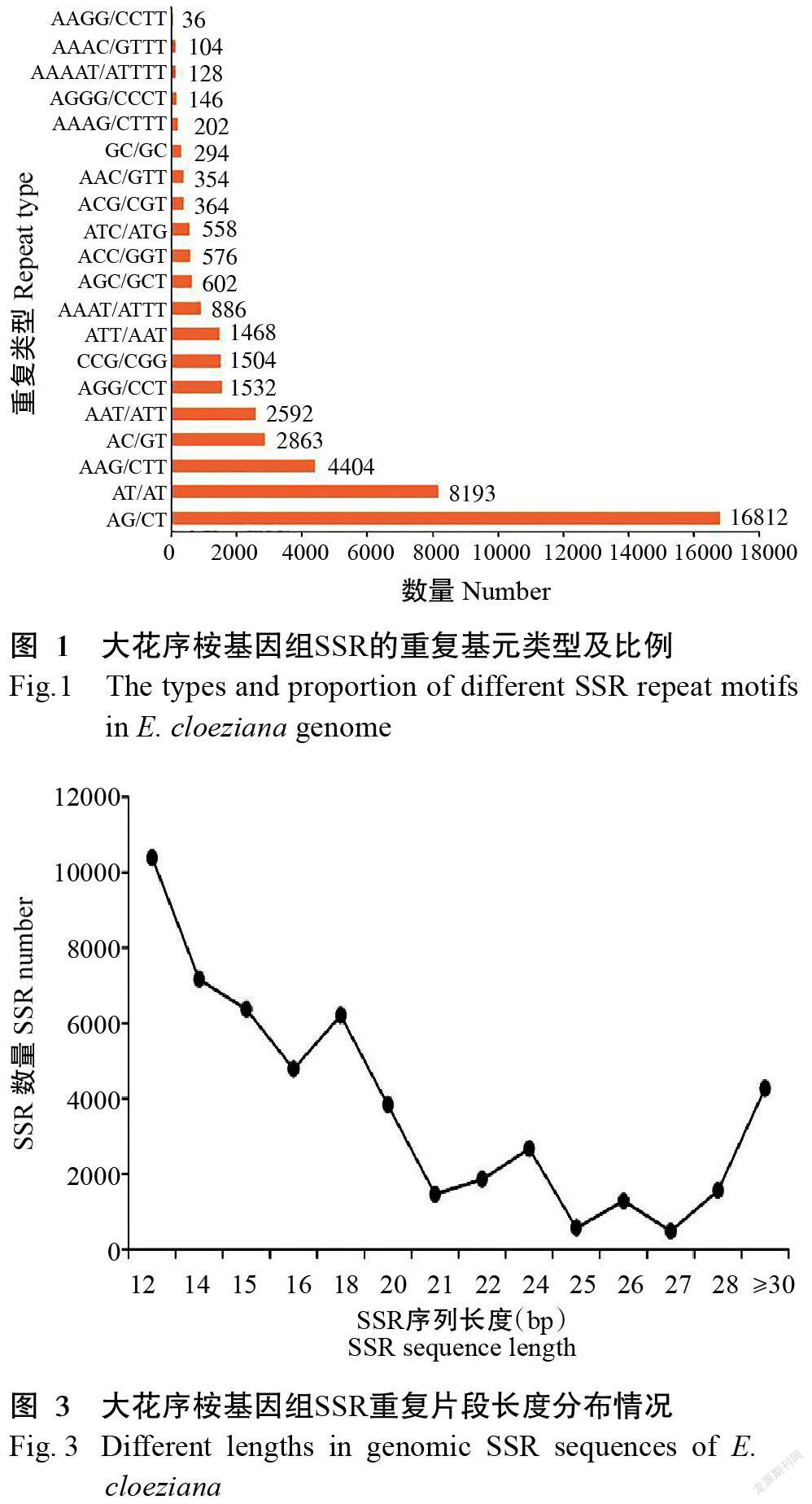
对大花序桉基因组中52612个二核苷酸~六核苷酸重复基元进一步分析,结果共发现138种重复基元类型,比例最高的20种类型SSR(图1)共计43618个(占82.91%)。在这些核苷酸重复类型中,二核苷酸基元重复类型中以AG/CT占绝对优势(共16812个,占31.95%),其次为AT/AT(共8193个,占15.57%)和AC/GT基元类型(共2863个,占5.44%);三核苷酸重复类型中则以AAG/CTT(共4404个,占8.37%)为优势重复基元类型,其次为AAT/ATT(4.93%)、AGG/CCT(2.91%)和CCG/CGG(2.86%)基元类型;大花序桉基因组SSR中四、五、六核苷酸重复基元虽然类型也较丰富,但占SSR位点总数的比例较低,且其中有76种基元类型仅出现1次。
2. 3 大花序桉基因组SSR基元重复次数分布
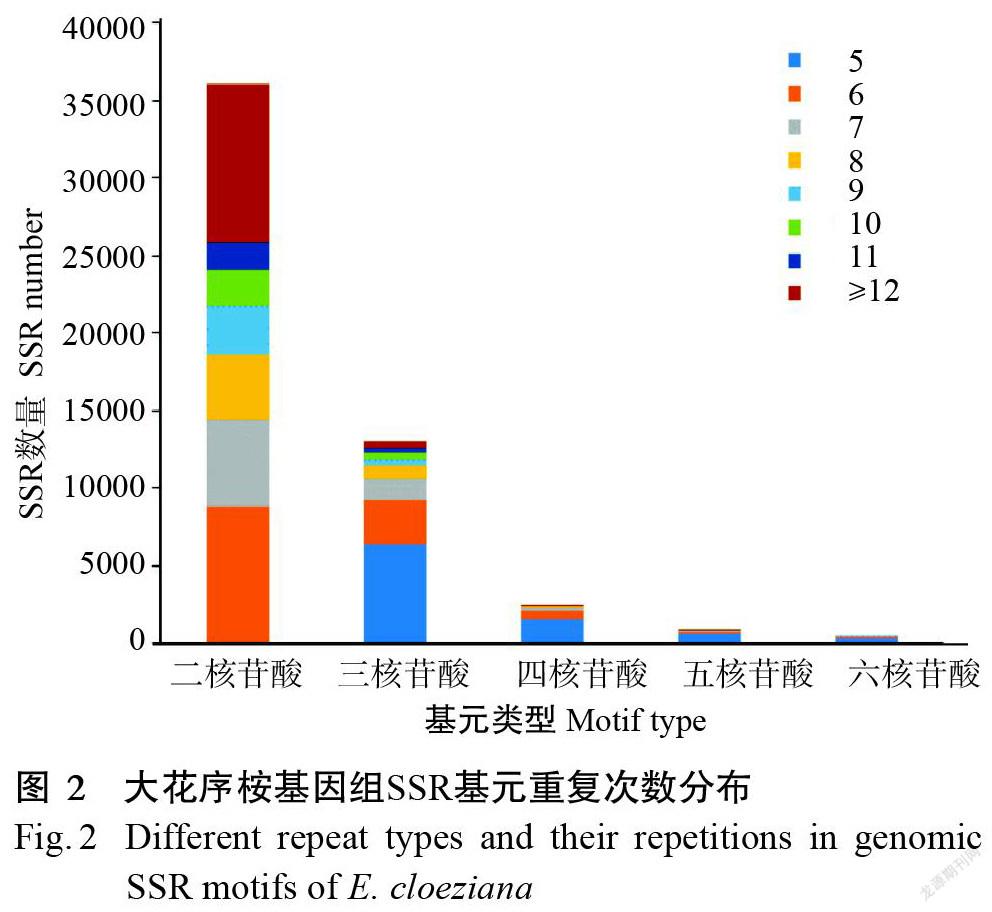
大花序桉基因组各类型核苷酸重复基元的数量和比例随着基元重复次数的增加而逐渐降低(图2)。除去单核苷酸类型,大花序桉基因组不同SSR类型重复次数主要集中于5~11次之间,占独立位点SSR总数的79.89%(表3);重复次数≥12的SSR位点以二核苷酸类型SSR为优势,占19.29%(10151个),其中,高重复次数(≥20次)的SSR位点数共983个。在大花序桉基因组所有类型SSR序列中,占比例最高的重复次数依次为6次、5次、7次和8次重复类型,分别为12333、8276、7382和5049个,各占SSR总数的23.44%、16.58%、14.03%和9.60%。
2. 4 大花序桉基因组SSR重复片段长度
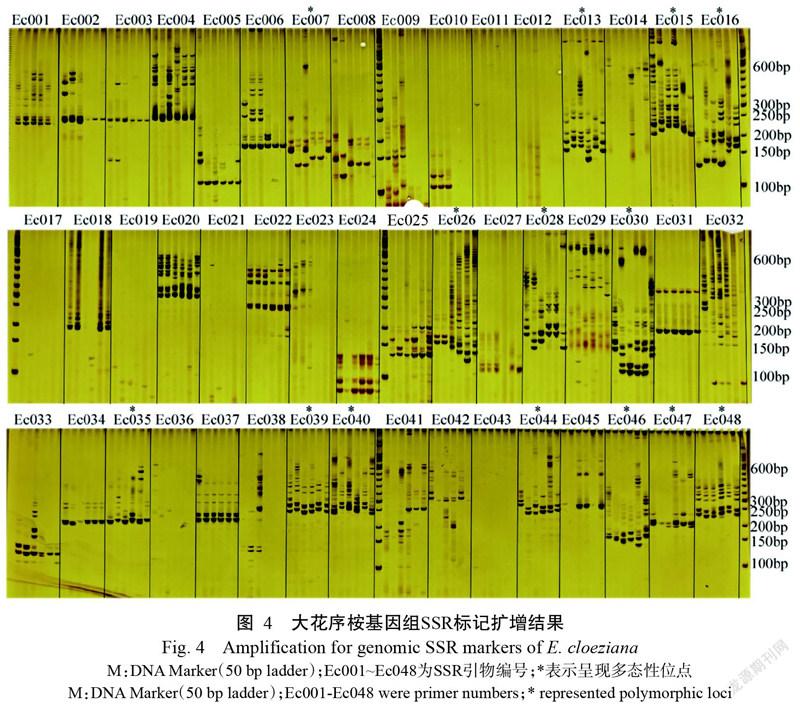
由于SSR序列长度≥20 bp时具有较高多态性,是理想的标记位点;序列长度在12~20 bp之间时标记多态性适中;<12 bp时SSR标记的多态性表现极低(Temnykh et al.,2001),因此本研究选取≥12 bp的二~六核苷酸重復基元作进一步片段长度分析,结果图3所示。大花序桉基因组SSR重复片段的长度变化规律和基元重复次数一致,SSR序列长度主要集中于12~20 bp,为38735个,占SSR总数的73.26%;分布于21~28 bp的SSR数量为9868个,占SSR总数的18.66%;≥30 bp以上的SSR数量为4265个,占SSR总数的8.07%。另外,大花序桉基因组SSR最长重复片段为三核苷酸类型ATT/AAT(102~111 bp),出现次数为7。总整来看,大花序桉SSR长度主要集中在中等多态性长度,具有较大的多态性标记开发潜力。
2. 5 大花序桉基因组SSR标记的扩增有效性检测结果
对大花序桉基因组中具有较大多态性开发潜力的10585个SSR标记进行引物设计,从中随机挑选48对SSR标记引物,以6株大花序桉新鲜叶片DNA为模板进行PCR扩增,并从中筛选扩增效果较好且符合预期大小的引物。由图4可知,有31对引物能有效扩增出清晰、明亮条带,且大小与预期相符(表2),其中有14对引物在6株大花序桉中扩增出多态性条带,多态百分率为29.17%,8对引物扩增效果不佳或扩增出非目的条带,9对引物未扩增出条带。结合表2还可知,未呈现多态性的SSR基元重复次数为7~33次;呈现多态性的SSR位点中,除复合型位点Ec015外,二基元类型占85.71%,重复次数为16~44次;三基元类型仅有一个SSR位点(即Ec007),重复次数为34次。
3 讨论
经本研究分析发现,大花序桉基因组177750个SSR位点,SSR分布密度为1/3.13 kb,发生频率为17.86%,高于赤桉(E. camaldulensis)的SSR分布密度(1/7.1 kb)(Hirakawa et al.,2011)以及基于NCBI数据库分析的巨桉(E. grandis)(11.8%)、苹果桉(E. gunnii)(4.6%)和细叶桉(E. tereticornis)(8.3%)EST-SSR发生频率(Yasodha et al.,2008),但低于基于FORESTs数据库分析的巨桉、赤桉、蓝桉等EST-SSR分布频率(25.6%和25.6%)(Ceresini et al.,2005;Rabello et al.,2005)。可见,不同树种基因组中SSR的分布特征存在较大的差异,相对于其他桉树,大花序桉基因组中SSR发生频率处于中等水平。Varshney等(2005)研究认为,SSR分布频度之所以出现差异,除了物种间差异因素外,还与测序数据深度、序列拼接数据质量及SSR位点查找软件以及SSR搜索标准不同有关。
單核苷酸、二核苷酸和三核苷酸重复基元是绝大多植物基因组SSR序列中优势重复类型(Biet et al.,1999)。本研究发现,大花桉基因组SSRs中,单、二和三核苷酸重复基元类型分别占基因组SSR数量的69.33%、21.01%和7.58%,且二核苷酸基元类型以AG/CT为优势重复基元(16812个,占31.95%),该结果和绝大部分植物中观测到的结果一致(Sumathi and Yasodha,2014)。而三核苷酸重复基元优势类型则因物种而异(Victoria et al.,2011)。本研究中,大花序桉SSR序列中三核苷酸重复类型占比从高至低依次为AAG/CTT(8.37%)、AAT/ATT(4.93%)、AGG/CCT(2.91%)和CCG/CGG(2.86%),与苹果桉(E. gunnii)(Rengel et al.,2009)和赤桉(E. camaldulensis)(Hirakawa et al.,2011)的基因组SSR三核苷酸重复类型中AAG/CTT为优势重复基元类型的结论一致。但蓝桉、尾叶桉、巨桉及细叶桉等桉树基因组SSR三核苷酸重复类型中CCG/GGC为优势重复基元类型(Ceresini et al.,2005;Yasodha et al.,2008;Sumathi and Yasodha,2014;Liu et al.,2018)。对于大花序桉而言,其根部转录组三核苷酸重复序列中CCG/GGC也为优势类型(朱林生等,2018)。上述基因组和转录组间的差异间接反映了三核苷酸重复类型SSR在桉树基因组上分布不随机。
研究表明,SSR基元重复次数越高,多态性标记的开发潜力越大,尤其当基元的重复次数≥12次或片段长度≥20 bp时多态信息含量(PIC)较高(Thao et al.,2013)。本研究对大花序桉基因组中具有较大多态性开发潜力的10585个SSR序列(二基元重复次数≥10、三基元重复次数≥7)进行引物设计,从中随机挑选48对基因组SSR标记引物进行初筛选,结果发现有31对引物能有效扩增,其中有14对引物在6株大花序桉中均呈现多态性。进一步将多态与非多态SSR位点基元重复次数进行比较,结果发现重复次数最高的SSR并非一定表现出多态性,但从占比最高的二基元类型分析,SSR长度≤30 bp(或重复次数小于16次)的位点多态性表现极低。本研究得出,大花序桉基因组SSR引物的多态百分率为29.17%,与E. victrix(33.33%)(Nevill et al.,2013)和E. gomphocephala(25%)(Bradbury et al.,2013)的多态百分率相近,但远低于赤桉(E. camaldulensis)(56%)(Silva et al.,2009)的多态百分率。今后应对大花序桉群体的多态信息含量(PIC)、观察等位基因数(Na)、有效等位基因数(Ne)、期望杂合度(He)和观察杂合度(Ho)进行深入研究,为群体遗传学分析和分子标记辅助育种打下理论基础。
4 结论
花序桉基因组SSR位点发生频率高,基元类型较丰富,SSR多态性标记开发潜力大。该研究结果为大花序桉SSR引物开发和筛选,以及开展大花序桉及其他桉树遗传多样性分析和遗传图谱构建提供依据。
参考文献:
邓紫宇,陈健波,郭东强,李昌荣,卢翠香. 2019. 大花序桉的遗传多样性分析[J]. 林业科学研究,32(4):41-46. [Deng Z Y,Chen J B,Guo D Q,Li C R,Lu C X. 2019. Genetic diversity of Eucalyptus cloeziana[J]. Forest Research,32(4):41-46.] doi:10.13275/j.cnki.lykxyj.2019. 04.006.
黄振,张俊,陈炙,王丽华,郭洪英. 2018. 大花序桉国内遗传育种现状与研究展望[J]. 四川林业科技,39(1):17-21. [Huang Z,Zhang J,Chen Z,Wang L H,Guo H Y. 2018. Development and prospects of heredity and breeding researches on Eucalyptus cloeziana[J]. Journal of Sichuan Forestry Science & Technology,39(1):17-21.] doi:10. 16779/j.cnki.1003-5508.2018.01.004.
李昌荣,项东云,陈健波,翟新翠,阚荣飞,兰俊. 2012. 大花序桉木材基本密度的变异研究[J]. 中南林业科技大学学报,32(6):158-162. [Li C R,Xiang D Y,Chen J B,Zhai X C,Kan R F,Lan J. 2012. Study on wood basic density variation of Eucalyptus cloziana[J]. Journal of Central South University of Forestry & Technology,32(6):158-162.] doi:10.14067/j.cnki.1673-923x.2012. 06.010.
祁述雄. 2002. 中国桉树[M]. 北京:中国林业出版社. [Qi S X. 2002. Eucalyptus in China[M]. Beijing:Chinese Fore-stry Press.]
朱林生,刘果,何沙娥,李慧,刘学锋,陈少雄. 2018. 基于Illumina HiSeq 2000 测序技术对大花序桉根的转录组特性分析[J]. 分子植物育种,16(13):4245-4254. [Zhu L S,Liu G,He S E,Li H,Liu X F,Chen S X. 2018. Transcriptome characterization analysis of Eucalyptus cloeziana root based on Illumina HiSeq 2000 sequencing technology[J]. Molecular Plant Breeding,16(13):4245-4254.] doi:10.13271/j.mpb.016.004245.
Biet E,Sun J,Dutreix M. 1999. Conserved sequence preferen-ce in DNA binding among recombination proteins:An effect of ssDNA secondary structure[J]. Nucleic Acids Research,27(2):596-600. doi:10.1093/nar/27.2.596.
Bolger A,Lohse M,Usadel B. 2014. Trimmomatic:A flexible trimmer for Illumina sequence data[J]. Bioinformatics(Oxford,England),30(15):2114-2120.
Bradbury D,Smithson A,Krauss S L. 2013. Development and testing of new gene-homologous EST-SSRs for Eucalyptus gomphocephala (Myrtaceae)[J]. Applications in Plant Sciences,1(8):e1300004. doi:10.3732/apps.1300004.
Ceresini P C,Silva C L S P,Missio R F,Souzi E C,Fischer C N,Guillherme I R,Gregorio I,Silva E H T D,Cicarelli R M B,Silva M T A D,Garcia J F,Avelar G A,Neto L R P,Marçon A R,Junior M B,Marini D C. 2005. Satellyptus:Analysis and database of microsatellites from ESTs of Eucalyptus[J]. Genetics and Molecular Biology,28(3):589-600. doi:10.1590/S1415-47572005000400014.
Hirakawa H,Nakamura Y,Kaneko T,Isobe S,Sakai H,Kato T,Hibino T,Sasamoto S,Watanabe A,Yamada M,Nakayama S,Fujishiro T,Kishida Y,Kohara M,Tabata S,Sato S. 2011. Survey of the genetic information carried in the genome of Eucalyptus camaldulensis[J]. Plant Biotechnology,28(5):471-480. doi:10.5511/plantbiotechnology.11.1027b.
Kirst M,Cordeiro C M,Rezende G D S P,Grattapaglia D. 2005. Power of microsatellite markers for fingerprinting and parentage analysis in Eucalyptus grandis breeding populations[J]. Journal of Heredity,2:161-166. doi:10. 1093/jhered/esi023.
Liu G,Xie Y J,Zhang D Q,Chen H P. 2018. Analysis of SSR loci and development of SSR primers in Eucalyptus[J]. Journal of Forestry Research,29(2):273-282. doi:10.1007/s11676-017-0434-3.
LV J P,Li C R,Zhou C P,Chen J B,Lia F G,Weng Q J,Li M,Wang Y Q,Chen S K,Chen J C,Gan S M. 2020. Genetic diversity analysis of a breeding population of Eucalyptus cloeziana F. Muell. (Myrtaceae) and extraction of a core germplasm collection using microsatellite markers[J]. Industrial Crops and Products,145:e112157. doi:10.1016/j.indcrop.2020.112157.
Nevill P G,Bradbury D,Jørgensen T,Krauss S,Samaraweera S,Gardner M G. 2013. Microsatellite primers identified by 454 sequencing in the floodplain tree species Eucalyptus victrix(Myrtaceae)[J]. Applications in Plant Sciences,1(5):e1200402. doi:10.3732/apps.1200402.
Nevill P,Reed A,Bossinger G,Vaillancourt R E,Larcombe M,Ades P. 2008. Cross-species amplification of Eucalyptus microsatellite loci[J]. Molecular Ecology Resources,8:1277-1280. doi:10.1111/j.1755-0998.2008.02362.x.
Rabello E,Souza A N D,Saito D,Tsai S M. 2005. In silico characterization of microsatellites in Eucalyptus spp.:Abundance,length variation and transposon associations[J]. Genetics & Molecular Biology,28(3):582-588. doi:10.1590/S1415-47572005000400013.
Rengel D,San Clemente H,Servant F,Ladouce N,Paux E,Wincker P,Couloux A,Sivadon P,Grima-Pettenati J. 2009. A new genomic resource dedicated to wood formation in Eucalyptus[J]. BMC Plant Biology,9:36-36. doi:10.1186/1471-2229-9-36.
Shepherd M,Raymond C. 2010. Species differentiation and gene flow in the Blackbutts (genus Eucalyptus subgenus Eucalyptus section Pseudophloius)[J]. Conservation Genetics,11(5):1965-1978. doi:10.1007/s10592-010-0086-8.
Silva J M D,Sousa A C B D,Souza A P D,Mori E S,Freitas M L M,Sebbenn A M,Moraes M L T D. 2009. Development and characterization of 14 microsatellite loci from an enriched genomic library of Eucalyptus camaldulensis Dehnh[J]. Conservation Genetics Resources,1(1):465-469. doi:10.1007/s12686-009-9107-7.
Steane D A,Nicolle D,Sansaloni C P. 2011. Population gene-tic analysis and phylogeny reconstruction in Eucalyptus (Myrtaceae) using high-throughput,genome-wide genotyping[J]. Molecular Phylogenetics & Evolution,59(1):206-224. doi:10.1016/j.ympev.2011.02.003.
Subashini V,Shanmugapriya A,Yasodha R. 2014. Hybrid purity assessment in Eucalyptus F1 h ybrids using microsatellite markers[J]. Biotech,4(4):e367. doi:10.1007/s13205-0130161-1.
Sumathi M,Yasodha R. 2014. Microsatellite resources of Eucalyptus:Current status and future perspectives[J]. Botani-cal Studies,55(1):e73. doi:10.1186/s40529-014-0073-3.
Temnykh S,Declerck G,Lukashova A,Lipovich L,Cartinhour S,Mccouch S. 2001. Computational and experimental analysis of microsatellites in rice(Oryza sativa L.):Frequency,length variation,transposon associations,and genetic marker potential[J]. Genome Research,11(8):1441-1452. doi:10.1016/j.ces.2004.03.045.
Thao D V,Yamashita M,Watanabe A,Shiraishi S. 2013. Development of tetranucleotide microsatellite markers in Pinus kesiya Royle ex Gordon[J]. Conservation Genetics Resources, 5(2):405-407. doi:10.1007/s12686-012-9814-3.
Varshney R K,Graner A,Sorrells M E. 2005. Genic microsatellite markers in plants:Features and applications[J]. Trends in Biotechnology,23(1):48-55. doi:10.1016/j.tibtech. 2004.11.005.
Victoria F C,Da Maia L C,De Oliveira A C. 2011. In silico comparative analysis of SSR markers in plants[J]. BMC Plant Biology,11:e15. doi:10.1186/1471-2229-11-15.
Xie Y L,Wu G X,Tang J,Luo R B,Patterson J,Liu S L,Huang W H,He G,Gu S Z,Li S K,Zhou X,Lam T W,Li Y R,Xu X,Wong G K S,Wang J. 2014. SOAPdenovo-Trans:De novo transcriptome assembly with short RNA-Seq reads[J]. Bioinformatics,30(12):1660-1666.
Yasodha R,Sumathi R,Chezhian P,Kavitha S,Ghosh M. 2008. Eucalyptus microsatellites mined in silico:Survey and evaluation[J]. Journal of Genetics,87(1):21-25. doi: 10.1093/bioinformatics/btu077.
Zhou C P,He X D,Li F G,Weng Q J,Yu X L,Wang Y,Li M,Shi J S,Gan S. 2014. Development of 240 novel EST-SSRs in Eucalyptus L’Hérit[J]. Molecular Breeding,33(1):221-225. doi:10.1007/s11032-013-9923-z.
Zonneveld M V,Scheldeman X,Escribano P,Viruel M A,Damme P V,Garcia W,Tapia C,Romero J,Sigueñas M,Hormaza J I. 2012. Mapping genetic diversity of cherimoya(Annona cherimola Mill.):Application of spatial analysis for conservation and use of plant genetic resources[J]. PLoS One,7(1):e29845. doi:10.1371/journal.pone. 0029845.
(責任编辑 陈 燕)

