负载山奈酚的小麦醇溶蛋白纳米颗粒的制备及其抗氧化活性研究
(刘亚男 郝柏妹 许为东 杨 丽 周 伟
(合肥工业大学食品与生物工程学院,合肥 230009)
近年来,从植物中提取的不同活性成分被用作创新的药物载体。基于蛋白质的纳米载体作为药物载体已经受到较多关注,纳米技术研究的发展在药物输送等制药科学领域上具有良好的应用前景。与合成蛋白相比,蛋白质作为天然材料具有较好的生物相容性和生物降解性等优势[1],因此其在材料科学和生物医学领域具有广阔的应用前景。
山奈酚(KAE)是一种天然黄酮类药物,存在于葡萄、洋葱和柑橘类水果中[2]。具有广泛的抗炎[3]、抗癌[4]、抗氧化[5]等优势,但是因其水溶性差,所以难以实现临床上的应用。研究表明,黄酮类化合物有限的水溶性和溶解度会影响其化学稳定性和生物利用度[6]。而纳米载体可以帮助改善KAE的溶解性和生物利用度[7],聚合物纳米颗粒具有许多优点,其中就包括提高生物利用度和有效输送疏水性化合物[8]。
麦醇溶蛋白是一种天然蛋白质,占小麦总蛋白的40%~50%,其通过分子内二硫键连接的单链多肽组成,每条多肽链的平均分子量为25~100 ku[9]。然而,由于小麦醇溶蛋白纳米颗粒之间相对较强的疏水性而使其在有些溶液中趋于聚集。为了使其稳定,必须仔细控制溶液的pH值和离子强度,以产生强静电排斥力[10]。已有研究表明,可以通过在小麦醇溶蛋白纳米颗粒上覆盖带电荷的生物聚合物,例如壳聚糖[11]、卵磷脂[12]、果胶[13]。因此,本研究通过反溶剂法制备山奈酚-小麦醇溶蛋白纳米颗粒(KAE-GNPs),考察其纳米粒子的稳定性、生物相容性和抗氧化活性,为解决难溶性药物的应用提供了新思路。
1 材料与方法
1.1 实验材料
谷朊粉;山奈酚,纯度≥98%;透析袋(截流量14 000 ku);新鲜兔血;DPPH,纯度为96%;DMEM培养基;胎牛血清;青霉素、链霉素双抗;乙醇、盐酸、氢氧化钠、葡萄糖、甘露醇等均为分析纯。
1.2 仪器与设备
Nano ZS90纳米粒度仪,Zeta电位仪,SU8000场发射扫描电子显微镜,Nicolet iS5傅里叶红外光谱仪,HERAcell 150i CO2细胞培养箱,IX71倒置相差显微镜,ELx800酶标仪。
1.3 山奈酚-小麦醇溶蛋白纳米颗粒制备
1.3.1 小麦醇溶蛋白提纯
取一定量的谷朊粉,加入10倍量的二氯甲烷,搅拌1 h脱脂处理。脱脂后的谷朊粉加入10倍量的70 %乙醇,搅拌4 h后以10 000 r/min的速度离心10 min取上清液,旋蒸去除乙醇。将体系液置于透析袋中,投入蒸馏水中透析去除剩下的乙醇,再投入至0.05 mol/L稀醋酸溶液中透析24 h,除去部分酸溶性的低分子量谷蛋白,之后用去离子水透析至中性,分装冻干备用。
1.3.2 山奈酚-小麦醇溶蛋白纳米颗粒的制备
根据王昶光[14]的研究,采用反溶剂法制备KAE-GNPs。将山奈酚与小麦醇溶蛋白分别按1∶5、1∶10、1∶20、1∶40的比例加入至体积分数70%乙醇中,超声助溶。随后将混合液缓慢滴加至pH 6的去离子水中,滴毕后继续搅拌5 min,旋蒸去除乙醇后得到的KAE-GNPs悬液以20 000 r/min的速度离心10 min去除上清液,加入5 mL质量分数3%葡萄糖和2%甘露醇作为冻干剂支架,冻干备用。在不加入山奈酚的情况下重复上述操作得到空载的小麦醇溶蛋白纳米颗粒(GNPs)。
1.4 材料表征
1.4.1 纳米粒子的粒径、电位及PDI的测定
取1.5 mL纳米粒子分散液放入样品池中,使用马尔文粒径仪测定其粒径、电位及PDI。
1.4.2 KAE-GNPs的包埋率及载药率
配制不同浓度的山奈酚溶液,使用紫外可见分光光度计在370 nm的波长下检测其吸收值,绘制成标准浓度曲线(y=0.076 6x+0.046 6,R2=0.999)。
将KAE-GNPs悬液以20 000 r/min的转速下离心20 min,使用紫外分光光度计在370 nm的波长下检测上清液中山奈酚的含量。根据标准浓度曲线计算出游离山奈酚质量。
称取一定质量的KAE-GNPs溶于70%乙醇中,使用紫外可见分光光度计在370 nm的波长下检测溶液中山奈酚的含量,根据标准浓度曲线计算出山奈酚质量。根据公式计算包埋率与载药率:


1.4.3 傅里叶红外光谱(FTIR)分析
将2.0 mg冻干样品放置于红外光谱仪指定位置直接扫描,光谱采集范围为500~4 000 cm-1,分辨率设置为4 cm-1。
1.4.4 场发射扫描电子显微镜(FE-SEM)分析
将冷冻干燥后的样品均匀地粘在导电胶上,在其表面溅射涂覆一层金层,然后在5.0 kV加速电压下用FE-SEM观察样品。
1.5 稳定性实验
取冻干后的KAE-GNPs分散于去离子水中,配制为1 mg/mL的分散液,置于常温下保存,定期检测粒径变化。
1.6 血液相容性实验
按照梯度浓度(200、400、600、800、1 000 μg/mL)将KAE-GNPs与新鲜兔血孵育4 h后,使用紫外分光光度计在541 nm处测其吸收值。
1.7 抗氧化活性实验
将KAE-GNPs(100、300、500 μg/mL)和KAE(5.4、16.2、27 μg/mL)溶液按浓度梯度与DPPH溶液混合,静置30 min后测定其在519 nm处吸收值,记A1。阴性对照组记A0。根据公式计算自由基清除率:
1.8 细胞实验
1.8.1 细胞培养
人脐静脉内皮细胞(HUVEC)培养于5% CO2,37 ℃的二氧化碳培养箱中,培养基使用含10%胎牛血清、1%青霉素和链霉素的DMEM培养基。细胞密度达到80%~90%时,按1∶3进行传代培养,取对数生长期、生长状态良好的细胞用于实验。
1.8.2 MTT测试
取对数生长期中HUVEC,以每孔5×103个细胞的密度接种于96孔板,在CO2培养箱中培养至贴壁。其中,空白组组加入100 μL培养基,处理组每孔加入100 μL 的KAE-GNPs(100、300、500 μg/mL)和KAE溶液(5.4、16.2、27 μg/mL),孵育24 h后每孔加入10 μL MTT,继续孵育4 h,去除培养基后,每孔加入150 μL DMSO,在酶标仪490 nm波长下测定吸光值。按照公式计算细胞存活率。

1.8.3 清除细胞内活性氧(ROS)实验
取对数生长期中HUVEC,以每孔5×104个细胞的密度接种于24孔板中,放置于CO2培养箱中孵育24 h至细胞贴壁。将GNPs(500 μg/mL)、KAE(27 μg/mL)、KAE-GNPs(500 μg/mL)与H2O2共同孵育细胞1 h后,用PBS洗涤3次。加入10 μmol/L DCFH-DA荧光探针孵育30 min,用PBS洗涤3次,在荧光显微镜下成像。使用ImageJ对荧光图进行荧光定量分析,计算相对荧光强度:
1.9 数据分析
所有实验均重复3次,结果以平均值±标准差(SD)表示,应用Origin和Prism 8.0进行数据分析,组间差异采用单因素方差分析比较。
2 结果与讨论
2.1 不同投药比对纳米粒子的影响
如图1所示,KAE-GNPs的平均粒径随投药比的增大而增大。纳米粒子的粒径控制着其在体内的分布,不同投药比的平均粒径在272~399 nm之间。当山奈酚与麦醇溶蛋白的质量比从1∶10减少至1∶40时,其载药率明显降低,而包埋率明显增加(表1),这说明包埋率与载药率和投药比相关。当投药比从1∶10增大至1∶5时,纳米粒子的包埋率与载药率的变化幅度并不明显,粒径从291 nm增加至399 nm,这可能是由于投药量过大,游离的KAE以吸附的形式附着在麦醇溶蛋白表面,导致纳米粒子的粒径突然增加。PDI代表纳米颗粒的分散指数,它的降低说明纳米粒子更加均一。因此综合考量纳米粒子的粒径、载药率、包埋率和电位,选择投药比为1∶10的比例进行后续研究。

图1 不同投药比KAE-GNPs的粒径分布
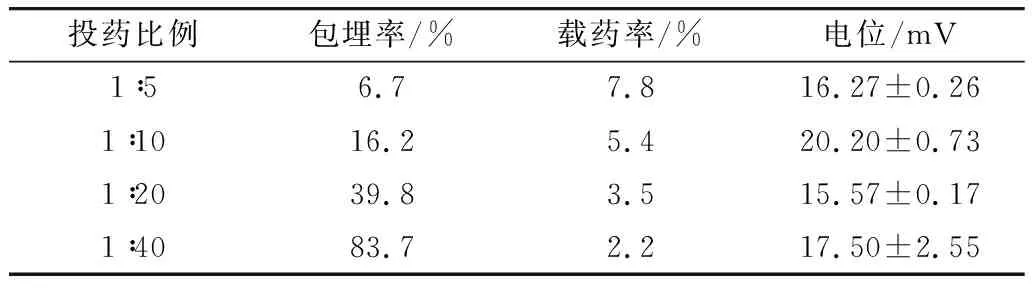
表1 山奈酚的包埋率与载药率
2.2 纳米粒子的粒径分布及电镜分析
在优化条件因素后制备出的KAE-GNPs平均粒径为150.9 nm(图2),PDI<0.2,说明粒子较为均一。载药纳米粒子具有较高的电位,正电荷之间的排斥作用使得纳米粒子具备较低的分散度,增加了其稳定性。空载小麦醇溶蛋白纳米颗粒的粒径在100 nm左右(图3a),与文献[15]报道的基本一致。载药后的纳米粒子的粒径主要呈现球形,粒子较为均一,粒子之间并没有出现明显的交联(图3b),但是实际的粒径在200 nm左右,这可能是由于粒度仪测得的数据是水合粒径。
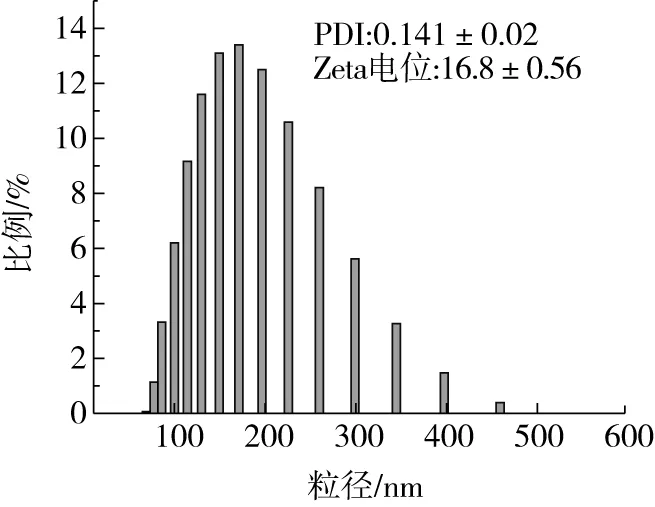
图2 KAE-GNPs载药纳米颗粒的粒径分布

图3 GNPs及KAE-GNPs的扫描电镜图(500 nm)
2.3 纳米粒子稳定性分析
在麦醇溶蛋白纳米颗粒表面包覆带电荷的生物聚合物或两亲生物聚合物是目前解决其稳定性和溶解性问题的主要策略[16]。复溶后的KAE-GNPs粒径明显增加,这是由于葡萄糖和甘露醇以静电作用的方式吸附在纳米粒子的表面,增大了粒子的粒径。在28 d的贮存过程中,粒子的水分散液并未出现明显的变化,流体力学直径也没有出现明显的增加(图4),这说明KAE-GNPs具有良好的稳定性和水分散性。

图4 KAE-GNPs在水分散液中28 d的粒径变化
2.4 傅里叶红外变换光谱分析
如图5所示,小麦醇溶蛋白在3 274.54 cm-1处有一个明显的峰,这是由于羟基的伸缩振动导致的[17]。在加入山奈酚之后,羟基的峰从3 274.54 cm-1移至3 288.04 cm-1,这表明小麦醇溶蛋白与山奈酚之间形成了氢键[18]。

图5 KAE-GNPs、山奈酚和GNPs的FTIR图

2.5 生物相容性分析
良好的生物相容性是作为给药载体材料的必要条件。随着KAE-GNPs和山奈酚的浓度增加,HUVEC存活率明显下降(图6)。HUVEC在KAE-GNPs(500 μg/mL)和KAE(27 μg/mL)孵育24 h后存活率分别为80.1%和49.3%,差异性显著(P<0.01)。将梯度浓度的KAE-GNPs与新鲜采集的兔血孵育4 h,所有KAE-GNPs处理组的溶血率均<2%,与阴性对照组(0.9% NaCl)相比无显著性差异(图7)。这说明KAE-GNPs具有很好的生物相容性,这是因为小麦醇溶蛋白对细胞具有促增殖作用[14]。综上所述,KAE-GNPs具有较低的细胞毒性和溶血率,且复溶效果良好,因此可以以冻干剂的形式保存,用作注射剂。
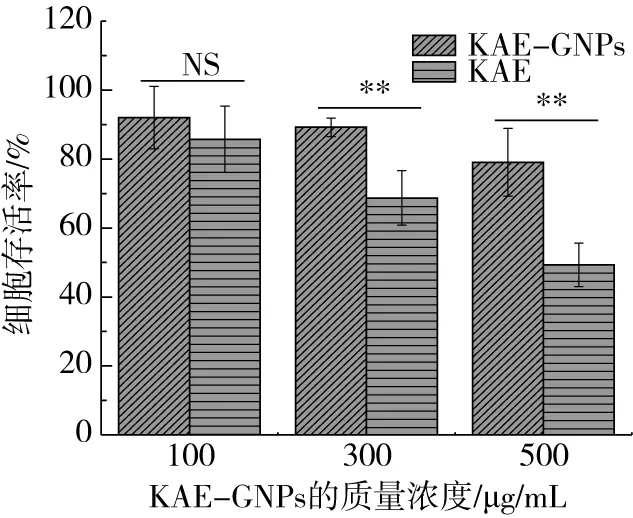
图6 不同浓度的KAE-GNPs和KAE对对HUVEC细胞的抑制作用(**:P<0.01)

图7 不同浓度的KAE-GNPs的溶血率
2.6 抗氧化活性以及清除细胞内ROS分析
KAE-GNPs与KAE清除DPPH能力随着浓度的增加而呈现出线性升高的趋势(图8),二者的IC50浓度分别为281、482 μg/mL,KAE-GNPs表现出更强的清除自由基能力,这是由于麦醇溶蛋白本身具有一定的抗氧化能力[22],其次可能是由于小麦醇溶蛋白与山奈酚的相互作用在一定程度上改变了山奈酚的分子空间结构,增强了其抗氧化的能力。

注:与KAE组相比,*为P<0.05;***为P<0.001。
如图9所示,未加H2O2组中的荧光信号十分微弱,细胞产生少量的活性氧属于正常现象。在H2O2处理后产生了强烈的荧光信号,这说明细胞已经产生了大量的活性氧。可以明显看到的是,HUVEC中由ROS探针被H2O2氧化而产生的强烈绿色荧光被KAE-GNPs和KAE孵育后明显减弱,但是二者之间仍具有显著性差异(图10)。这证实了KAE是可以有效清除细胞内的ROS[23]。而纳米粒子可以提高细胞对药物的摄取能力[24],这可能是KAE-GNPs能够更有效清除细胞ROS 的原因,但是具体的机制仍需进一步研究。

图9 活性氧染色图(标尺:100 μm)

注:与H2O2组相比,NS 无显著性差异;*P<0.05 **P<0.01。与H2O2+KAE组相比,## P<0.01。
3 结论
通过反溶剂法制备出表面光滑、大小均一的KAE-GNPs,KAE主要通过氢键、静电作用和疏水作用等分子间相互作用与小麦醇溶蛋白结合,KAE-GNPs具有良好的稳定性以及生物相容性,同时表现出较好的清除细胞内ROS的能力,为后续体内抗氧化研究提供了参考。KAE-GNPs在氧化应激和抗炎方面的应用以及机制仍需要进一步研究。

