BSA-Cu2+对头孢地尼的测定及作用机理研究*
王艳妮,马红燕
(延安大学 化学与化工学院 陕西省反应工程重点实验室,陕西 延安 716000)
头孢地尼(Cefdinir,CEF)属于第三代口服头孢菌素类抗生素,是临床上治疗敏感菌所致的感染性和炎症性疾病的常用药,比第一代或第二代头孢菌素抑制革兰氏阴性菌有更高的活性[1]。误服或过量服用会引起皮疹、发汗、血压迅速降低等过敏性症状,因此,对于CEF 的含量监测和药理研究很有必要。目前,对于CEF 含量的测定大多采用分光光度法[2]、高效液相色谱法[3,4]和电化学方法[5,6],毛细管电泳法[7]也有报道。然而本研究采用荧光分析法对CEF 的含量进行了测定,同时探讨了其猝灭机理。
实验发现,CEF 对BSA 的荧光信号有一定的猝灭作用,Cu2+的加入,对CEF 猝灭BSA 的荧光信号有很强的协同作用,且荧光猝灭值ΔF 在一定范围内与CEF 的浓度成正比,据此建立了定量测定CEF的荧光新方法。通过荧光光谱、紫外吸收光谱和荧光寿命的测定对猝灭机理进行了探讨。该方法的研究为后续了解药物在体内的运转代谢和新药研发提供了理论依据。
1 实验部分
1.1 仪器与试剂
F-4500 荧光光度计(日本日立公司);FLSP920瞬态稳态荧光光谱仪(英国爱丁堡公司);8453 型紫外-可见分光光度计(美国安捷伦公司)。
1.0×10-4mol·L-1CEF 标准溶液 准确称取0.0495g 头孢地尼标准品,用适量0.1mol·L-1KH2PO4溶解后用超纯水稀释、定容至250mL 容量瓶,待用时逐级稀释;
1.0×10-4mol·L-1BSA 标准溶液 准确称取1.6750g 牛血清白蛋白,超纯水溶解、定容于250mL容量瓶中;
B-R 缓冲溶液 在100mL 浓度均为0.04mol·L-1的混酸中(H3PO4-HAc-H3BO3)加入 47.5mL 0.2mol·L-1的NaOH 溶液,摇匀后经pH 计校准,配成pH 值为6.60 的缓冲液;
Tris-HCl 缓冲溶液 准确移取50mL 0.1mol·L-1Tris 溶液(三羟甲基氨基甲烷)和42.0mL 0.1mol·L-1HCl 溶液,超纯水定容至100mL 后经pH 计校准,配成pH 值为7.40 的缓冲液;
2.0×10-2mol·L-1Cu2+溶液 准确称取 0.1704g CuCl2,溶解、定容于100mL 容量瓶;待用时稀释;
所用试剂均为分析纯,配置好后于冰箱4℃保存,水为UP 超纯水(实验室自制)。
1.2 实验方法
室温下,于25mL 比色管中分别加入1.50mL BSA、1.50mL B-R 缓冲液以及5mL Cu2+(10umol·L-1)溶液,一份做试剂空白,其余比色管加入不同浓度梯度的 CEF,每次增加浓度为 2μmol·L-1。充分摇匀后,室温下静置15min 进行测定。采用1cm 石英比色皿,激发狭缝和发射狭缝均为5.0nm,以283nm 为最佳激发波长,扫描300~450nm 范围内的荧光发射光谱图。以CEF 的浓度为0nmol·L-1作为参照组,荧光强度记为F0,并计算ΔF。
2 结果与讨论
2.1 头孢地尼的测定
2.1.1 测定原理 为探究实验原理,固定各试剂浓度,以283nm 为激发波长分别扫描BSA、BSA-Cu2+、BSA-CEF、BSA-Cu2+-CEF 的荧光光谱图,结果见图1。
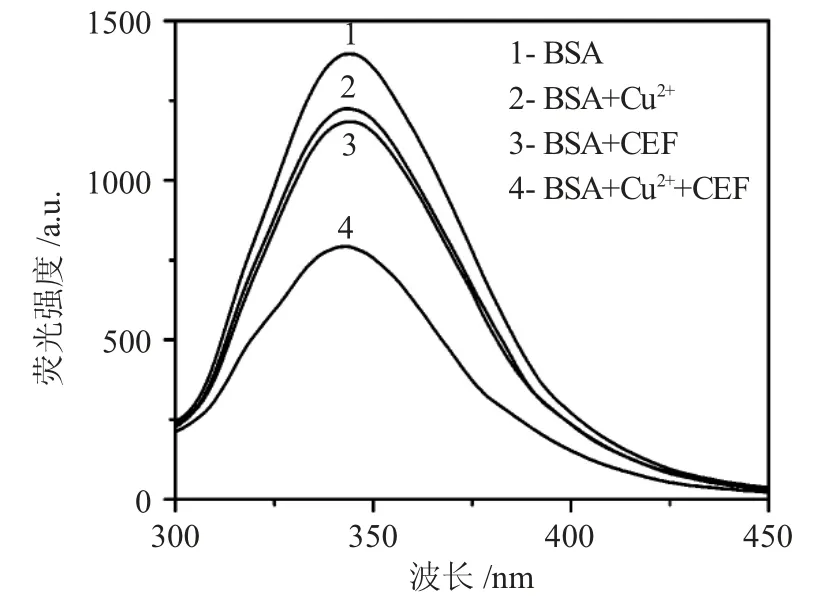
图1 实验原理图Fig.1 Experimental schematic spectra
BSA 本身有强荧光性质,分别加入Cu2+和CEF后BSA 荧光强度明显降低,如曲线2 和3 所示;若同时加入Cu2+和CEF,BSA 荧光强度猝灭更明显,经计算,并非两者猝灭值的叠加,如曲线4 所示,说明Cu2+对CEF 猝灭BSA 内源性荧光具有协同作用。分析反应过程可能是:无药物加入时,Cu2+与BSA 结合形成复合物猝灭其荧光,待药物加入后Cu2+与CEF结合性更强使其脱离了BSA,从而形成Cu2+-CEF 复合物再次反应猝灭了BSA 的荧光强度。

图2 BSA-Cu2+-CEF 荧光发射图谱Fig.2 Emission spectra of BSA-Cu2+-CEF
由图2 可以看出,随CEF 浓度的增加,体系Cu2+-BSA 荧光强度逐渐减小,因此,可以实现对CEF 的测定。
2.1.2 反应条件的优化 实验研究了BSA、缓冲介质,增敏剂的种类和用量对体系的影响。结果表明,BSA 用量为1.50mL 时荧光猝灭值最大,BSA 的最终测试浓度为0.6μmol·L-1。实验考察了一系列缓冲溶液的影响,结果证明,1.50mL 的 B-R(pH 值为 6.60)影响最大。
BSA 探针直接测定CEF 灵敏度较低,因此,考察了部分金属离子和纳米粒子对CEF 的协同作用,结果表明,Cu2+与CEF 结合对BSA 的荧光猝灭更明显,F/F0接近0.5,即Cu2+的协同作用最好。可能原因是CEF 加入后先与Cu2+发生亲和反应形成二元复合物,进而与BSA 相互作用猝灭其荧光强度。实验考察了Cu2+用量对体系的影响,最终选择5mL(10μmol·L-1),测试浓度为 2.0μmol·L-1。
2.1.3 共存物质的干扰 以相对误差不高于±5%为限,研究了实验过程中和实际样品中可能存在物质的干扰情况。当 CEF 浓度为 80nmol·L-1时,1000 倍的葡萄糖、乳糖、蔗糖、淀粉、D-果糖、Na+、K+、Mg2+,500 倍的赖氨酸、SO42+、Ba2+、Ca2+、Zn2+、Pb2+,50 倍的Fe3+、Mg2+不产生干扰。
2.1.4 精密度、线性范围和样品的测定 在优化的条件下,CEF 溶液浓度在 6~360nmol·L-1范围内与体系的荧光强度ΔF 值呈良好的线性关系,线性回归方程为 ΔF=30c(nmol·L-1)+25.83,R2=0.9994。对浓度为 80nmol·L-1的 CEF 溶液平行测定 5 次,其相对标准偏差为0.35%。根据IUPAC 规定,以3S0/S 计算,方法检出限(S/N=3)为 3.3nmol·L-1。实验抽取两个厂家的头孢地尼片剂进行测定,回收率为99.40%~102.2%。
2.2 机理的研究
2.2.1 猝灭方式初探 模拟生理条件,调节体系缓冲溶液pH 值为7.40 的Tris-HCl 溶液,参考斯特恩-沃尔默方程[8]进一步研究CEF、Cu2+-CEF 和BSA间的猝灭机理,固定BSA 和Cu2+的浓度扫描荧光光谱,得出不同浓度下CEF 的相对猝灭曲线,见图3、4。

图3 BSA-CEF 的 Stern-Volmer 图Fig.3 Stern-Volmer plots of BSA-CEF

图4 BSA-Cu2+-CEF 的 Stern-Volmer 图Fig.4 Stern-Volmer plots of BSA-Cu2+-CEF
由图3、4 可知,两体系的猝灭常数均随温度的升高而降低,说明CEF 对BSA 的猝灭过程为静态猝灭,Cu2+存在使得KSV和Kq均增大,增强了BSA 的猝灭作用,但对猝灭方式不会产生影响。通过拟合不同CEF 浓度下的双对数曲线,发现Cu2+加入后,CEF和BSA 的结合常数(KA)和结合位点数(n)明显增大(见表 1),说明 Cu2+的存在,使得 CEF 和 BSA 结合的更加牢固和紧密,从而延长CEF 在血液中的作用时间,有助于药物持续发挥药效。推断该体系可能存在竞争作用,即Cu2+与CEF 的络合作用强于CEF 与BSA 的结合先生成复合物,然后再与BSA 反应猝灭其荧光强度。
2.2.2 作用力类型判断 药物小分子和蛋白质大分子发生反应主要通过各种作用力相结合,即疏水作用力(ΔH>0,ΔS>0),氢键和范德华力(ΔH<0,ΔS<0),静电引力(ΔH<0,ΔS>0),参考范特霍夫方程方程[9]:

计算出两体系的热力学参数见表1,ΔH<0,ΔS<0,表明CEF 和BSA 均通过氢键和范德华力相结合,Cu2+的参与没有改变两者间的作用力类型,同时,ΔS<0,说明反应过程放热,因此,温度的升高不利于反应正向进行,与同一体系下温度越高结合常数和位点数越小结论相一致,ΔG<0,说明该反应自发进行。

表1 CEF、CEF-Cu2+与BSA 作用的结合常数、结合位点数和热力学常数Tab.1 Bingding constants、bingding sites and thermodynamic constans of CEF、CEF-Cu2+to BSA
2.2.3 紫外吸收光谱和寿命测定 紫外吸收光谱也是区分猝灭机理的重要手段,本实验固定各物质的浓度分别绘制 BSA,CEF,BSA-CEF、CEF-BSA-Cu2+的紫外吸收曲线(见图5)。
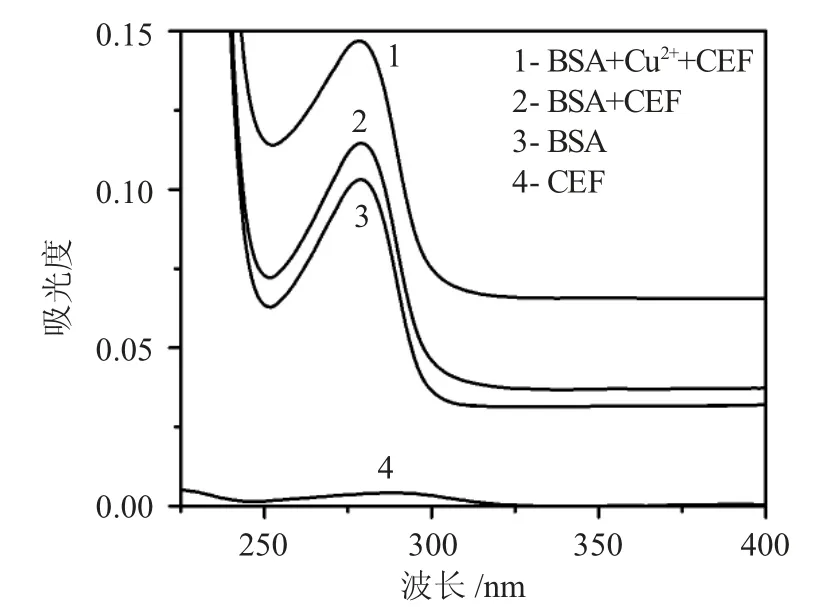
图5 紫外吸收光谱图Fig.5 UV absorption spectrum
实验发现BSA 在278nm 处有明显的吸收(3),加入CEF 后BSA 的吸收峰略有增强(2),继续加入Cu2+,体系的吸收峰进一步增强(1),再次证明有无Cu2+参与,CEF 与BSA 的作用机理均为静态猝灭,同时也表明Cu2+参与了CEF 和BSA 的反应过程,即三者之间形成了配合物[10]。
于FLSP920 瞬态稳态光谱仪上分别测定BSACEF 和BSA-Cu2+-CEF 体系的荧光寿命衰减曲线,拟合结果表明有无Cu2+参与荧光寿命均为6.79ns,荧光寿命比值为1,进一步证明Cu2+存在下体系的猝灭过程为静态猝灭[11]。
2.2.4 结合间距和能量转移的计算 根据Forster能量转移理论[12],供能体的荧光发射光谱与受能体的吸收光谱有足够的重叠且供能体与受能体的最大距离不超过7nm 时,将会发生非辐射能量转移现象,导致荧光猝灭。BSA 作为能量给体进行荧光共振能量转移的只有Trp 残基和Tyr 残基,而Trp212残基是BSA 的主要荧光源[13],因此,利用公式可以求出Trp212残基与CEF 间的结合距离:


图6 BSA 的荧光光谱和CEF 的UV 光谱重叠Fig.6 Overlapping of BSA fluorescence spectra with CEF UV spectra(A: BSA-Cu2+-CEF, B:BSA-CEF)
将图6 的光谱重叠部分分别采用矩形分割法求出积分值:BSA-CEF 体系的J=1.78×10-15(cm3·L)·mol-1,R0=1.89nm,CEF 和BSA 等摩尔相互作用的荧光强度求出E=44.8%,进而求出r=2.0nm,同样的方法求得 BSA-CEF-Cu2+体系 J=1.79×10-15(cm3·L)·mol-1,R0=1.89nm,E=79.0%,r=1.5nm,r 值均小于 7nm,表明CEF 和BSA 之间发生了非辐射能量转移。对比Cu2+存在下,BSA 的能量转移效率更高,且CEF 与BSA的色氨酸残基结合距离更小,更加证明了Cu2+对CEF 的强协同作用,使得BSA 的荧光强度降的更低。
3 结语
实验发现,在B-R(pH 值为6.60)缓冲溶液中,基于Cu2+对CEF 猝灭BSA 内源性荧光有明显的协同作用,建立了Cu2+-BSA 为体系,实现对CEF 的定量测定。并通过荧光光谱法、紫外分光光度法和荧光寿命的测定证明在有无Cu2+存在下,体系的猝灭过程包括静态猝灭和非辐射能量转移,Cu2+的参与并未改变CEF 对BSA 的猝灭机理和作用力类型,但使猝灭常数、结合常数和结合位点数增大。热力学参数表明该反应自发进行,CEF 与BSA 通过氢键和范德华力相结合。因此,选择合适的金属离子可以适当改善药物与BSA 的相互作用,使其更好地发挥药效,该研究为药物的药理研究提供了可靠地数据参考,也为测定CEF 含量提供了新方法。

