BUB1B在肾透明细胞癌免疫细胞和预后中的作用
吴少波,臧淇娟,邢梓轩,代秉玲(西安交通大学医学部药学院,西安 710061)
肾透明细胞癌(KIRC)是肾癌中最常见的恶性肿瘤,占肾脏原发恶性肿瘤的75%~82%[1-2]。近年来,免疫检查点抑制剂已成为KIRC一线治疗的标准[3-5]。BUB1B是纺锤体装配检查点蛋白家族的成员之一,已被证实与多种癌症相关,但其在KIRC发生中的确切作用尚不清楚。研究表明,多种因素可能在KIRC免疫微环境的形成过程中发挥不同的作用。免疫检查点阻断疗法已被证实对KIRC患者预后的改善具有一定作用[6],但免疫浸润细胞与KIRC预后的关系仍不清楚。
本研究采用癌症基因组图谱(TCGA,https://tcga-data.nci.nih.gov/tcga/)数据库中的KIRC数据,通过基因表达谱交互分析(GEPIA)和Cox比例风险回归模型回归分析确定BUB1B与KIRC表达的相关性及对预后的影响。利用CIBERSORT和TIMER计算KIRC中22种不同类型肿瘤浸润性免疫细胞(TIICs)的相对比例,探讨BUB1B与TIICs的关系。此外,对BUB1B进行基因功能富集,分析其表达影响的通路,最后利用GEO和UCLCAN数据库对结果进行外部数据验证。BUB1B有可能成为新的评估KIRC患者预后的生物标志物和肿瘤免疫治疗靶点。
1 资料与方法
1.1数据下载和预处理 下载KIRC患者的基因表达谱和临床信息,包括539份肿瘤样本和72份正常样本,均来自于TCGA(是高通量芯片实验数据的公共存储库)。剔除年龄、总生存时间、肿瘤原发灶(T)、淋巴结转移(N)和远处转移(M)分期资料不足或缺失的病例。最后,对497例临床资料符合要求的患者进行后续分析。
1.2GEPIA数据库分析 用GEPIA (http://gepia.cancer-pku.cn/)对TCGA数据库中BUB1B在肿瘤和正常样本中的表达量进行分析。GEPIA是一个公共平台,用于分析来自TCGA和基因型-组织表达(GTEx)数据库项目的9 736个肿瘤和8 587个正常样本的RNA测序表达数据[7]。本研究使用GEPIA分析KIRC总生存与BUB1B表达的相关性及其表达与病理分期之间的联系。
1.3免疫浸润分析 TIMER是一个用于系统分析各种癌症类型免疫浸润的数据库(https://cistrome.shinyapps.io/timer/)[8]。本研究通过基因模块评估KIRC中BUB1B与6种免疫细胞丰度的关系。此外,为了评估样本集中基因表达的相对差异,使用了一种名为CIBERSORT的基于表达的反卷积算法。利用CIBERSORT计算了22种类型免疫细胞的免疫应答,以评估它们在KIRC中与BUB1B表达的关系,并发现与TIICs之间的相关性。
1.4基因功能富集分析 基因功能富集分析(GSEA)通常用于评估某一特定基因集在一定的生物学状态下是否存在显著差异。本研究通过GSEA分析BUB1B低表达组和高表达组在哪些通路上存在显著差异表达。
1.5外部数据来源 本研究分析了从GEO(http://www.ncbi.nlm.nih.gov/geo)下载的2个KIRC基因表达谱芯片数据集,分别为GSE36895和GSE71963。UALCAN是一个验证目标基因和确定肿瘤亚群特异性候选生物标志物的数据平台(http://ualcan.path.uab.edu)[9],通过UALCAN分析了BUB1B在KIRC中的表达差异、肿瘤分期以及预后。
1.6统计学方法 本研究数据处理基于R(3.6.3)软件,来源于Bioconductor (https://www.Bioconductor.org/)。数据整理:如果数据出现缺少任意单个值则删除整个样本,采用单因素Cox和多因素Cox分析评估BUB1B表达及其他病理临床因素(年龄、性别、淋巴结、远处转移、肿瘤状态、分期)与总生存期之间的相关性。P<0.05表示差异具有统计学意义。
2 结果
2.1KIRC患者的临床特征及Cox分析 与正常组织相比,KIRC中BUB1B的表达水平明显升高(log2FC<1,P<0.01),见表1和图1。由图1可知,通过GEPIA发现,BUB1B高表达与低总生存率(P=0.008 2)(图1B)和病理晚期(P<0.01)显著相关(图1C)。单因素Cox回归分析表明,年龄、肿瘤分期、肿瘤分级、肿瘤原发灶(T)、远处转移(M)分期和BUB1B高表达都是不良预后的危险因子。多因素Cox分析表明,年龄、肿瘤分期、肿瘤分级以及BUB1B高表达均与患者预后显著相关。因此,BUB1B表达上调[风险比(HR)=1.23,P=0.00]可作为预测患者预后的独立危险因素。

图1 GEPIA中BUB1B的表达与预后及临床病理因素的相关性分析注:A.BUB1B在癌旁组织样本和肿瘤样本中的差异表达;B.BUB1B高、低表达组在KIRC患者中的生存曲线;C.不同肿瘤分期中BUB1B表达的箱式图;D.多因素Cox分析的森林图。Fig.1 Expression of BUB1B,survival prognosis and correlation analysis with clinicopathological factors by GEPIANotes:A.BUB1B is differentially expressed in normal samples and tumor samples; B.the prognosis survival curve of KIRC patients with high and low BUB1B expression group; C.Box diagram of BUB1B expression in different tumor stages;D.forest map by multivariate Cox analysis.

表1 患者总体生存和多变量特征的相关性Tab.1 Correlation between overall survival and multivariable characteristics
2.2KIRC患者免疫浸润水平以及免疫浸润细胞与预后的关系 见图2。由图2可知,经TIMER评估得出,BUB1B的表达水平与KIRC 6种免疫细胞浸润水平呈显著正相关(图2A)。此外,以P<0.05为标准过滤样本,最后得到13例正常样本和415例肿瘤样本,利用CIBERSORT分析计算免疫细胞的密度,评估它们在正常组和肿瘤组中表达水平的差异(图2B)。结果表明,CD8+T细胞、激活的CD4+记忆性T细胞、T-regs细胞、M0巨噬细胞和中性粒细胞在肿瘤组中呈高表达(P<0.05),静息的CD4+记忆性T细胞、静息的NK细胞、单核细胞和静息的肥大细胞在肿瘤组中呈低表达(P<0.05)。KIRC中22种免疫细胞之间的相关性评估见图3。正相关用红色表示,负相关用蓝色表示。由图3可见,CD8+T细胞与静息的CD4+记忆性T细胞呈强负相关(-0.63),与M2巨噬细胞也呈一定的负相关(-0.51)。

图2 BUB1B与免疫浸润细胞的相关性和KIRC中不同免疫细胞的比例Fig.2 Correlation of BUB1B with immune-infiltrating cells and proportions of different immune cells in KIRC
2.3GSEA分析 GSEA分析显示了BUB1B富集到的存在显著差异的KEGG通路[错误发现率(FDR)<0.05且P<0.05]。见表2和图4。由表2和图4可知,KEGG通路分析显示了与BUB1B高表达呈正相关的5个通路:细胞周期、自然杀伤细胞介导的细胞毒性、P53信号通路、T细胞受体信号通路和非小细胞肺癌;呈负相关性的3个通路是亨廷顿病、氧化磷酸化和帕金森氏病。结果表明,BUB1B在KIRC的发生、发展中发挥重要作用。

图4 基因功能富集图Fig.4 Map of gene function enrichment

表2 基因功能富集分析Tab.2 Gene sets enriched in phenotype
2.4外部数据验证 见图5。由图5可知,提取GEO数据集GSE36895(正常样本=23,肿瘤样本=29)和GSE71963(正常样本=16,肿瘤样本=32)中的基因表达矩阵,发现BUB1B在肿瘤组织中高表达;通过UALCAN分析可知,BUB1B同样也在肿瘤组织中高表达(图5C)。此外,UALCAN数据库还分析了134例BUB1B高表达样本和397例中低表达样本的生存曲线,发现BUB1B高表达组的预后更差(P<0.000 1),且BUB1B的表达水平与肿瘤各分期呈显著正相关,与之前的结论一致(图5D和图5E)。
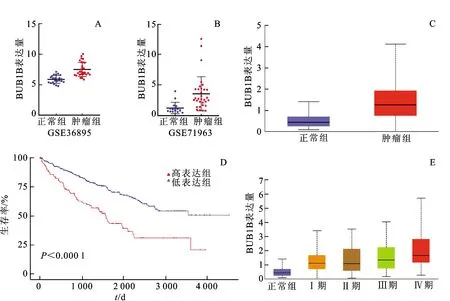
图5 外部数据验证结果注:A.数据集GSE36895中BUB1B的表达情况;B.数据集GSE71963中BUB1B的表达情况;C.UALCAN中BUB1B的表达情况;D.UALCAN中BUB1B高、低表达患者的生存曲线;E.UALCAN中BUB1B的临床分期表达情况。Fig.5 Results of external data validationNotes:A.expression of BUB1B in data set GSE36895;B.expression of BUB1B in data set GSE71963;C.ehe expression of BUB1B in UALCAN;D.survival curve of patients with high and low expression of BUB1B in UALCAN;E.clinical stage expression of BUB1B in UALCAN.
3 讨论
KIRC在全球范围内是最常见的十大癌症之一,每年约有338 000例新发病例[10-11]。与其他肾癌亚型患者相比,KIRC患者的预后更差。目前,包括手术和靶向治疗的综合治疗已经被用于治疗KIRC,患者的总体存活率得到了提高[12]。然而,Cost N G等[13]报道靶向分子治疗对透明KIRC血栓的临床效果微乎其微。近年来,KIRC的基因治疗逐渐成为研究者关注的热点[14]。研究表明,目前的治疗远远不能满足KIRC患者的需求,对于KIRC的治疗和预后评价,迫切需要新的生物标志物。据报道,BUB1B的表达与多形成性胶质细胞瘤(GBM)患者的不良预后相关,可促进胶质母细胞瘤患者肿瘤细胞的增殖[15-16]。此外,BUB1B与肿瘤生长和前列腺癌的进展有关[17],BUB1B高表达已被证实与人类肺腺癌有关[18],但其在KIRC中的作用尚未见报道。KIRC常伴有免疫细胞浸润,被认为是一种免疫原性癌[19]。从KIRC中分离出多种免疫细胞,包括自然杀伤细胞(NK)、对自体肿瘤细胞有特异性的细胞毒性T细胞、辅助T细胞和表达白细胞介素-1(IL-1)和白细胞介素-2(IL-2),并作为抗原提呈细胞的树突状细胞[20-23],而巨噬细胞、单核细胞、中性粒细胞和树突状细胞可能是免疫检查点抑制剂疗法重要的靶标[24]。本研究首次论证了BUB1B作为独立危险因素在预测KIRC患者预后以及在免疫微环境中的调控潜力。
本研究显示,BUB1B在KIRC组织中呈显著高表达。多因素Cox分析结果显示,BUB1B可作为独立危险因素预测KIRC患者更差的预后,这在外部数据GEPIA和UALCAN中均得到了验证,说明研究BUB1B对KIRC患者的预后具有临床意义。进一步研究发现,不同的免疫细胞浸润水平与KIRC中BUB1B的表达量呈显著正相关,在癌旁组织和肿瘤组织样本中有多种免疫细胞存在显著差异表达。在大多数实体瘤中,CD8+T细胞的高浸润有利于肿瘤的治疗[25-27],在KIRC的免疫细胞中,CD8+T细胞所占比例最大,而肾癌中CD8+T细胞的高浸润与不良预后有关[28]。NK细胞是存在于肾细胞癌中的一种浸润性免疫细胞,有研究表明,NK细胞介导的细胞毒性通路在肾细胞癌中表现出较高的活性,提高KIRC细胞对NK细胞的细胞毒性的敏感性可能是治疗KIRC的有效方法[29]。一些基于NK细胞毒性作用的KIRC新治疗方法的研究已经完成[30]。这些发现有助于进一步研究BUB1B在KIRC中的预后价值以及与免疫浸润细胞相互作用的可能机制。此外,本研究还表明,BUB1B与许多免疫应答途径和癌症通路显著相关。BUB1B高表达组富集到的通路包括自然杀伤细胞介导的细胞毒性、T细胞受体信号通路和非小细胞肺癌等,BUB1B低表达组富集到的通路包括亨廷顿病、氧化磷酸化和帕金森氏病。有研究发现氧化磷酸化下调、三羧酸循环(TCA)通路及其相关通路可能在KIRC的发生和发展中起关键作用,趋化因子信号通路及其相关通路的上调可能有助于KIRC的转移[29]。
基于本研究结果以及以往对BUB1B的研究,有理由认为BUB1B在KIRC免疫浸润细胞的调控中发挥了关键作用。建议进一步深入研究,逐步完善BUB1B生物学效应的证据。综上所述,BUB1B是一个具有潜在应用前景的预后生物标志物,可能成为KIRC免疫治疗的新靶点。

