蛋白质乙酰化对宰后肉品质调控的研究进展
田铸,师希雄,张攀高,郭兆斌,余群力,王建忠
(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
蛋白质翻译后修饰(post-translational modifications, PTMs)通常是在酶的催化作用下,将相应的小分子基团共价结合到蛋白质的某些氨基酸残基上,也有一些具有活性的代谢产物可在无酶参与下与蛋白质分子上的亲核残基共价结合[1]。蛋白质的PTMs方式较多,主要有磷酸化、泛素化、乙酰化、甲基化、糖基化等,它作为一种重要的细胞调控机制,通过调节蛋白质的折叠、构象以及活性等多种特性从而调节蛋白质功能[2]。生物中几乎所有的蛋白质都经历了特定的PTMs来获得生物活性。蛋白质乙酰化作为蛋白质翻译后修饰之一,普遍存在于动物、植物、微生物及人类在内的各种自然界生命中[3]。近年研究发现,蛋白质乙酰化可能在调控宰后肌肉品质中发挥着重要作用,该研究领域已成为蛋白质领域的研究热点,它可能通过调节宰后肌肉糖酵解、肌肉收缩、细胞凋亡等,从而调控肌肉品质[4-7]。目前研究表明,蛋白质乙酰化在调节宰后肌肉的生理生化过程和代谢变化中发挥着重要作用。本文总结了近年来蛋白质乙酰化对宰后肌肉糖酵解、肌肉收缩、细胞凋亡3个方面的调控及其对肉品质的影响。
1 蛋白质乙酰化的概念与分类
1.1 概念
蛋白质乙酰化是指蛋白质在乙酰基转移酶的作用下把乙酰基团共价结合到底物蛋白质中氨基酸残基上的过程。1963年文森特·奥弗雷第一次发现了蛋白质乙酰化,此后便一直备受研究者的关注[8-10]。
乙酰化修饰在蛋白质乙酰化酶和去乙酰化酶的相互作用下受到精确的调控,其主要的生化过程涉及两类蛋白质[11]:第一类是蛋白质乙酰转移酶,它们的作用是将乙酰基团添加到蛋白质中,蛋白质乙酰转移酶以乙酰辅酶A作为必需的辅助因子,将乙酰基转移到特定的赖氨酸残基上。第二类是蛋白质去乙酰酶,其可去除乙酰化蛋白质中的乙酰基,蛋白质去乙酰酶可以将Zn2+作为辅助因子,或以NAD+作为共底物从蛋白质中除去乙酰基,2种调控反应如图1所示。蛋白质乙酰转移酶与去乙酰酶共同调节细胞内蛋白质的乙酰化修饰,在众多的代谢调控及代谢相关疾病预防中发挥着重要作用[12-13]。
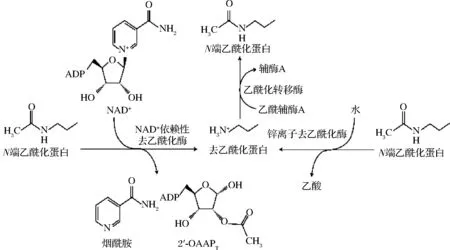
图1 乙酰化和去乙酰化的机理[13]Fig.1 Mechanism of acetylation and deacetylation[13]
1.2 分类
根据修饰位置的不同,蛋白质乙酰化分为Nα乙酰化和Nε乙酰化2种形式[14]。Nα乙酰化是指蛋白质N末端被乙酰化修饰,并能够调控蛋白质的稳定性,其存在于近 80% 的真核蛋白质中,该种修饰方式属于不可逆修饰。Nε乙酰化是一种动态、可逆性的修饰方式,它执行着不同的生物学功能,并随着细胞的生理状态和外界环境变化而改变,从而起到细胞内外信号传递、酶原激活的作用[15]。
目前,利用蛋白质组学分析对自然界各物种进行蛋白质乙酰化的研究备受关注[16]。经过系统的筛选,几乎在每个细胞内的蛋白质上都存在数千个乙酰化位点,它们在细胞信号传导、基因表达调控、新陈代谢以及疾病预防等各个方面发挥着重要作用[17]。
2 蛋白质乙酰化调节糖酵解、肌肉收缩、细胞凋亡及对肉品质的影响
目前研究表明,宰后肉成熟过程中大部分蛋白质均出现不同程度的乙酰化。通过对乙酰化修饰差异蛋白质之间的互作分析,这些差异表达的乙酰蛋白参与了糖酵解、肌肉收缩和细胞凋亡等[4]。近年研究发现,蛋白质乙酰化可能通过调节宰后肌肉的糖酵解、细胞凋亡、僵直等进而调控肉品质的形成[18]。
2.1 蛋白质乙酰化调节糖酵解对肉品质的影响
糖酵解作为宰后肌肉最主要的供能方式,与肌肉的色泽、pH、保水性以及肌肉僵直都有直接关系。动物屠宰后机体氧气供应立即停止,肌肉细胞中肌糖原发生无氧酵解,并最终产生大量乳酸,随着乳酸的累积,肌肉的pH值下降,使其达到肌原纤维蛋白质的等电点(pH 5.1~5.2),由于pH值的波动会影响糖酵解与蛋白分解相关的酶活性。同时在糖酵解的过程中也会产生一定的热量,这会使得胴体温度升高从而导致肌肉中蛋白质发生变性。如果糖酵解速率过快则产生PSE(pale soft exudative)肉,过慢则会产生DFD(dark,firm and dry)肉,过快的糖酵解更有利于组织蛋白酶释放、激活,促进蛋白质降解,进而有利于肉的嫩化,同时糖酵解对肌肉的保水性以及嫩度等品质具有一定的影响[19-21]。
糖酵解作为能量代谢的一种,蛋白质乙酰化修饰在调控糖酵解过程中起到关键作用[22-23]。李琼[24]研究发现,蛋白质乙酰转移酶抑制剂能够降低宰后小鼠肌肉中蛋白质乙酰化水平,而且拮抗AMP活化蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)对糖酵解的促进作用。同时,通过宰前腹腔注射蛋白质去乙酰酶抑制剂能大大提升宰后小鼠肌肉中蛋白质的乙酰化水平和糖酵解速率。李仲文[25]通过对宰前小鼠腹腔注射乙酰化酶和去乙酰化酶抑制剂,证明2种抑制剂分别抑制和促进了宰后肌肉的糖酵解,同时蛋白质印记(western blot,WB)检测乙酰化水平后发现,2种抑制剂分别降低和提高了宰后肌肉的乙酰化水平。SHAKESPEAR等[26]研究发现,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)作为炎症和代谢信号汇聚的关键转录因子,可以调节糖酵解基因的表达,从而增强糖酵解通量。由此证明除了蛋白质乙酰化/去乙酰化介导对糖酵解酶活性的调控外,蛋白质去乙酰化酶还可以通过去乙酰化转录因子或组蛋白来调控糖酵解相关基因的表达。WANG等[27]报道,山竹子素(garcinol)可以显著降低育肥猪宰后肌肉的糖酵解并能够改善肉品的品质,可能由于山竹子素降低了糖酵解酶的乙酰化水平。
LI等[28]研究表明,游泳能显著提高小鼠宰后背最长肌的糖酵解和总乙酰化蛋白水平,蛋白乙酰化酶抑制剂抑制了糖酵解水平的增加,相反,宰前腹腔注射去乙酰化酶抑制剂提高了宰后肌肉的乙酰化水平,并加速了糖酵解,这些结论证实了蛋白质乙酰化对宰后肌肉糖酵解具有一定促进作用。
LI等[5]通过使用组蛋白乙酰转移酶和去乙酰化酶抑制剂进一步发现蛋白质乙酰化参与了AMPK来调控宰后肌肉的糖酵解进程,证明了蛋白质乙酰化在宰后肌肉糖酵解过程中发挥着重要的调节作用,它能够影响宰后肌肉的pH值进而影响早期肌肉的持水性。JIANG等[29]研究了蛋白质去乙酰化酶1对胃癌的生存和生物学行为的影响,在 252 例原发性胃癌肿瘤样本和体外研究中,分析了蛋白质去乙酰化酶 1的表达和糖酵解活性,经体外试验研究表明蛋白质去乙酰化酶 1能够显著促进胃癌中的糖酵解进程。BOND等[30]的研究表明,可逆的4个位点的乙酰化/去乙酰化相互调控其糖酵解和糖合成活动,有助于在小鼠肝脏和全身水平上糖酵解和糖异生的相互调控。ZHOU等[4]为了探讨蛋白质乙酰化在宰后肌肉的作用,通过采用蛋白质乙酰化定量分析的方法对猪宰前应激处理后,共鉴定出771个乙酰肽,其中681个赖氨酸乙酰化位点映射到176个乙酰蛋白。研究表明宰后猪肉成熟过程中肌肉的糖酵解与宰前应激有关,并证明大多数的糖酵解酶被乙酰化。JIANG等[18]基于定量蛋白质组学手段,研究了宰后猪肉蛋白质乙酰化对糖酵解的影响,结果表明,蛋白质乙酰化可以调控宰后猪肉的糖酵解水平。宰后肌肉的糖酵解作用会一直持续到糖酵解酶失活或肌糖原耗尽。随着糖酵解的进行,乳酸含量逐渐增加,导致pH值的下降,宰后肌肉的异常糖酵解导致PSE肉、DFD肉甚至酸性肉类的发生,由于品质低劣而不被消费者所喜欢。BALASUBRAMANYAM等[31]和WANG等[32]研究发现,山竹子素作为一种非常有效的组蛋白乙酰转移酶p300/CBP-缔合因子的天然抑制剂,可以通过4种乙酰化的糖酵解酶激活糖酵解途径。以上结论进一步证实了蛋白质乙酰化对宰后肌肉糖酵解具有一定的抑制作用。
综上表明,蛋白质乙酰化通过调控宰后肌肉的糖酵解进而对肉品质具有一定的调控作用。然而当前国内外对糖酵解的具体作用机制还存在一定的争议,这在今后将成为一个研究热点。
2.2 蛋白质乙酰化调节肌肉收缩对肉品质的影响
肌原纤维蛋白是肌肉中主要的结构蛋白,它能够将化学能转化为机械能并负责支撑肌纤维的形状。肌原纤维蛋白分为收缩蛋白、调节蛋白以及支架蛋白三类,其中主要的收缩蛋白有肌球蛋白和肌动蛋白,二者主要负责肌肉的收缩以及肌纤维的支撑功能[33]。肌肉中每一个肌节之间的肌动蛋白和肌球蛋白之间的相对滑动,导致了肌节的变短从而引起肌肉的收缩。动物屠宰以后,短时间内肌肉的收缩功能并没有停止,而是会持续一段时间[34]。此时,肌细胞处于缺血缺氧的环境中,其主要通过糖酵解供能,代谢产生乳酸导致肌细胞pH下降。与此同时,肌浆网钙离子的释放导致细胞质中钙离子浓度升高,能量的消耗和钙离子浓度的提高促使肌肉收缩形成肌动球蛋白,从而使肌节长度变短,最终导致嫩度的降低。有研究表明,肌球蛋白,伴肌球蛋白以及其他肌原纤维蛋白的磷酸化可调节宰后肌肉的收缩与僵直,然而蛋白质乙酰化对肌肉收缩的相关研究鲜有报道[35-37]。
SAMANT等[38]证明肌球蛋白重链的乙酰化可调节肌动蛋白激活腺苷三磷酸酶(ATPase)活力以及肌动蛋白滑动速度,从而影响肌肉收缩。GUPTA等[39]研究发现,蛋白质乙酰转移酶和去乙酰化酶所进行的动态可逆的蛋白质乙酰化作用在调节肌丝的收缩活性方面发挥作用,通过原代培养的心肌细胞和小鼠心脏切片经免疫组化和电镜分析证明,相关蛋白MLP在乙酰化依赖下增加了肌丝的收缩活性,蛋白质乙酰转移酶和去乙酰化酶分别对肌肉收缩有促进和抑制作用。
RYDER等[40]和VISWANATHAN等[41]通过乙酰化蛋白组学分析发现蛋白质乙酰化参与了骨骼肌收缩的进程。通过假乙酰化作用,肌动蛋白在K328和/或K326处的高乙酰化改变了肌动蛋白、肌球蛋白以及原肌球蛋白三者间的关系,并能够诱导肌肉收缩。JIANG等[18]研究报道,与肌肉收缩相关的大多数蛋白质具有多个赖氨酸残基,在宰后肌肉中可以动态地被乙酰化或去乙酰化。同时,肌原纤维蛋白的乙酰化可影响肌球蛋白与肌动蛋白的相互作用,由此推测蛋白质乙酰化可调控肌球蛋白与肌动蛋白的相互作用,从而调控肌肉的收缩。聂作明[42]通过结构域(domain)富集分析证实了乙酰化修饰倾向于调控家蚕体内物质与能量代谢,进一步分析发现,乙酰化修饰在家蚕的肌肉收缩中扮演着重要的功能角色。宰后肌肉细胞中的肌浆蛋白可能发生乙酰化修饰,加之肌原纤维收缩性能的改变导致僵直,进而可能会影响宰后肌肉的嫩化进程,最终导致肉的嫩度发生改变[13]。然而,WILLIAM等[43]研究发现,肌动蛋白的K326和K328与原肌球蛋白的负电荷氨基酸建立了关键的静电相互作用,这些残基被证明在豚鼠心脏中被乙酰化,可以通过削弱肌动蛋白-原肌球蛋白的接触进而抑制肌肉收缩。
综上表明,蛋白质乙酰化对宰后肌肉收缩的影响报道不一致,且现阶段蛋白质乙酰化介导畜禽宰后肌肉收缩的研究在国内外鲜有报道,具体调控机理仍需进一步研究。
2.3 蛋白质乙酰化介导细胞凋亡对肉品质的影响
宰后肌肉的成熟过程实际上就是肌肉细胞死亡以及死亡后的一系列生化反应的过程。肌肉细胞死亡的方式主要有细胞凋亡、细胞自噬以及细胞坏死等[44]。宰后肌肉成熟期间,肌浆网钙离子的释放导致细胞质中钙离子浓度升高,线粒体膜的功能紊乱释放多种促细胞凋亡因子而激活细胞凋亡酶,引发细胞凋亡。细胞凋亡主要有线粒体凋亡、死亡受体凋亡和内质网途径凋亡3条途径[45]。细胞凋亡往往伴随着细胞骨架蛋白和细胞成分的裂解、肌肉细胞的收缩和膜不对称的缺失等,最终导致肉质性状的改变[46]。宰后肌肉的嫩化主要受细胞凋亡酶以及其他内源性蛋白水解酶的调节,细胞凋亡在宰后肉嫩化过程中起着主要作用[47]。
目前,有国内外学者对蛋白质乙酰化调节细胞凋亡进行了一些研究。CHEN等[48]研究发现蛋白质乙酰化以及去乙酰化能够调节细胞代谢的进程。李艳莹等[49]为了研究蛋白质去乙酰化酶抑制剂西达本胺对3种B淋巴瘤细胞株的抑制增殖和诱导凋亡的作用及其机制,以不同浓度不同时间处理作用于体外培养的3种B淋巴瘤细胞,结果发现西达本胺能够抑制B淋巴瘤细胞株的增殖从而诱导细胞凋亡,其机制可能与西达本胺上调组蛋白H3、H4乙酰化水平、触发线粒体凋亡途径有关。王晓阳等[50]通过将西达本胺与硼替佐米结合来研究其对套细胞淋巴瘤株增殖的影响,研究发现,西达本胺作为组蛋白去乙酰化酶抑制剂结合蛋白酶体抑制剂硼替佐米共同作用于套细胞淋巴瘤细胞株,可以显著抑制套细胞淋巴瘤株细胞的增殖,并且能够诱导细胞凋亡。以上表明,蛋白质乙酰化对细胞凋亡具有促进作用。
WANG等[51]通过研究蛋白质乙酰化在 32 例微胱氨酸-亮氨酸精氨酸诱导的细胞凋亡和周期阻滞中的作用,结果发现MC-LR能够增强蛋白质去乙酰化酶的活性,而蛋白质乙酰化酶的活性受到抑制,同时,MC-LR诱导睾丸组织损伤,增加了凋亡相关基因Bax、细胞凋亡酶-3(caspase-3)以及细胞凋亡酶-8(caspase-8)的表达,最终导致睾丸组织发生细胞凋亡。MARTEL等[52]和BONORA等[53]研究发现,蛋白质乙酰化能够调节蛋白质分子间相互作用以及蛋白质功能,同时,具有渗透率过渡孔隙复合体(permeability transition pore complex,PTPC)成分的快速乙酰化/去乙酰化在宰后早期可以参与肌肉向肉类转化过程中的细胞凋亡过程。PARK等[54]为研究Hsp70乙酰化介导的凋亡和自噬程序性细胞死亡的机制发现,应激诱导细胞凋亡时,热休克蛋白70(Hsp70)乙酰化可抑制凋亡细胞死亡,Hsp70与凋亡蛋白酶激活因子-1和凋亡诱导因子分别作为细胞凋亡酶依赖性和非依赖性凋亡通路的关键调节因子,结果表明,Hsp70的乙酰化在细胞凋亡途径中发挥关键调控作用,共同使细胞在应激反应中得到保护。吴程程[55]研究发现,家蚕Bm30K-3蛋白具有抗细胞凋亡的活性,试验采用TSA(去乙酰化酶抑制剂)和C646(乙酰化酶抑制剂)研究Bm30K-3的乙酰化水平对其抗凋亡能力的影响。结果表明,乙酰化水平上调后,Bm30K-3蛋白的抗凋亡能力提升,而乙酰化水平下调后,其抗凋亡能力下降,而且抗凋亡活性上调下调的幅度具有显著的差异,表明乙酰化修饰具有提高Bm30K-3蛋白抗细胞凋亡的能力。DAI等[56]研究发现,核转录因子κB(NF-βB)激活由Rel A/p65乙酰化和去乙酰化二者相互调节,并由蛋白质乙酰转移酶和去乙酰转移酶进行调节。通过药理抑制剂或遗传策略来抑制NF-βB,蛋白质去乙酰化酶诱导的凋亡明显增强,并伴有活性氧产生的增强、锰超氧化物歧化酶和X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)的下调,以及c-Jun氨基端激酶 1(JNK 1)的活化。相反,乙酰半胱氨酸(N-acetyl-L-cysteine)通过抑制ROS的生成阻止了磷酸化抑制剂Bay 11-7082(Bay)/蛋白质去乙酰化酶抑制剂(HDACIs)引起的凋亡。以上研究结果表明,蛋白质乙酰化对细胞凋亡具有抑制作用。
JIANG等[18]对宰后猪肉骨骼肌进行乙酰蛋白质谱分析,结果表明,线粒体蛋白被乙酰化,且线粒体通透性转换孔复合体的乙酰化参与了宰后成熟过程中的细胞凋亡。同时发现,在肌肉向肉的转化过程中蛋白质乙酰化水平发生了显著变化,该研究证实了蛋白质乙酰化可能通过调节宰后肌肉细胞凋亡调控肉品质的形成。
综上所述,蛋白质乙酰化对细胞凋亡的调控尚未明确,而且,相关研究多集中在医学领域,而关于宰后畜禽肌肉细胞凋亡的研究仅有猪肉、小鼠肉(动物模型为宰后小鼠肌肉)的报道。因此,通过蛋白质乙酰化调节细胞凋亡进而影响肉品质的研究有待进一步深入。
3 结论与展望
蛋白质乙酰化修饰作为众多生命过程中重要的修饰方式之一,近年来,随着蛋白质组学技术的不断成熟以及生物信息学的不断发展,将蛋白质乙酰化修饰在生命体中的功能逐步被揭示。宰后肌肉的糖酵解、肌肉收缩与细胞凋亡对肉品质的形成具有重要影响。目前研究表明,蛋白质乙酰化对宰后肌肉糖酵解、肌肉收缩与细胞凋亡的的调控具有争议,有待进一步研究,而且,蛋白质乙酰化介导糖酵解、肌肉收缩及细胞凋亡的研究大多集中在医学领域。因此,有必要从蛋白质乙酰化对宰后肌肉糖酵解、肌肉收缩、细胞凋亡的调节深入探究其调控肉品质的潜在机制。

