microRNA-361-5p在人类恶性肿瘤中的研究进展
齐 媛, 郭宝良
(哈尔滨医科大学附属第二医院 乳腺外科, 黑龙江 哈尔滨, 150000)
1 背 景
microRNA(miRNA)是一种非编码RNA, 在进化中高度保守,人类基因2%的miRNA 可通过调控网络影响机体近1/3基因的表达[1]。成熟的miRNA长度通常为18~25个核苷酸,其经典机制主要为通过靶向作用于mRNA的3′非编码区(3′UTR)在转录后水平调控基因表达[2], 抑制蛋白质翻译过程和/或降解靶mRNA, 从而抑制目标基因表达,进而调控细胞凋亡、增殖、分化、代谢及个体发育、肿瘤发生及耐药,发挥miRNA的生物学作用。miRNA的失调与各种癌症的发生、发展密切相关。在一定程度上, miRNA的异常表达会对肿瘤的侵袭、远处转移和化学耐药等方面产生影响。此外, miRNA可作为提示疾病状态的重要生物标志和治疗靶点。
Pre-miR-361位于Xq21.2上,存在于外显子9和10之间的内含子中,并产生成熟miR-361-3p以及miR-361-5p[3], 通常作用于其靶基因血管内皮生长因子A(VEGFA)、GSR、MTR、MTUS1、RAD23B。作者将就miR-361-5p在肿瘤中的特定功能综述如下。
2 miR-361-5p在肿瘤中的功能
肿瘤的生长和转移是一个复杂的生物过程,通常与信号通路失调、分子异常表达相关。因此,对恶性肿瘤敏感性和特异性新生物标志物的鉴别具有重要意义。miR-361-5p作为一种与癌症密切相关的miRNA,在不同肿瘤中作用于不同靶基因和信号通路,调控肿瘤的多种恶性表型。在人类恶性肿瘤中, miR-361-5p的功能及其靶基因见表1。
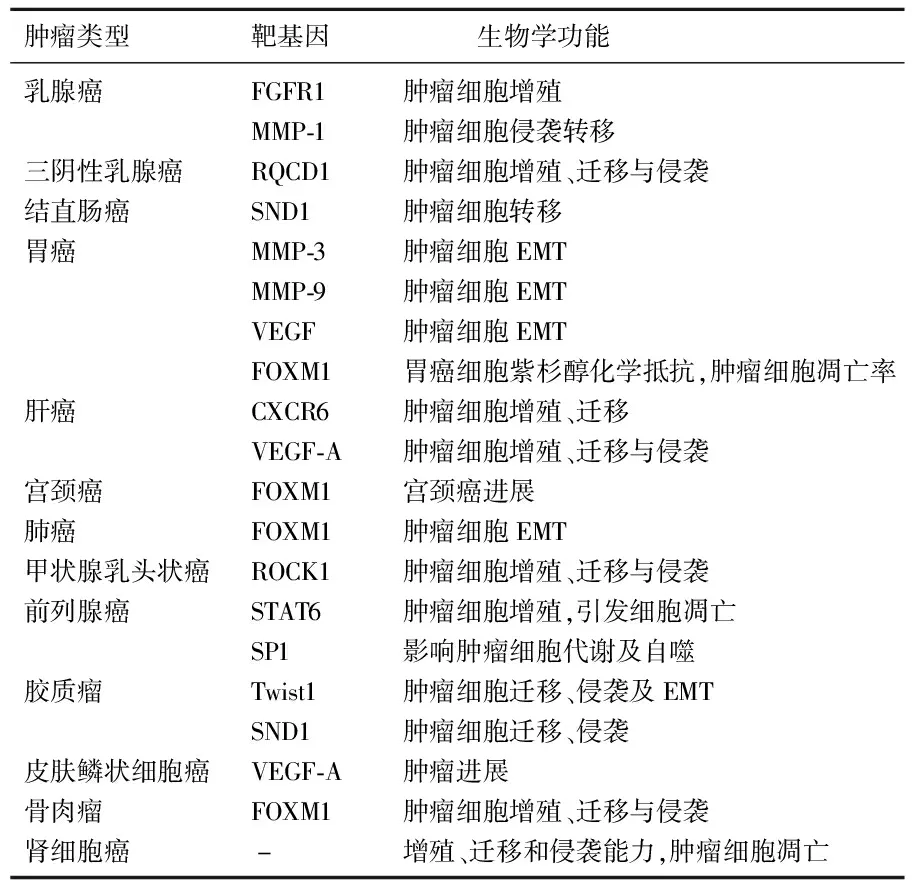
表1 人类恶性肿瘤中miR-361-5p的功能及其靶基因
2.1 miR-361-5p与乳腺癌
乳腺癌为女性最常见的恶性肿瘤[4-5], 具有不同的表型、分子特征及行为异质性。MA F等[6]采用实时荧光定量PCR(qRT-PCR)及ISH检测等方法将乳腺癌组织与正常乳腺组织对比,发现在癌组织中miR-361-5p显著下调。miR-361-5p可通过抑制乳腺癌细胞糖酵解,从而抑制乳腺癌的增殖、侵袭和转移。该研究确认FGFR1为糖酵解相关启动子,并能为靶标被miR-361-5p结合。miR-361-5p过表达后,降低FGFR1 mRNA和蛋白质的表达水平,迫使乳腺肿瘤细胞的糖代谢方式由糖酵解向氧化磷酸化转变,抑制乳腺癌细胞的增殖。此外, miR-361-5p还可靶向抑制转移相关因子MMP-1, 限制乳腺癌细胞的侵袭和转移。临床资料[7]分析表明, miR-361-5p表达与TNM分期呈负相关性。同时, Kaplan-Meier生存分析显示, miR-361-5p高表达的患者具有更好的无病生存率(DFS)。在该实验中,应用LNA探针进行基于组织芯片(TMA)的miRNA检测原位杂交强度半定量miR-361-5p的表达,并统计分析了375例患有浸润性导管癌的女性患者的数据、标本,计算DFS(中位随访96.57个月),结果显示miR-361-5p高表达患者临床结果显著优于miR-361-5p低表达患者(P=0.002), 且miR-361-5p表达与DFS呈正相关, miR-361-5p阳性表达患者疾病复发风险较低。miR-361-5p密度与BC亚型显著相关,而患者年龄、绝经状态、分级、肿瘤大小和淋巴结状态与miR-361-5p表达无显著相关性。
miR-361-5p对三阴性乳腺癌(TNBC)患者的预后价值极为显著[7]。TNBC定义为缺乏ER、PR以及HER2表达的BC。HAN J J等[8]采用qRT-PCR和蛋白质印迹法分析测定TNBC和相邻组织中miR-361-5p及细胞分化1同源物(RQCD1)的表达,结果表明TNBC组织中miR-361-5p和RQCD1均异常表达,与正常组织相比, miR-361-5p的表达在肿瘤组织中显著下调,而RQCD1 mRNA表达上调。荧光素酶报告基因实验证实了RQCD1是miR-361-5p的直接靶点,在乳腺癌细胞系MDA-MB-231中过表达miR361-5p后,抑制EGFR/PI3K/Akt信号通路,进而抑制肿瘤细胞的增殖、迁移和侵袭能力。miR-361-5p的过表达可抑制乳腺癌细胞在体内的增殖、侵袭、转移以及糖酵解,提示miR-361-5p表达水平是乳腺癌预后的独立预测因子,且miR-361-5p及其靶点可作为乳腺癌治疗的新方向。
2.2 miR-361-5p与胃肠道肿瘤
MA F等[9]通过体内和体外实验研究表明,结直肠癌(CRC)组织中miR-361-5p的低表达与肿瘤分期、肺转移及DFS显著相关。CRC细胞中miR-361-5p的过表达可显著抑制CRC细胞的转移。葡萄球菌核酸酶(SND1)作为高度保守和普遍表达的多功能蛋白,可以调节各种细胞内过程。SND1可通过多种方式促进恶性肿瘤侵袭。在生物信息学分析和荧光素酶报告分析中,SND1被鉴定为miR-361-5p的潜在靶标,其3′-UTR中含有miR-361-5p能够识别的靶序列。miR-361-5p可与SND1的3′-UTR结合从而抑制SND1表达,而SND1又可以直接结合pre-miR-361-5p,作为转录因子转录水平下调pre-miR-361-5p的表达,形成一个负反馈调节通路。miR-361-5p相关研究对CRC靶向治疗药物的开发具有重要意义。
胃癌(GC)是世界上最常见的恶性肿瘤之一[10], 相关研究[11]表明上皮间质转化(EMT)在胃癌的肿瘤发生中起重要作用。TIAN L等[12]在胃癌中通过transwell、伤口愈合试验证明, miR-361-5p可靶向作用于基质金属蛋白酶-3(MMP-3)、基质金属蛋白酶-9(MMP-9)和血管内皮生长因子(VEGF),同时可调控Wnt/β-catenin信号通路,抑制肿瘤细胞EMT。此外,研究发现miR-361-5p在胃癌细胞中的表达量与TNM分期呈正相关。另外, miR-361-5p的过表达也可显著影响裸鼠异种移植肿瘤体积和体质量。
WU R R等[13]应用双荧光素酶基因报告系统对183例胃癌患者组织核酸片段进行分析,发现CD80基因的mRNA 3′-UTR端具有miR-361-5p的特异性结合位点,而该段序列中存在单核苷酸多态性位点(SNP)(rs1599795), 其与胃癌复发风险显著相关。rs1599795中TA基因型通过稳定miR-361-5p等miRNA在CD80mRNA中的结合位点,降低CD80表达,促使胃癌发生发展。
在胃癌治疗中,手术联合化疗是改善患者预后的常用方法之一。多西紫杉醇是一种较常用的化疗药物,抑制GC中对多西紫杉醇的化学抵抗可能是改善GC治疗效果的关键一环。FOXM1作为一种特异性增殖致癌转录因子,可调节微管动力学,介导肿瘤细胞的化学耐药。相关研究[14]通过生物信息学研究和荧光素酶报告基因检测等方法,确认miR-361-5p能够与FOXM1 mRNA特异性结合,并降低其表达,同时作用于参与自噬调节的PI3K/Akt/mTOR信号通路。过表达miR-361-5p可抑制胃癌细胞的紫杉醇化疗抵抗,降低紫杉醇药物的半数致死有效剂量,增高细胞的凋亡率。该实验对miR-361-5p在化疗抵抗中的作用进行了较为深入的基础研究,但缺少临床样本验证,仍需进一步深入研究。
2.3 miR-361-5p与肝癌
miR-361-5p在肝癌中可抑制肿瘤增殖, SUN J J等[15]采用qRT-PCR等方法证实,与正常组织相比, miR-361-5p在肝细胞癌(HCC)组织中表达下调,其原因是pre-miR-361的启动子区存在过度甲基化。体内、外实验均证明miR-361-5p可通过作用于靶标趋化因子受体6(CXCR6)抑制肿瘤细胞的生长。因此,这种启动子区甲基化导致的miR-361-5p表达下降与肝癌的肿瘤增殖、迁移有关。
miR-361-5p在肝癌细胞中增殖、侵袭对其产生影响也得到了进一步验证。VEGFA通常在HCC中上调,并促进HCC的进展, CUI W X等[16]通过逆转录聚合酶链式反应(RT-PCR)分析证实了miR-361-5p在丙型肝炎病毒(HCV)相关肝癌患者中显著下调, miR-361-5p与VEGF-A的3′-UTR存在互补性, miR-361-5p可与靶标VEGF-A直接结合,并负调节其表达。荧光素酶报告分子测定评估及蛋白质印迹试验验证了miR-361-5p的表达与VEGF-A高度相关,miR-361-5p表达减少或缺失可增加VEGFA含量,从而对HCC的增殖、迁移和侵袭起到促进作用。因此, miR-361-5p可作为潜在治疗HCC的新靶点。
2.4 miR-361-5p与宫颈癌
宫颈癌(CC)是全球女性中第2高发的恶性肿瘤[17]。GAO F等[18]发现长链非编码RNA(lncRNA)SBF2-AS1在宫颈癌组织中表达升高,且lncRNA SBF2-AS1能够在体内、外实验中促进宫颈癌的增殖和转移。miR-361-5p可作为内源性竞争性非编码RNA, 与lncRNA SBF2-AS1相互作用,竞争性拮抗miR-361-5p对下游靶基因FOXM1的调控作用,促进宫颈癌的进展。
WU X M等[19]研究结果与上述结论不同,并提出miR-361-5p的过表达可导致人类宫颈癌进展的假说。MTT比色法表明miR-361-5p上调时,宫颈恶性肿瘤细胞生长速率显著增高。细胞侵袭测定也显示miR-361-5p过表达可使宫颈恶性肿瘤细胞表现出更高的侵袭性。地高辛标记的抗miR-361-5p核酸探针原位杂交表明, miR-361-5p表达增加与宫颈癌通过EMT过程进展相关。Matrigel-Transwell、蛋白质印迹法和qRT-PCR等试验均证明miR-361-5p介导的Wnt/β-catenin信号传导诱导宫颈癌细胞EMT。miR-361-5p过表达导致人类宫颈癌进展。因此miR-361-5p被证明是治疗宫颈癌EMT进展的有效靶点。
2.5 miR-361-5p与其他肿瘤
肺癌作为最常见的癌症类型,其进展与miR-361-5p的表达相关。miR-361-5p的过表达可抑制肺癌细胞的增殖和侵袭。HOU X W等[20]通过试验验证了miR-361-5p通过靶向作用于FOXM1,抑制EMT表型以抑制肿瘤进展。
甲状腺乳头状癌(PTC)是内分泌器官中常见的恶性肿瘤,一些PTC患者表现出侵袭性行为,导致预后不良[21-22]。LI R等[23]通过qRT-PCR、生物信息学分析、双荧光素酶报告基因测定证实miR-361-5p表达水平在PTC中显著下调,过表达的miR-361-5p通过靶向作用于Rho相关的卷曲螺旋激酶1(ROCK1)来抑制肿瘤细胞增殖、迁移、侵袭。miR-361-5p的表达量与TNM分期、PTC淋巴结转移密切相关。
miR-361-5p在前列腺癌(PCa)中可预防雄激素依赖性前列腺癌(ADPC)向去势抵抗性前列腺癌(CRPC)的进展,表现为miR-361-5p在CRPC组织中表达显著低于ADPC组织,miR-361-5p直接作用于靶标信号转导和转录激活因子-6(STAT6),其过表达降低了STAT6/Bcl-XL信号转导途径的表达,抑制细胞增殖并促进细胞凋亡,减缓PCa的恶性进展[24]。转录因子特异性蛋白1(Sp1)在PCa进展中具有重要作用,包括影响细胞增殖、分化、凋亡,迁移、侵袭和血管生成,是治疗癌症的理想靶点[25-26]。LING Z X等[27]证明miR-361-5p在预防PCa恶性进展方面发挥重要作用。敲低Sp1可显著抑制细胞生长、有氧糖酵解和缺氧诱导的自噬, miR-361-5p可通过直接作用于Sp1的3′-UTR的结合位点来抑制Sp1/PKM2轴,从而影响PCa细胞代谢和自噬,并影响PCa的进展。
miR-361-5p在胶质瘤组织和细胞系中显著降低[28]。miR-361-5p可显著抑制胶质瘤细胞迁移、侵袭和EMT。miR-361-5p通过靶向作用于EMT的关键诱导剂Twist1,调节Twist1/Bmi-1信号轴而抑制胶质瘤的进展。LIU J等[29]应用免疫组化、蛋白质印迹法、双荧光素酶报告基因测定法等试验也验证了miR-361-5p对胶质瘤细胞迁移和侵袭起抑制作用。miR-361-5p直接靶向作用于SND1, 从而影响MMP-2基因转录,进而抑制胶质瘤迁移和侵袭。同时miR-361-5p表达下调与胶质瘤分级呈负相关。
在皮肤鳞状细胞癌(SCC)中, miR-361-5p通过靶向作用于VEGFA发挥抑癌作用[30]。SHEN B等[31]研究表明LncRNA MEG3/miR-361-5p/FOXM1信号轴可显著影响骨肉瘤细胞增殖、迁移、侵袭和运动,证实其可作为潜在的骨肉瘤的治疗靶标。
miR-361-5p过表达可显著抑制肾细胞癌(ACHN)细胞的增殖、迁移和侵袭能力,并诱导肿瘤细胞凋亡,但相关机制还需要进一步探索[32]。
3 结论和前景
肿瘤侵袭、转移、疾病复发和耐药已被确定为恶性肿瘤的典型标志,并且是癌症患者临床治疗效果不佳的主要原因[33-34]。miR-361-5p的表达为独立预测因子,其异常表达与众多恶性肿瘤的进展存在关联。miR-361-5p在多种人类恶性肿瘤中表达失调, miR-361-5p在恶性肿瘤细胞增殖、凋亡、转移及耐药性方面发挥作用。miR-361-5p通过不同靶基因调控疾病进展,具有促进或抑制肿瘤进展的功能,且在相同恶性肿瘤中可能具有不同的作用机制[18-19]。作者认为各研究的差异可能与所使用的细胞系或实验方法相关,研究之间样本量的差异也可能会造成相反的实验结果,需要在更大的群体中进行研究以揭示miR-361-5p在肿瘤中的确切作用,并且进一步验证miR-361-5p的可能效用。
本综述通过对miR-361-5p功能及作用机制进行总结,强调了miR-361-5p的表达可作为判断肿瘤预后的生物标志物,有望进一步确定其成为生物学治疗的重要靶标及潜在及临床应用的可能性。但miR-361-5p的多因素生物学功能尚未得到充分证明, miR-361-5p靶向治疗的应用还有待于继续研究。

