慢性冷热应激对放牧西门塔尔牛抗氧化功能及HPA轴、SAM轴激素分泌的影响
陈 浩,敖日格乐,王纯洁,斯木吉德,超 克,刘 波
(1.内蒙古农业大学 动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018)
应激是动物机体对各种刺激所产生的非特异性应答反应的总和,根据应激源的不同可分为热应激、冷应激、运输应激及断奶应激等[1]。目前,因环境温度的变化所引起的冷热应激常导致畜禽在实际生产中出现繁殖力降低、生产性能下降及免疫功能降低等问题,这严重制约了我国畜牧业的健康快速发展[2-4]。当动物所处环境温度大于等热区中的舒适区的上限时将引起动物产生热应激,可通过动物机体自身的生理指标如直肠温度和呼吸频率来判定奶牛是否处于热应激状态。温湿指数(THI)作为综合环境温度和湿度的外界环境参数也能判断动物是否处于热应激状态,有研究指出当THI大于72时,奶牛处于热应激状态[5]。目前关于冷应激的研究主要集中于冷应激对动物机体所产生的影响,并无明确定义,有研究报道在无风环境下,温度下降至-6.8℃ 时欧洲牛处于冷应激状态[6]。由温度刺激引起的冷热应激可根据应激持续时间分为急性和慢性,其中急性冷热应激是指机体短时间处于高温或低温环境,慢性冷热应激通常是由于季节变化导致机体长时间处于高温或低温环境,机体已经暂时适应环境之后的冷热应激状态,无论是急性还是慢性冷热应激都会对畜禽的生理功能和营养代谢等造成一定影响,并给畜牧业带来巨大的经济损失[7]。
应激可导致机体抗氧化酶系统受损,大量自由基无法被及时清除而堆积引起机体氧化-抗氧化失衡,机体发生氧化应激反应进而引起疾病的发生[8]。钟光等[9]报道,持续热应激显著降低了黄羽肉鸡血清中SOD及肝脏中GSH-Px活性;张燕等[10]研究发现冷应激状态下荷斯坦奶牛血清中MDA含量显著增多;近年来,有大量研究报道,热应激可降低绵羊和山羊血清中SOD和T-AOC活性,导致动物机体抗氧化功能受损进而诱导机体产生氧化应激[11-13]。当动物处于冷热应激状态时,可通过降低或增加呼吸频率从而有效减少或增加呼吸排出的热量。蔡明成[14]的研究表明,热应激状态下肉牛的呼吸频率增加了17.6次/min;王祖新等[15]研究发现低温可显著降低奶牛的呼吸频率。肾上腺是对环境温度极其敏感的动物机体内分泌腺,去除肾上腺的动物在遭受过强应激时易衰竭死亡[16]。有研究指出,仔猪血清中ACTH含量随着冷应激持续时间的延长而升高[17]。应激可使机体交感神经兴奋,井霞[18]研究发现冷热应激可显著提高荷斯坦奶牛血清中EPI含量以提高机体的抗应激能力。目前,国内外关于冷热应激的研究较少,放牧环境下肉牛冷热应激相关研究鲜有报道。因此,本研究拟以放牧西门塔尔牛为试验群体,探讨慢性冷应激对放牧西门塔尔牛抗氧化功能和HPA轴、SAM轴激素分泌的影响,旨在为放牧牛抗冷热应激、抗病及冷热应激相关研究提供理论基础。
1 材料与方法
1.1 试验动物及饲养管理以内蒙古锡林郭勒盟苏尼特左旗某家庭牧场提供的60头体质健康、体质量相近的西门塔尔牛为试验动物。试验牛群饲养管理一致,采用散栏式饲养,日粮公司统一配制,每日早和晚饲喂2次,自由饮水。
1.2 试验时间及地点试验在内蒙古锡林郭勒盟苏尼特左旗某家庭牧场进行。试验分3个阶段进行:春季(2018年4月)、夏季(2018年6月)和冬季(2017年12月)。
1.3 环境温湿度测定由于试验是以在天然草场进行全年放牧的肉牛为研究对象, 所以所测的环境指标均为自然环境下的温度、相对湿度和风速。试验期间, 测定每天8:00、14:00以及20:00的天然放牧草场的温度和相对湿度, 并监测计算试验当月的平均风速和日照时间。
1.4 血样采集在试验期最后一天清晨对每头试验牛进行颈静脉采血。采用非抗凝采血管采集10 mL 血液,静置30 min后3 000 r/min离心15 min,分离制备血清,分离的血清立即置于液氮中带回实验室,保存于-80℃冰箱中用以测定血液生化指标。
1.5 生理指标及血液指标测定试验期间,测定每日8:00、14:00和20:00时试验牛的呼吸频率和直肠温度。呼吸频率:观察试验牛安静休息时胸廓及腹部的运动,用秒表计时器连续测定10 min。直肠温度:用兽用体温计测定。
血清中促肾上腺皮质激素(ACTH)、胰高血糖素(GC)、去甲肾上腺素(NE)和肾上腺素(EPI)含量测定采用酶联免疫分析法,试剂盒均购自北京华英生物技术研究所,测定方法按照试剂盒说明书进行操作。血清中丙二醛(MDA)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)活性测定采用酶联免疫分析法,试剂盒均购自南京建成生物工程研究所,测定方法按照试剂盒说明书进行操作。

2 结果
2.1 不同季节放牧草场温湿度及综合指数(CCI )不同季节牛舍温湿度及CCI的测定结果见表1。在各试验阶段中,草场上平均温度夏季最高为27.70℃,其次是春季为13.80℃,冬季最低,为-15.49℃;平均相对湿度夏季最高为69.40%,其次是春季为57.70%,冬季最低为31.50%;平均CCI值夏季最高为28.40,其次是春季为14.90,冬季最低为-9.70 。
2.2 不同季节放牧西门塔尔牛直肠温度及呼吸频率的测定结果不同季节西门塔尔牛生理指标的测定结果见表2。结果显示,试验牛的呼吸频率及直肠温度夏季最高,冬季最低。春季直肠温度及呼吸频率分别为38.26℃和28.11次/min,均处于正常水平。直肠温度及呼吸频率夏季显著高于春季和冬季(P<0.05),春季显著高于冬季(P<0.05)。

表1 不同季节牛舍温湿度及CCI

表2 不同季节西门塔尔牛直肠温度及呼吸频率
2.3 不同季节西门塔尔牛血清抗氧化指标的变化不同季节西门塔尔牛血清抗氧化指标变化如表3所示。结果显示,试验牛血清中MDA含量夏季和冬季均显著高于春季(P<0.05),夏季与冬季之间差异不显著(P>0.05);T-AOC含量春季与夏季显著高于冬季(P<0.05),夏季与春季之间差异不显著(P>0.05);GSH-Px含量在3个季节之间差异不显著(P>0.05);SOD含量春季显著高于夏季和冬季(P<0.05),且冬季显著高于夏季(P<0.05)。

表3 西门塔尔牛血清抗氧化相关指标
2.4 不同季节西门塔尔牛血清中HPA及SAM轴激素分泌变化不同季节西门塔尔牛血清中的HPA及HPT轴激素分泌测定结果见表4。结果显示,西门塔尔牛血清中ACTH、GC、GCG、GLU含量冬季显著高于夏季和春季(P<0.05),春季显著高于夏季(P<0.05);NE含量夏季和冬季均显著高于春季(P<0.05),夏季与冬季之间差异不显著(P>0.05);EPI含量夏季和冬季均显著高于春季(P<0.05),冬季显著高于夏季(P<0.05);INS含量夏季显著高于冬季和春季(P<0.05),春季显著高于冬季(P<0.05)。
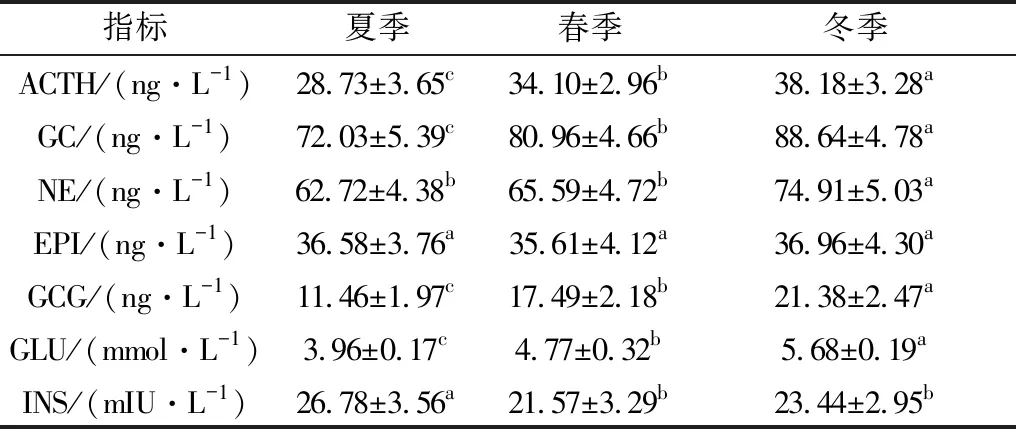
表4 西门塔尔牛血清中HPA轴及SAM轴激素水平
3 讨论
3.1 慢性冷热应激对西门塔尔牛直肠温度及呼吸频率的影响肉牛热应激是由环境温度、湿度、空气对流及自身产热等多种因素引起的,其中环境温湿度是最主要的影响因素,因此综合了环境温湿度、风速及日照时间的CCI是判断放牧条件下肉牛是否遭受热应激的重要指标[19]。一般认为当CCI大于25时肉牛处于热应激状态,小于0时处于冷应激状态;奶牛最适宜温度为-0.5~20.0℃,肉牛生长适宜温度是5~25℃[20-22]。本试验研究结果显示,春季试验期牧场平均温度为13.80℃,CCI为14.90,均未达到牛产生热应激的临界值;夏季试验期草场平均温度为27.70℃,CCI达到28.40,已超出牛产生热应激的临界值,试验牛处于热应激状态;冬季试验期,草场平均温度为-15.49℃,最低气温至-21.40℃,远低于奶牛泌乳和肉牛生长的适宜温度,因此试验牛在冬季遭受冷应激。本试验因此根据冷热应激反应的持续时间,判定春季试验期为非冷热应激期,冬季和夏季为慢性冷热应激期。
热应激刺激机体引起交感神经兴奋进而导致体温升高,机体通过增加呼吸频率以加快散热;而当动物处于冷应激状态时,机体最主要的生理反应是通过自主神经和神经内分泌双重调节增加产热以维持恒定体温[23-24]。奶牛安静状态下呼吸频率为18~28次/min,正常体温为38.00~39.17℃[25]。SRIKANDAKUMAR[26]等和CORREA-CALDERON等[27]研究发现,热应激状态下荷斯坦奶牛的呼吸频率和直肠温度均极显著升高(P<0.01)。BERMAN等[28]的研究结果显示,当牛舍温度超过25℃时,荷斯坦奶牛的呼吸频率上升到50~60次/min。魏学良等[29]报道,在6-9月份奶牛的呼吸频率和直肠温度显著高于3-5月份(P<0.05),10月份至来年2月份奶牛的呼吸频率和直肠温度显著低于3-5月份。本试验研究发现,西门塔尔牛呼吸频率和直肠温度在春季处于正常范围内,冬季显著低于春季且夏季显著高于春季,这表明在遭受热应激刺激时,西门塔尔牛通过增加呼吸频率以加快机体散热,但是当通过增加呼吸频率无法调节时,则表现为直肠温度升高;随着冷应激持续时间的延长,西门塔尔牛通过自身调节可能无法有效缓解寒冷应激,其直肠温度和呼吸频率显著低于非冷热应激状态下的水平。
3.2 慢性冷热应激对西门塔尔牛抗氧化功能的影响动物在正常生长代谢过程中会产生含氧自由基,若不能被及时清除,体内积累的自由基可通过破坏细胞的结构和功能,使生物膜中的不饱和脂类发生脂质过氧化并形成脂质过氧化物,其最终产物即是MDA[30]。动物机体自身具有广泛的抗氧化防御机制,哺乳动物体内抗氧化防御机制包括酶促体系和非酶促体系两大抗氧化防御体系,酶促体系中的主要抗氧化酶有T-AOC、GSH-Px及SOD[31]。GSH-Px可通过清除体内过多的自由基以抑制机体脂质过氧化;SOD是机体内一种重要的抗氧化酶,在清除自由基和防止生物大分子损伤等方面具有重要作用;T-AOC代表机体防御体系的抗氧化能力[32-34]。由于抗氧化酶系统不断地清除体内产生的自由基,从而保护机体在正常生长代谢过程中免受氧化应激损伤。
当动物遭受应激时,其抗氧化酶系统平衡被打破,机体需耗费大量的抗氧化酶来消除过多的自由基[35]。王玲等[36]研究发现,夏季肉牛血清中T-AOC、GSH-Px及SOD活性较春季显著降低,MDA含量极显著升高(P<0.01)。杨笃宝等[37]通过研究热应激对荷斯坦奶牛的影响,也进行了类似的报道。吴秀群等[38]报道热应激状态下,奶牛血清中MDA含量显著升高,SOD和GSH-Px活性极显著(P<0.01)和显著下降。本试验研究发现,热应激状态下西门塔尔牛血清中MDA含量相较于非应激状态显著升高,T-AOC和SOD活性显著降低。由于热应激可以导致动物内脏组织缺氧进而诱导自由基的产生量增加。为清除体内产生的过多自由基,西门塔尔牛血清中SOD被大量消耗,进而加快机体组织的脂质过氧化,导致其终产物MDA含量同样显著升高,西门塔尔牛体内抗氧化酶系统平衡因此被打破,导致其T-AOC显著下降,这些均表明慢性热应激对西门塔尔牛机体造成了一定的氧化损伤。近年来,大量研究表明,冷应激能够对雏鸡、大鼠及蛋鸭造成氧化损伤[39,40-41]。张燕等[10]研究发现,冷应激使荷斯坦奶牛血清中T-SOD和CuZn-SOD活力显著降低,MDA含量显著升高。孟祥坤等[42]报道,在舍内平均温度为-4.0℃时,西门塔尔杂交犊牛血清中SOD和GSH-Px活性显著降低,MDA含量显著升高。本试验研究发现,冷应激状态下西门塔尔牛血清中MDA含量显著高于非应激状态,T-AOC含量有升高的趋势,SOD活性显著下降,但GSH-Px活性无显著变化。这可能是由于冷应激破坏了西门塔尔牛体内抗氧化酶系统平衡,导致自由基产生过量,MDA含量显著升高,为清除体内过量的自由基而SOD被大量消耗导致其活性下降;冷应激状态下西门塔尔牛血清中T-AOC含量相较于非应激状态有升高的趋势,可能是随着冷应激持续时间的延长,西门塔尔牛机体逐渐适应低温环境,导致T-AOC代偿性升高,进一步保护机体免受氧化损伤,但其代偿性升高的作用机制有必要进行深入研究。
3.3 慢性冷热应激对西门塔尔牛HPA轴及SAM轴激素分泌的影响机体内分泌系统通过多种激素调控机体的生理机能以维持内环境的恒定,当动物受到外界刺激产生应激时,机体SAM轴被激活,引起交感神经兴奋进而刺激肾上腺髓质增强合成及释放NE、EPI及DA,以提高机体对应激的适应能力[43]。NE是由肾上腺髓质神经末梢释放的神经递质,其分泌量随交感神经兴奋的增强而增加。EPI是一种由肾上腺释放的激素,其含量的变化与HPA轴激活与否相关[44]。当SAM轴不能有效调节机体应激时,HPA轴将被激活,HPA轴激素适度分泌有利于机体抵抗应激,但持续被激活HPA轴的动物将处于亚病理状态,严重时可导致动物产生病理变化[45]。冷热应激激活HPA轴,下丘脑释放促肾上腺皮质激素释放激素(CRH)促使垂体分泌ACTH进而激活肾上腺皮质分泌和释放GC,GC通过负反馈调节垂体分泌ACTH。ACTH的主要生理功能是促进肾上腺皮质发育并调控GC的合成与分泌。肾上腺是动物体内对温度较敏感的内分泌腺,去除肾上腺的动物抗应激能力显著下降,遭受强烈应激时易衰竭死亡[46]。有研究发现高温环境可引起肾上腺交感神经兴奋,促进EPI分泌增加进而升高GLU;近年来,对小鼠的冷应激相关研究表明,冷应激状态下小鼠的HPA和SAM轴被激活进而促进ACTH的分泌[47-48]。胡丽蓉等[49]通过研究冷热应激对荷斯坦奶牛血液生化指标的影响,结果表明与非应激状态相比,热应激状态下奶牛血清中NE含量极显著下降,冷应激状态下ACTH含量分别呈显著下降和极显著下降(P<0.05)。吕晓伟[6]研究发现,冷热应激状态下泌乳奶牛血清中EPI含量相较于非应激状态分别升高了7.61和5.63倍,这表明在冷热应激期间SAM轴起着重要作用。GC主要调控动物机体的内分泌及代谢以维持内环境的稳定,可增强肝糖原异生和糖原贮备;GCG可利用自身较强的糖异生和分解作用引起GLU升高;INS可通过调节GLU在机体内的合成和转化作用以维持血糖稳定[50]。有研究报道热应激状态下奶牛血液中INS浓度显著降低[51]。但ITOH[52]研究发现,热应激显著提高了泌乳奶牛血清中INS浓度,并降低GC浓度。本试验研究结果表明,与非应激状态相比,冷应激状态下西门塔尔牛血清中ACTH、GC、NE、GCG和GLU含量均显著升高,INS水平显著降低,EPI含量差异不显著;与非应激状态相比,热应激状态下西门塔尔牛血清中ACTH、GC、GCG和GLU含量显著下降,INS含量显著升高,NE和EPI含量差异不显著。 这表明在冷应激时,西门塔尔牛SAM轴迅速被激活引起交感神经兴奋, NE分泌增多,进而导致GCG的糖原分解作用增强,GLU含量升高为机体提供能量,以提高牛机体应对低温应激的能力,且由于冷应激持续时间较长,西门塔尔牛HPA系统被激活,ACTH含量升高引起GC分泌增多,GC主要功能是增强糖异生进而升高血糖为机体提供能量,最终提高西门塔尔牛的抗寒能力;热应激期间,GLU含量下降可能是由于西门塔尔牛机体利用GLU供能以加快外周循环增强散热,随着热应激持续时间延长,西门塔尔牛HPA轴被激活,引起GC分泌量增加,GC对下丘脑和垂体前叶具有负反馈抑制作用,可能通过负反馈抑制作用降低了ACTH分泌量,但其具体作用机制需进行下一步深入研究。
总之,冷热应激对内蒙古锡林郭勒草原放牧西门塔尔牛的正常生理指标均产生了显著影响,机体通过神经内分泌系统的HPA轴及SAM轴分泌的主要激素调节生理功能以维持内环境稳定。冷热应激状态下西门塔尔牛组织细胞遭受损伤,导致体内自由基蓄积过多,血清中MDA含量显著升高,T-AOC和SOD活性显著下降,体内抗氧化酶系统遭受破坏。

