二氧化氯稳定性相关基本性质及影响因素综述
刘宇鹤,吴明松,王欣舒,黄楠楠,周秀艳
(1.东北大学资源与土木工程学院,辽宁沈阳110819;2.东北大学秦皇岛分校资源与材料学院;3.秦皇岛市节水治污与生态修复重点实验室)
二氧化氯(ClO2)是一种高效、广谱、安全、pH适用范围广的氧化剂和消毒剂。ClO2在低浓度(<10 mg/L)下的杀菌、消毒作用主要以氧化的方式进行。在常见环境下,ClO2可有效氧化去除锰、氰化物、硫化物、苯酚和有机物,杀死病毒、细菌、原生生物、藻类、真菌和各种孢子及孢子形成的菌体[1],同时具有安全无残留、不产生“三致作用(致癌、致畸、致突变)”的有机氯化物、可持续消毒等优点[2],已成为氯系消毒剂(氯气、氯氨、次氯酸钠、次氯酸钙)的理想替代品。目前,ClO2已广泛应用于造纸制浆的漂白、饮用水处理、畜牧养殖、食品保鲜、医疗消毒以及农业种植土壤消毒[3]等领域。
传统的稳定性ClO2溶液是将ClO2气体通入过氧化物(过碳酸钠、过硼酸钠)水溶液或碳酸钠-过氧化氢复合吸收液等吸收制得,将ClO2转化为亚氯酸根,使用时再加酸活化[4],本质上该类产品并不含ClO2,只能属于二氧化氯释放剂。也有人尝试用有机络合剂稳定水溶液中的ClO2分子[5],但是该方法稳定性相对较差,稳定机理及ClO2的释放过程还需要进一步研究。而以特定pH 下的或亚氯酸作为稳定剂,目前质量浓度最高只能做到约500 mg/L。在新冠肺炎疫情期间防疫需求的刺激下,免活化即用型ClO2消毒剂成为研发热点,而这必须建立在对ClO2化学的基础研究充分认识的基础上。但是,近20年,由于市场及准入等原因,ClO2的产品开发以满足现场制备需求的发生器为主,基础研究主要集中在制备方法上。ClO2稳定机理的研究存在断档,自20 世纪90年代起发表的ClO2基本化学性质的研究迄今仍未得到系统整理。笔者以影响因素为线索,综述与ClO2稳定性相关的性质、反应机理等研究成果,为ClO2稳定产品的开发与应用提供参考。
1 ClO2 的基本性质
ClO2熔点为-59℃,沸点为10℃,凝固点为-59℃。25 ℃时ClO2基本热力学参数为ΔG⊖=12.351 kJ/mol、ΔS⊖=104.67 kJ/mol、ΔH⊖=104.6 kJ/mol[6],溶 解 热 为27.61 kJ/mol。ClO2易溶于水、冰醋酸、四氯化碳等溶剂,在水中以分子形式存在,不易被水解。ClO2在35 ℃的分配系数为21.5。在室温、101.325 kPa 压力(常压)下,ClO2的溶解度可达到3.1 g/L。但是,ClO2溶于水后不稳定,受pH、光照和温度的影响易发生歧化和光解。
ClO2有两种异构体:对称、稳定的OClO 和不对称、具有反应性的ClOO(又称为氯超氧自由基)。OClO 基态呈扁长不对称形状,顶端键长re(ClO)=0.147nm、键角为117.4°,基态基本振动频率ν1=946cm-1(对称拉伸)、ν2=448 cm-1(弯曲)、ν3=1110 cm-1(不对称拉伸)[7]。ClOO 平衡几何形状的键角为110°,伸长的Cl—O 键为0.183 nm、O—O 键为0.123 nm,与游离O2分子相似。其红外光谱对称拉伸和弯曲振动频率分别为373、407 cm-1,不对称拉伸的振动频率为1441、407、373 cm-1,用 于 计 算 的 振 动 频 率 为181.2、390.8、1505.6 cm-1[8]。
尽管ClOO 异构体的电子基态比OClO 低约16.75 kJ/mol,虽然其在热力学上比OClO 更稳定,但是其在动力学上却更不稳定,更容易离解成Cl 和(见图1)。解离既可以保持C2ν对称性,也可以不对称的方式进行,ClOO 可能作为反应中间体。基质隔离实验和理论计算表明,ClOO 的活化能低于Cl 和O2对称解离后的活化能,所以OClO 更容易转化为ClOO。OClO—ClOO 异构化反应的活化能在空气中为62.8 kJ/mol,在 水 溶 液 中 为50.24 kJ/mol[7]。在666.5~6665.0 Pa 下,质量分数为1%~10%的OClO在Ar 中的激波实验表明,OClO 经诱导会热分解成活化能为64.53 kJ/mol[8]。
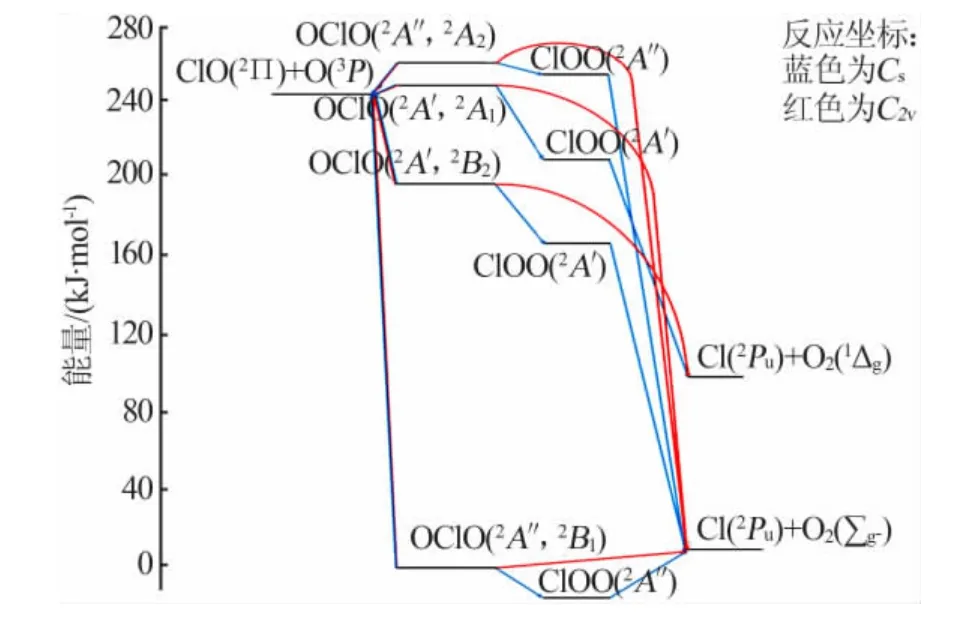
图1 OClO 反应性的轨道图[7]
2 pH 和电子活度对二氧化氯稳定性的影响
pH 对ClO2溶液稳定性的影响强于温度、 光照等因素,pH=6 时最稳定。ClO2表现出趋于强酸环境而保持自身稳定的趋势[10]。在5 ℃、pH=2 条件下30 d后ClO2仅衰减5%[11],在pH=7 时60 d 后ClO2可衰减34%[12],而pH=10 时1 d 后就可衰减30%。pH>9 时ClO2会更容易发生歧化生成和(氯酸根):
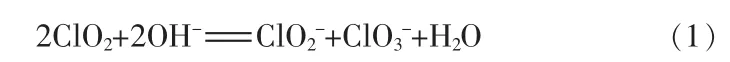
ClO2浓度较低时不同pH 下歧化形成ClO3-的量基本不变,但是ClO2-的量随着pH 的下降而增大[13]。当ClO2浓度很高时(>6 g/L),歧化作用主要生成Cl-和反应方程式:

ClO2在碱性溶液中的歧化存在中间产物HO·[14],且随着初始浓度的升高而增强。ClO2在mmol/L 级或更高浓度下产生同等物质的量的和但在μmol/L 级浓度下将明显多于动力学研究表明,有3 种歧化途径都存在OH-参与的电子转移步骤,对于[OH-]均为一级反应,但是对于[ClO2]的级数却不相同[15](见图2)。途径1,对于[ClO2]为一级反应。ClO2在中性水溶液中的分解相当慢,但是在碱性条件下分解加速:
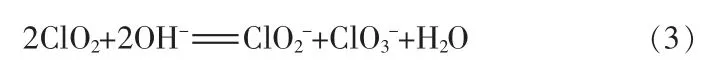
该歧化反应在19℃的速率常数为15.3mol-2·s-1·L,速率方程:

途径2,对于[ClO2]也是一级反应,但是只生成唯一的含氯产物该途径主要在低浓度的ClO2溶液(约为74 μmol/L)中发生。机理可能是ClO2氧化了溶剂,OH-对ClO2中氧原子的攻击生成过氧化物中间体,并最终生成和O2:
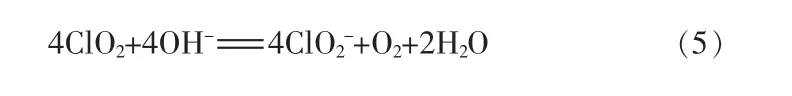

图2 二氧化氯解离的3 种可能途径
途径3,对于[ClO2]是二级反应,发生在高浓度ClO2溶液中,产生等量的和还可能有中间体Cl2O4。
ClO2在酸性溶液中歧化比在碱性条件下缓慢,降解率≤3%/d[12]。在pH=6 时ClO2溶液相对最稳定。田朝晖等[10]认为在碱性水溶液中ClO2歧化产物主要是和其次是Cl-、OCl-和Cl2。裴元生等[16]总结了电子活度(p ε)和pH 对ClO2稳定性的影响,认为实际上可能直接生产出纯净ClO2水溶液。p ε-pH 平衡图显示,ClO2稳定区的下边界与水稳定区的上边界平行,因此即使在绝对高的酸度下水溶性ClO2依然不能稳定存在,仅可在强酸介质中优势存在。当pH 小于0.92 时,ClO2与Cl2(aq)在p ε-pH 图中有共存边界,这可以解释Cl2从ClO2溶液释放的现象。在pH 介于0.92~9.68 时,ClO2能与Cl-共存,因此ClO2水溶液必然含有Cl-。质子数和电子数增加都不利于ClO2稳定,当溶液中质子数增加时ClO2向Cl-或Cl2(aq)转化,当溶液中电子数增加时ClO2向Cl-或Cl2(aq)或转化。
3 光对二氧化氯稳定性的影响
量子化学计算和光谱实验表明,二氧化氯(OClO)的光反应性强烈依赖于介质(气相、液体溶液或低温基质)[7]。ClO2光解的最终产物为和纯气态ClO2在30 ℃开始以一定速率分解,在50 ℃时爆炸性分解为Cl2和O2。
3.1 气相
基态OClO 产生的Cl 是自旋轨道激发态的5 倍,在362 nm 处的量子产率为0.15±0.10[18],在436 nm处的量子产率为0.20,在405 nm 处则上升为1.0[19]。OClO 的光解反应可以通过两个反应路径产生Cl[9]:

途径(6)通过OClO 光致异构化到ClOO,可以在基态A′或第一电子激发态A″产生。途径(7)是产生Cl+O2(1Δg)的对称解离(沿着C2ν反应坐标),可通过产物中氧分子的电子状态区分这两种途径。OClO激发时键角减小(117°至107°)、键长增加(0.147 nm至0.163 nm)。并且发现弯曲和非对称拉伸模式都可促进激发[20],(8)~(10)的激发态反应为反应的量子产率相对较低,并且仍然存在争议。光碎片研究证实了反应(11)是气相中发生的主要过程。液体溶液中OClO 的光解与气相相似,主要产物为ClO+O[21]。用λ≥395 nm 的可见光照射基质分离的单体OClO,可将其定量转化为ClOO,一小部分基质分离的OClO范德华二聚体光解后产生副产物ClOClO3、ClOClO2和ClOClO。无定形冰中ClO2的光化学研究结果表明[22]:将溶解在冰中的OClO 稀释混合物暴露于360 nm 紫外光下,OClO 可定量转化为ClOO。与气相相反,这个过程不生成ClO 自由基。根据平流层中冰粒吸收OClO 的程度,可以判断大气中的非均相OClO 也会光解产生ClOO。一旦从冰中释放到气相中,ClOO 将离解成O2和Cl 原子。

由上述研究可见,ClO2在气相中的分解产物以自由基为主,产物仍具有较强的反应活性,这可能也是ClO2在气相中的氧化能力强于液相的原因。
3.2 液体溶液(溶剂化效应)
OClO 在各种溶剂中被光激发会产生ClO+O 和Cl+O2。在极性溶液中Cl 伴随O2(3∑g)产生,在非极性溶液中主要生成O2(1Δg)。对称性的降低可能导致ClOO 的生成,也更容易衰变成Cl+O2[23]。OClO 基态反应[OClO→Cl(2Pu)+O2(3Σg-)]在水中没有观察到溶剂效应,但在激发态光解时[OClO+hν→ClO(2Π)+光学产物量子产率会显著增加,在水溶液中Cl 产物的量子产率为10%,而直接解离只产生0.5%。并且,量子产率会随溶剂极性降低而系统性增大[8]。溶剂效应可以显著改变激发态生成ClO+O 反应的原因,可能是在低温溶剂环境中ClO+O 通道的能量无法满足,使放热的Cl+O2通道成为唯一反应途径。采用飞秒瞬态吸收光谱对OClO 在水溶液中的超快动力学的研究结果也证实,由OClO*(一种光产物)形成Cl 基团的主要途径是生成光异构化分子ClOO[24],继续分解生成Cl+O2。
Cosson 等[25]研究紫外光照射ClO2在水溶液中的光解过程,确定了ClO2在253.7 nm 和300.0 nm处光分解的量子产率分别为0.44 和1.4。253.7 nm处ClO2在水中光解总反应式:
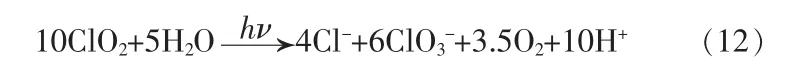
在300~436 nm 的波长连续光解,反应式:
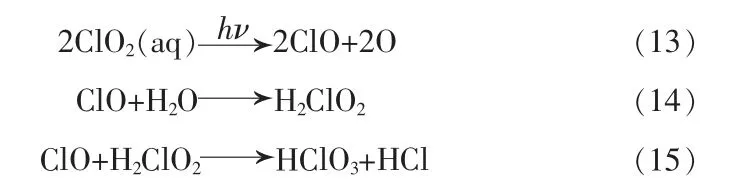
总反应式:
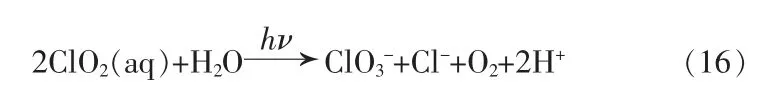
在溶液中光引发的激发态结构与气相中显著不同。时间分辨共振拉曼光谱(TRRR)研究表明,溶剂的存在导致初级ClO 和O 光碎片的有效重组产生基态OClO。该过程也会产生少量的ClOO,但会在亚毫微秒时间尺度上迅速热分解为Cl。OClO 在水溶液中会嵌入水团簇,且生成Cl 的光量子产率不受波长影响[23]。
OClO 在水中发生光化学反应生成HCl 和HClO。通过光谱分析观察到OClO 在硫酸(H2SO4)中的反应性与水中反应性类似,都存在ClO+O 和Cl+O2的离解[7]。TRRR 证实了在乙腈溶剂中ClO 和O 重新成对结合,而且乙腈溶剂分子间氢键的缺失导致重新结合过程中的量子产率更低,ClO 和O 在乙腈溶剂中的成对重组仅为在水中的1/5[23]。
综上所述,避光、强极性溶剂均有助于ClO2分子的稳定。
4 温度的影响
温度对ClO2稳定性的影响弱于pH。在供水管网中ClO2的衰减服从wt=w0e-(0.00133+0.000343T)t[26]。在较高温度条件下水溶液中ClO2会歧化生成大量和该过程近似为二级反应。贮存ClO2溶液时应控制温度<10 ℃[12]。在同样的避光条件下,25 ℃时15 d 的衰减率只有当ClO2质量浓度<186 mg/L 时小于10%;而在7 ℃条件下,质量浓度为78~842 mg/L的衰减率均小于10%[27]。但是高浓度下稳定性更好,3000 mg/L 的纯ClO2在避光40 ℃条件下,90 d后溶液也能保持其起始浓度的90%以上[28]。
溶剂效应中生成ClO+O 通道的改变也会导致OClO 在低温基体中的光化学性质发生显著变化[23],主要产物为Cl+O2[21],而这却是气相反应中的次要产物。
5 共存物质的影响
5.1 亚氯酸盐和氯酸盐
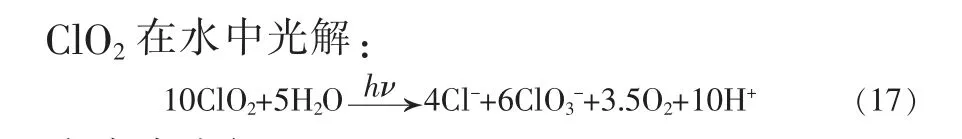
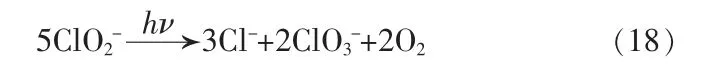
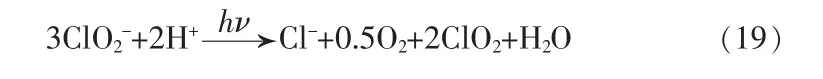
结合反应H2O →H++OH-,消除H+后得到总反应:
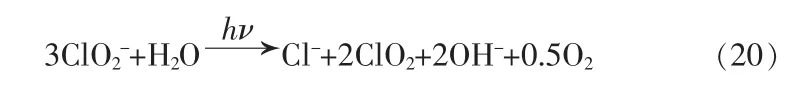
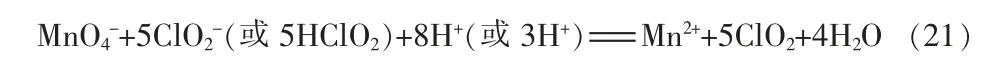
在相同条件下,速率方程为:
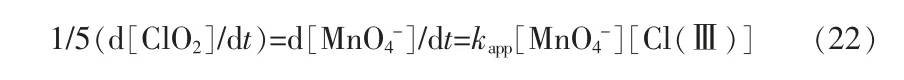
[H+]为假一级反应,速率常数k=kapp[Cl(Ⅲ)],其中k=(a+b[H+])/(1+c[H+]),由快速建立的质子守恒方程和两个限速步骤和可得出如下速率 参 数 值:l/c=Ka=(2.70±0.45)×10-3mol/L,a=k1=(24.4±2.0)mol-1·s-1·L,b/c=k2=(92±29)mol-1·s-1·L。
离子强度在0.01~0.10 mol/L(NaClO4)对kapp没有显著影响,在0.1~2.0 mol/L(NaClO4)使kapp略微增大。因此可以通过调整水中氯(Ⅲ)、H+和的含量来保持ClO2含量恒定。
5.2 Cl-和HClO
在水溶液中,Cl-既可促进ClO2的分解,也可以是ClO2的分解产物。前者反应:

0.8 mmol/L ClO2在0.1 mol/L HCl 中3 h 内消耗量小于5%,在0.01 mol/L HCl 和1 mmol/L NaCl 混合溶液中0.3 mmol/L ClO2在2 周内消耗量小于10%。由于该反应缓慢且具有光敏性,反应速率一直存在较大分歧,早期研究表明60 ℃时3 级速率常数为1×10-3mol-2·s-1·L2,25 ℃下振荡器中反应动力学速率常数为5×101~8×107mol-2·s-1·L2。反应不能自发进行,在25 ℃和60 ℃时通过自由能计算的平衡常数分别为5.0×10-12和3.4×10-13[11]。这说明Cl-对ClO2分解的促进有限。
在2.0 mol/L 离子强度、1.2×10-3~2.0 mol/L H+条件下,HClO2可歧化生成ClO2:

生成的Cl-会促进HClO2分解,少于0.1 mol/L 的Cl-也可加快反应,此时化学反应变为:
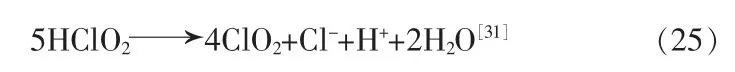
继续研究HClO2的歧化反应动力学发现,相同[H+]下25 ℃时分解速率方程为:
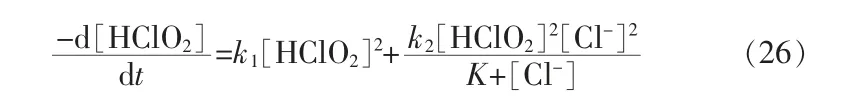
k1和K 分别为1.17×10-2mol-1·s-1·L 和0.0012 mol/L,与[H+]无关。在1.2 mol/L HClO4溶液中k2为1.57×10-2mol-1·s-1·L,在2.0 mol/L HClO4中k2为3.00×10-2mol-1·s-1·L[32]。
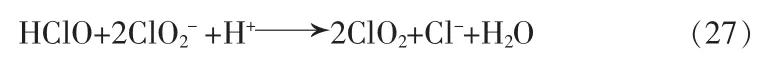
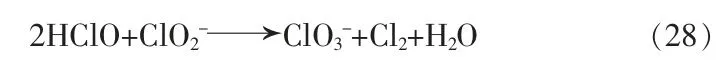
综上所述,在水中若无其他物质参与反应,Cl-对ClO2的影响不大,少量HClO 可以促进转化为ClO2,而过量的HClO 则会消耗ClO2。
6 结论与展望
高纯、高浓度ClO2液体制剂的安全性、腐蚀性、成本等有明显优势,更适于在防疫、医疗、器械消毒等领域应用。但是,此类产品的开发需要在稳定方法上取得新的突破。ClO2两种同分异构体ClOO、OClO的性质和转化规律是制备高纯稳定ClO2制剂的重要知识基础。
水溶性ClO2不能稳定存在,只能通过控制pH、温度、光照、溶剂等条件减缓分解歧化过程,pH 影响最大。ClO2在酸性、避光、低温、极性溶液中更稳定。但是,要注意不同的歧化方向产物不同,应避免生成Cl2等产物。通过化学平衡补充消耗的ClO2也可以在表观上实现浓度稳定。但是,此过程要综合考虑和等氯化物的作用及H+等共存的影响。
现有ClO2的基础研究主要发表于20 世纪90年代和21 世纪初,集中在光化学及化学平衡领域,经过梳理虽然较为系统,但是对于稳定产品开发更具有指导意义的动力学研究较少。由于分子中有一个孤对电子,络合稳定ClO2的可能性也值得尝试。

