黑曲霉β-葡萄糖苷酶的分离纯化及酶学性质研究
郭金玲,陈程鹏,周一郎,陈红吉,吕育财,任立伟,龚大春
(1.三峡大学 湖北省生物酵素工程技术研究中心,湖北 宜昌 443002;2.三峡大学生物与制药学院,湖北 宜昌 443002)
β-葡萄糖苷酶(EC 3.2.1.21)又称β-D-葡萄糖苷水解酶,是纤维素酶系的重要组成成分,可以水解β-D-葡萄糖苷键释放出β-D-葡萄糖[1],被广泛应用于生物燃料[2-3]、食品[4-6]、医药保健品[7-8]等诸多领域,具有广阔的市场应用前景。因此,国内外对β-葡萄糖苷酶研究日益增多,加快了其投入生产应用的步伐。
微生物产β-葡萄糖苷酶具有生长周期短,易于提取,操作成本低等优点。目前,国内外研究较多的β-葡萄糖苷酶产生菌为细菌中的芽孢杆菌属(Bacillus),真菌中的木霉属(Trichoderma)和曲霉属(Aspergillus)。黑曲霉产β-葡萄糖苷酶不仅酶活性高,同时,黑曲霉不产生有毒物质,安全可靠,是公认的安全微生物[9]。因此,黑曲霉在产β-葡萄糖苷酶方面显示了较大的潜力,为该酶的应用和开发提供更广阔的空间。目前已经报道了多种来源于黑曲霉的β-葡萄糖苷酶,分子质量分布在67~330 kDa之间,最适催化温度为50~70 ℃,最适pH值为2.0~6.0,具有较广泛的多样性[4,10-13]。
本课题组前期已对实验室保藏黑曲霉产β-葡萄糖苷酶的发酵产酶条件、β-葡萄糖苷酶在鲜人参皂苷生物转化中的应用、β-葡萄糖苷酶的固定化和初步纯化等进行了研究[14-17]。本研究拟对黑曲霉产的β-葡萄糖苷酶进行分离纯化和性质研究,以期进一步了解其酶学性质,为其后续应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黑曲霉(Aspergillus niger):实验室保藏。
1.1.2 培养基
斜面培养基[16]:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH自然。
种子培养基[16]:葡萄糖60.0 g/L,麦芽粉8.0 g/L,硫酸铵10.0 g/L,磷酸二氢钾5.0 g/L,硫酸镁1.0 g/L,121 ℃灭菌20 min。
发酵培养基[16]:麦芽糖12.0 g/L,酵母膏4.0 g/L,磷酸二氢钾2.0 g/L,硫酸镁0.8 g/L,硫酸锰0.17 g/L,吐温80 0.2%,pH 5.5,121 ℃灭菌20 min。
1.1.3 试剂
水杨素(纯度≥99%):上海源叶生物科技有限公司;3,5-二硝基水杨酸(分析纯):上海顺强生物科技有限公司;季氨乙基-琼脂糖凝胶FF(Q-Sepharose FF)离子交换层析填料、苯基-琼脂糖凝胶6FF(Phenyl-Sepharose 6 FF)疏水层析填料、丁基-琼脂糖凝胶HP(Butyl-Sepharose HP)疏水层析填料:美国GE公司;蛋白质电泳试剂盒:上海碧云天生物科技有限公司;超滤离心管(10 kDa):德国默克密理博公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AR2140型电子天平:梅特勒-托利多仪器(上海)有限公司;PHS-3C型pH计:上海仪电科学仪器股份有限公司;SX-700型蒸汽灭菌器:日本Tomy公司;SW-CT-1D型净化工作台:苏州净化设备有限公司;ZQLY-180型振荡培养箱:上海知楚仪器有限公司;MX-307型落地高速冷冻离心机:日本Tomy公司;UV1800型紫外可见分光光度计:日本岛津公司;WH-861型微型旋涡混合仪:生工生物工程(上海)股份有限公司;BT1-100L-LCD型智能恒流泵、SBS-100-LCD型数控计滴自动部分收集器:上海琪特分析仪器有限公司;UVD-680-3型紫外检测仪:上海金达生化仪器有限公司;DYCZ-24DN型电泳仪:北京市六一仪器厂;WD-9405B型水平摇床:北京沃德生物医学仪器公司。
1.3 方法
1.3.1 粗酶液的制备
将甘油管保藏的黑曲霉孢子悬浮液划线接种于斜面培养基,28 ℃活化5~7 d。将活化后的黑曲霉转接于种子培养基中,于28 ℃、150 r/min摇床中培养48 h作为种子液。将种子液以10%(V/V)的接种量接种于发酵培养基,于28℃、150 r/min摇床中培养4 d,除去菌丝体得到β-葡萄糖苷酶粗酶液,保存于4 ℃冰箱备用。
1.3.2β-葡萄糖苷酶活力的测定
参照文献[16]测定β-葡萄糖苷酶活力。β-葡萄糖苷酶活力单位定义:在测定条件下,每分钟释放1 μmol还原糖所需要的酶量为一个酶活力单位(U/mL)。
1.3.3 蛋白质含量的测定
采用考马斯亮蓝法测定蛋白质含量[18]。
1.3.4β-葡萄糖苷酶的分离纯化
硫酸铵盐析[10]:取一定体积粗酶液于烧杯中,冰浴,采取两种方案进行盐析。方案1(分级盐析):在搅拌下缓慢加入硫酸铵粉末,使其饱和度达到35%,4 ℃静置2 h使其完全沉淀,取盐析液10 000 r/min离心15 min,上清液中继续加入硫酸铵使其饱和度达到80%,4 ℃静置使其完全沉淀,10 000 r/min离心15 min,收集沉淀,缓冲液复溶后透析过夜。方案2(一步盐析):直接加硫酸铵至饱和度达到80%。
Q-Sepharose FF离子交换柱层析:20 mmol/L用磷酸盐缓冲液(pH 7.0)平衡色谱柱,取透析后粗酶液上样。采用含0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L和1.0 mol/L NaCl的20 mmol/L磷酸盐缓冲液(pH 7.0)进行梯度洗脱,洗脱流速为1 mL/min,收集各梯度洗脱液进行酶活性检测,合并有酶活性的洗脱液进行进一步纯化。
Phenyl-Sepharose6FF疏水层析柱层析:将经过离子交换层析后的酶液用超滤管浓缩并将缓冲液更换为含1.0 mol/L硫酸铵的20 mmol/L磷酸盐缓冲液(pH 7.0),上样后以降低硫酸铵浓度的方式进行梯度洗脱,即分别用含1.0 mol/L、0.8 mol/L、0.6 mol/L、0.4 mol/L、0.2 mol/L和0 mol/L硫酸铵的20 mmol/L磷酸盐缓冲液(pH 7.0)进行洗脱,收集有酶活性的洗脱液。
Butyl-Sepharose HP疏水层析柱层析:方法同Phenyl-Sepharose 6 FF层析柱层析进行梯度洗脱,洗脱流速为1.5 mL/min,收集有酶活性的洗脱液。
1.3.5β-葡萄糖苷酶蛋白纯度及相对分子质量的测定
酶蛋白纯度及相对分子质量的测定采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)法,SDS-PAGE条件:浓缩胶5%,分离胶10%;浓缩胶选用80 V固定直流电压,待进入分离胶时改用110 V直流电压。电泳结束后倒入考马斯亮蓝R250染色液,在摇床上振荡染色0.5 h,蒸馏水反复冲洗几次后加入脱色液(乙醇冰醋酸溶液),在摇床上振荡脱色至蛋白质条带清晰可见。
1.3.6β-葡萄糖苷酶的酶学性质
最适反应温度:在温度30~80 ℃条件下按照方法1.3.2测定酶活。将最高酶活定义为100%,分别计算不同反应温度下的相对酶活。
热稳定性:将待测酶液置于30~80℃条件下保温30min,冷却后按照方法1.3.2测定酶活。以未保温酶活为100%,分别计算在不同温度下保温后的相对酶活。
最适反应pH值:在pH值1.0~8.0条件下按照方法1.3.2测定酶活。将最高酶活定义为100%,分别计算不同pH值下的相对酶活。
pH值稳定性:在4 ℃条件下,将纯化后的酶液置于pH 1.0~8.0的缓冲液中处理3 h,按照方法1.3.2测定酶活。将未处理的酶活定义为100%,分别计算不同pH值下处理后的相对酶活。
2 结果与分析
2.1 β-葡萄糖苷酶的分离纯化
2.1.1 硫酸铵盐析
β-葡萄糖苷酶粗酶液经硫酸铵盐析后,测定总酶活、总蛋白含量、比酶活、纯化倍数及回收率,结果见表1。由表1可知,分级沉淀(方案1)的回收率为47.26%,低于一步盐析(方案2)(59.90%),但纯化倍数(2.84)较高,除去了更多的杂蛋白。为了在保证一定回收率的基础上达到更好的纯化效果,本实验采用硫酸铵饱和度为35%~80%的分级盐析方法。
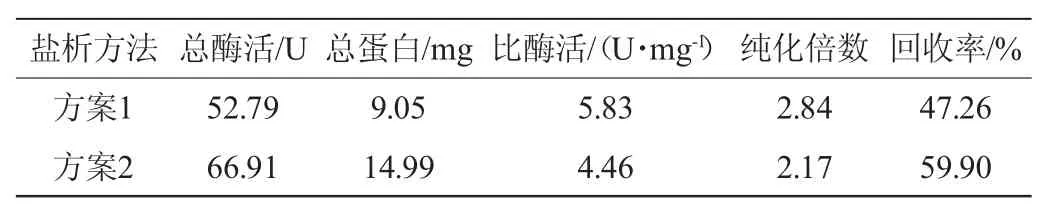
表1 硫酸铵盐析结果Table 1 Results for ammonium sulfate precipitation
2.1.2 Q-Sepharose FF离子交换柱层析
Q-Sepharose FF离子交换层析洗脱曲线见图1。由图1可知,脱盐后的粗酶液经Q-Sepharose FF离子交换柱层析分离后,共得到4个洗脱峰,其中第3个洗脱峰具有β-葡萄糖苷酶活力,即β-葡萄糖苷酶在NaCl浓度达到0.6 mol/L时被洗脱下来,其余的洗脱峰均无β-葡萄糖苷酶活力,为杂蛋白。将0.6 mol/L洗脱液进行回收合并,测定得到总β-葡萄糖苷酶活力为27.42 U,总蛋白质含量为1.89 mg,比酶活为14.5 U/mg,纯化倍数达到7.04倍,回收率为24.66%。

图1 β-葡萄糖苷酶经Q-Sepharose FF离子交换层析洗脱色谱图Fig.1 Chromatogram of β-glucosidase after elution with Q-Sepharose FF ion exchange column chromatography
2.1.3 Phenyl-Sepharose 6 FF疏水柱层析
Phenyl-Sepharose 6 FF疏水柱层析洗脱曲线见图2。由图2可知,粗酶液经Phenyl Sepharose 6 FF疏水柱层析分离后,共得到6个洗脱峰,其中第4个洗脱峰具有β-葡萄糖苷酶活力,即β-葡萄糖苷酶在硫酸铵浓度达到0.4 mol/L时被洗脱下来,其余的洗脱峰均无β-葡萄糖苷酶活力,为杂蛋白。将0.4 mol/L洗脱液进行回收合并,测定其总酶活为10.71 U,总蛋白质含量为0.15 mg,比酶活为71.40 U/mg,纯化倍数达到35.66倍,回收率为9.59%。
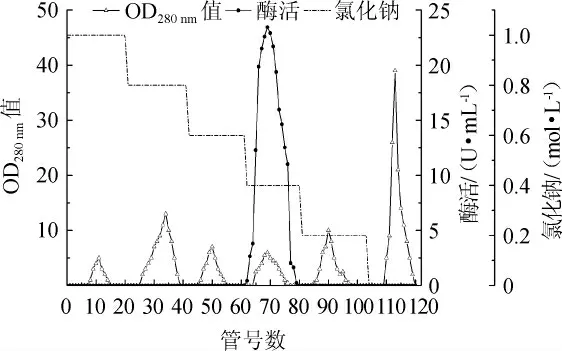
图2 β-葡萄糖苷酶经Phenyl Sepharose 6 FF疏水层析洗脱色谱图Fig.2 Chromatogram of β-glucosidase after elution with Phenyl Sepharose 6 FF hydrophobic chromatography
2.1.4 Butyl-Sepharose HP柱层析
Butyl-Sepharose HP疏水柱层析洗脱曲线见图3。由图3可知,酶液经Butyl Sepharose 6 HP疏水柱层析分离后,共得到5个洗脱峰,其中第3个洗脱峰具有β-葡萄糖苷酶活力,即β-葡萄糖苷酶在硫酸铵浓度达到0.6 mol/L时被洗脱下来,其余的洗脱峰均无β-葡萄糖苷酶活力,为杂蛋白。将0.6 mol/L洗脱液进行回收合并,测定其总酶活为5.19 U,蛋白质含量为0.05 mg,比酶活为103.8 U/mg,纯化倍数达到50.39倍,回收率为4.65%。
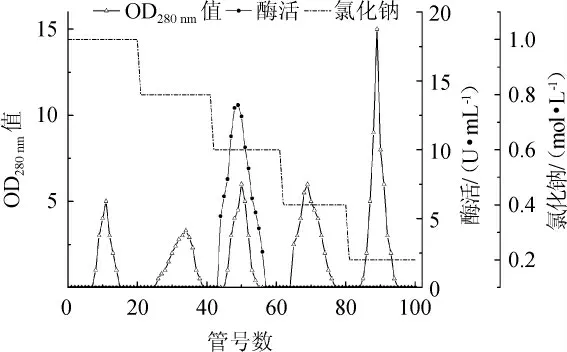
图3 β-葡萄糖苷酶经Butyl Sepharose HP疏水层析洗脱色谱图Fig.3 Chromatogram of β-glucosidase after elution with Butyl Sepharose HP hydrophobic chromatography
2.1.5β-葡萄糖苷酶分离纯化结果
β-葡萄糖苷酶各步纯化结果见表2。
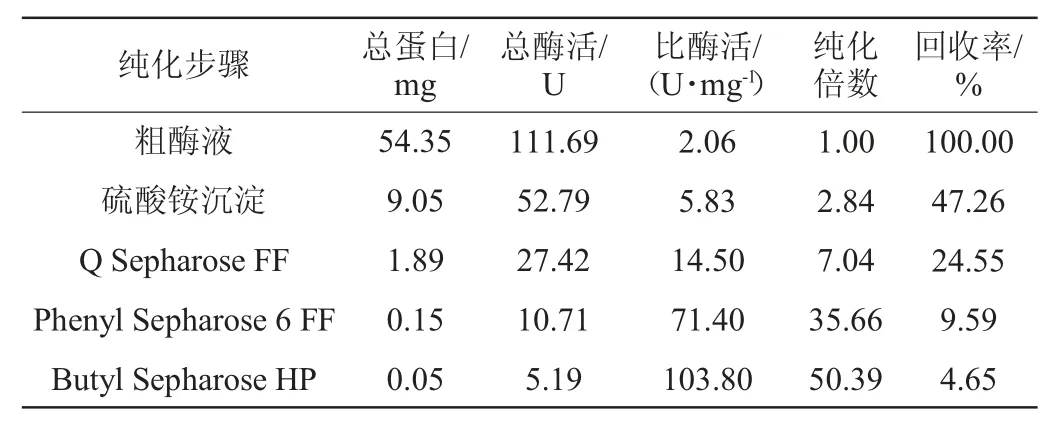
表2 β-葡萄糖苷酶纯化结果汇总Table 2 Summary of β-glucosidase purification results
2.2 β-葡萄糖苷酶分子质量的测定
β-葡萄糖苷酶的SDS-PAGE结果见图4。由图4可知,β-葡萄糖苷酶的分子质量约为116 kDa,与徐星等[10-11]报道的黑曲霉β-葡萄糖苷酶分子质量大小相近,而NARASIMHA G等[12]报道的来源于黑曲霉的β-葡萄糖苷酶的分子质量约为95 kDa,王剑锋等[13]报道的来源于黑曲霉的β-葡萄糖苷酶的分子质量分别为102 kDa和97 kDa,与本研究报道的β-葡萄糖苷酶的分子质量存在较大差别,表明来源于黑曲霉的β-葡萄糖苷酶具有广泛的多样性。

图4 黑曲霉产β-葡萄糖苷酶SDS-PAGE结果Fig.4 SDS-PAGE result of β-glucosidase from Aspergillus niger
2.3 β-葡萄糖苷酶酶学性质研究
2.3.1 最适反应温度和热稳定性
通常,随着反应温度的升高,酶反应速度加快,但是当温度升高到一定程度后,酶蛋白变性失活,反应速度随之降低。温度对黑曲霉β-葡萄糖苷酶活性的影响见图5。由图5可知,随着反应温度的升高该酶活性逐渐升高,当反应温度为60 ℃时酶活力最大,但是当温度超过60 ℃后酶活迅速降低,因此,确定该β-葡萄糖苷酶的最适反应温度为60 ℃,与KARAMI F等[19-20]报道的黑曲霉β-葡萄糖苷酶的最适反应温度相近。
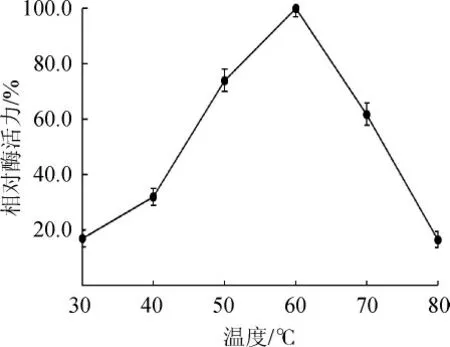
图5 温度对黑曲霉产β-葡萄糖苷酶活性的影响Fig.5 Effect of temperature on the activity of β-glucosidase from Aspergillus niger
黑曲霉β-葡萄糖苷酶的热稳定性结果见图6。由图6可知,该β-葡萄糖苷酶在30~50 ℃范围内较稳定,温度超过50 ℃后,β-葡萄糖苷酶的稳定性逐渐下降。因此,确定该β-葡萄糖苷酶在温度30~50 ℃范围内稳定性好。
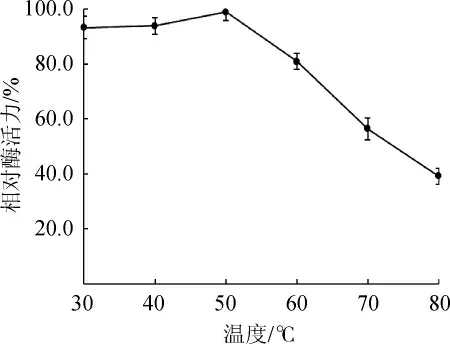
图6 黑曲霉产β-葡萄糖苷酶的热稳定性Fig.6 Thermostability of β-glucosidase from Aspergillus niger
2.3.2 最适反应pH值和pH稳定性
pH值会影响酶活性中心必需氨基酸的解离状态和底物的解离状态,从而影响酶的反应速度。pH值对黑曲霉β-葡萄糖苷酶活性的影响见图7。由图7可知,随着反应pH值的升高,β-葡萄糖苷酶活性呈先升高后下降的趋势,当反应pH值为5时,β-葡萄糖苷酶活性最高,因此,确定该β-葡萄糖苷酶的最适反应pH值为5。
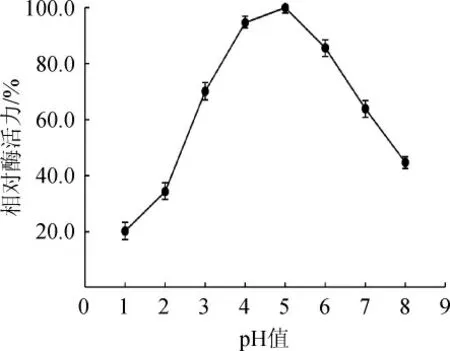
图7 pH值对黑曲霉产β-葡萄糖苷酶活性的影响Fig.7 Effect of pH value on the activity of β-glucosidase from Aspergillus niger
黑曲霉β-葡萄糖苷酶的pH值稳定性结果见图8。
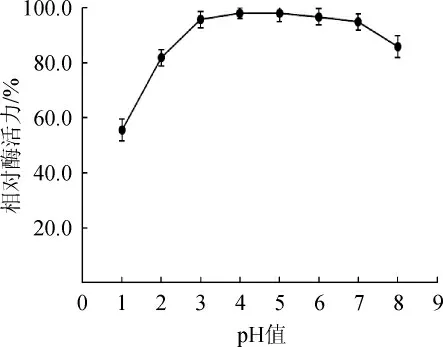
图8 黑曲霉产β-葡萄糖苷酶的pH稳定性Fig.8 pH stability of β-glucosidase from Aspergillus niger
由图8可知,在pH 2.0~8.0的缓冲液中处理3 h,该β-葡萄糖苷酶仍然可以保留80%以上的酶活性,较好的pH稳定性利于该酶在不同领域的应用。因此,确定该β-葡萄糖苷酶在pH值2.0~8.0范围内稳定性好。
3 结论
本研究利用硫酸铵盐析、Q-Sepharose FF离子交换层析、Phenyl-Sepharose 6 FF疏水层析和Butyl-Sepharose HP疏水层析对黑曲霉来源β-葡萄糖苷酶进行分离纯化,并对其酶学性质进行了初步研究。结果表明,经硫酸铵分级盐析、3步柱层析后,β-葡萄糖苷酶的比酶活达到103.80 U/mg,纯化倍数达到50.39倍,回收率为4.65%。利用SDS-PAGE测定该β-葡萄糖苷酶的分子质量约为116 kDa。该酶的最适反应温度为60 ℃,最适反应pH值为5.0,在温度30~50 ℃、pH 2.0~8.0之间具有较好的稳定性,较宽的pH稳定性表明该酶有较好的潜在应用价值。

