某国产人类免疫缺陷病毒1型核酸定量检测试剂的临床试验研究*
周全华,王 越,刘 华,廖 莉,陈 玲,张媛媛,张 敏
重庆市疾病预防控制中心微生物检测所,重庆 400042
艾滋病是全球共同关注的疾病,我国自1985年发现首例人类免疫缺陷病毒(HIV)感染者以来,截至2018年9月30日,报告现存活849 602例感染者[1]。早发现、早治疗是控制艾滋病传播的关键[2]。其病原HIV在人体体液中的含量与其传播能力呈正相关。病毒载量是指每毫升体液中病毒颗粒的数量。根据人类免疫缺陷病毒1型(HIV-1)病毒载量检测结果,可以诊断HIV-1感染状况,监测疾病病程,判断抗病毒治疗的效果和指导治疗方案的选择[3-5]。但是,我国HIV-1病毒载量检测主要还是依赖于进口设备和试剂,其昂贵的价格,严重制约了接受抗病毒治疗的感染者和患者的检测频率及病毒载量检测覆盖的范围。为使有限的公共卫生资源能更好地运用于临床诊断、治疗等领域,开发灵敏度、精确度和准确度与进口试剂相当的国产检测试剂已迫在眉睫。本研究对某国产HIV-1核酸定量试剂盒(PCR-荧光探针法)进行临床评价,比较其和进口同类试剂的相关性和一致性,为该国产HIV-1核酸检测试剂的临床性能评价提供数据支撑,现报道如下。
1 材料与方法
1.1标本来源 所有标本均来自重庆市疾病预防控制中心在2018-2019年接受抗病毒治疗患者和新确认的HIV感染者,共筛选了208例血浆标本,因标本信息不全剔除11例,实际纳入197例标本,其中,阳性标本188例,定量范围涵盖10~106IU/mL,阴性标本9例(健康人群),符合对比试剂和考核试剂定量限范围的标本178例。
1.2试剂 对比试剂为Roche Cobas TaqMan HIV-1 Test Version2.0检测试剂盒(简称Roche试剂),购于罗氏公司,上样量1 mL,检测限33.40~1.67×107IU/mL;考核试剂为HIV-1核酸测定试剂盒(RT-PCR荧光探针法,简称丽珠试剂),由珠海丽珠试剂股份有限公司研制,上样量500 μL,检测限1.0×102~1.0×107IU/mL;复核试剂为HIV-1核酸定量试剂盒(PCR-荧光探针法,简称达安试剂),由中山大学达安基因股份有限公司提供,上样量200 μL,检测限2.5×102~1.0×108IU/mL。
1.3方法 根据国家食品药品监督管理局2014年9月11日颁布的《体外诊断试剂临床试验技术指导原则》的要求,选择已批准上市的产品作为对比试剂(Roche试剂),与考核试剂(丽珠试剂)对临床标本进行对比试验研究,结果不一致的标本用复核试剂(达安试剂)进行复核检测。操作过程均严格按照试剂盒说明书进行。
1.4统计学处理 用SPSS22.0统计软件对数据进行分析。计数资料以频数、率表示,组间比较采用χ2检验。采用线性回归方法分析不同试剂检测结果的相关性,采用Bland-Altman法分析2种试剂检测结果的一致性。通过GraphPad prism 6.0软件进行统计分析和绘图。
2 结 果
2.1考核试剂与对比试剂的对比试验结果比较 188例HIV阳性标本中,186例标本经2种试剂检测均为阳性,阳性符合率为98.94%(95%CI:96.20%~99.71%),9例阴性标本经2种试剂检测结果均为阴性,阴性符合率为100.00%(95%CI:70.09%~100.00%),2种试剂检测总符合率为98.98%(95%CI:96.37%~99.72%),见表1。2例(编号为RZ-159、RZ-166)结果不一致的标本用复核试剂进行复核检测,复核结果见表2。利用数据统计分析软件SPSS22.0对数据进行Kappa一致性分析,Kappa值为0.895(P<0.05),说明考核试剂与对比试剂具有较好的一致性。
2.2各基因型标本检出情况 共有188例标本进行分型检测,143例标本分型检测成功,其中,AE重组型(CRF01-AE重组型)19例、BC重组型116例(CRF07-BC重组型88例、CRF08-BC重组型28例)、B/B′型8例,加上购买的O组商品化阳转血清盘1例,共计144例分型成功。考核试剂检出率为99.31%(143/144),有1例(编号RZ-166)CRF08-BC的标本未检出;对比试剂检出率为100.00%(144/144)。
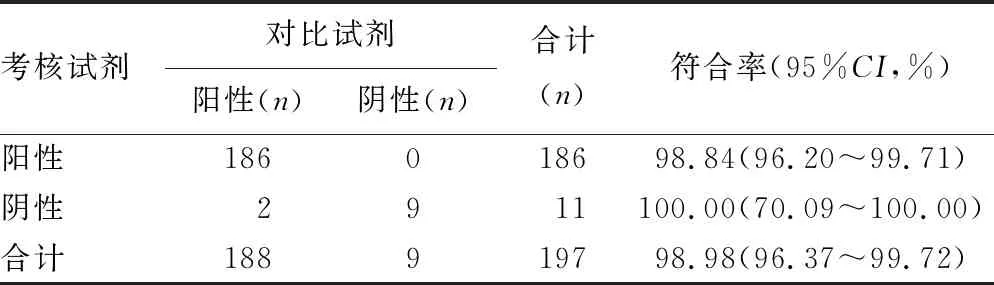
表1 考核试剂与对比试剂定性检测结果比较

表2 2例结果不一致标本考核试剂、对比试剂及复核试剂检测结果
2.3线性范围内检测结果 符合对比试剂(33.4~1.67×107IU/mL)和考核试剂(1.0×102~1.0×107IU/mL)检测限范围的标本178例,剔除其中4例离群标本,对剩余的174例标本检测结果采用对数转换处理后再进行定量统计分析,线性回归方程为Y=0.98X-0.04,相关系数r=0.968(R2=0.937,P<0.05),2种试剂检测结果线性相关关系成立,说明2种试剂相关性较好,见图1A。采用Bland-Altman一致性分析,174组数据的95%一致性界限为(-0.64,0.35),有5/174(2.87%)例标本在95%一致性界限以外,说明2种检测试剂的一致性较好,见图1B。
2.4治疗患者标本与未治疗患者标本检测结果的相关性 本次试验中共收集到97例接受抗病毒治疗的患者标本,检测范围涵盖10~104IU/mL,考核试剂与对比试剂的线性回归方程为Y=0.93X+0.07,相关系数为r=0.933(R2=0.871),见图2。92例(含1例HIV-1 O组商品化阳转血清盘)未接受治疗的HIV-1感染者标本,检测范围涵盖102~106IU/mL,考核试剂与对比试剂的线性回归方程为Y=X+0.12,相关系数为r=0.950(R2=0.903),见图3。
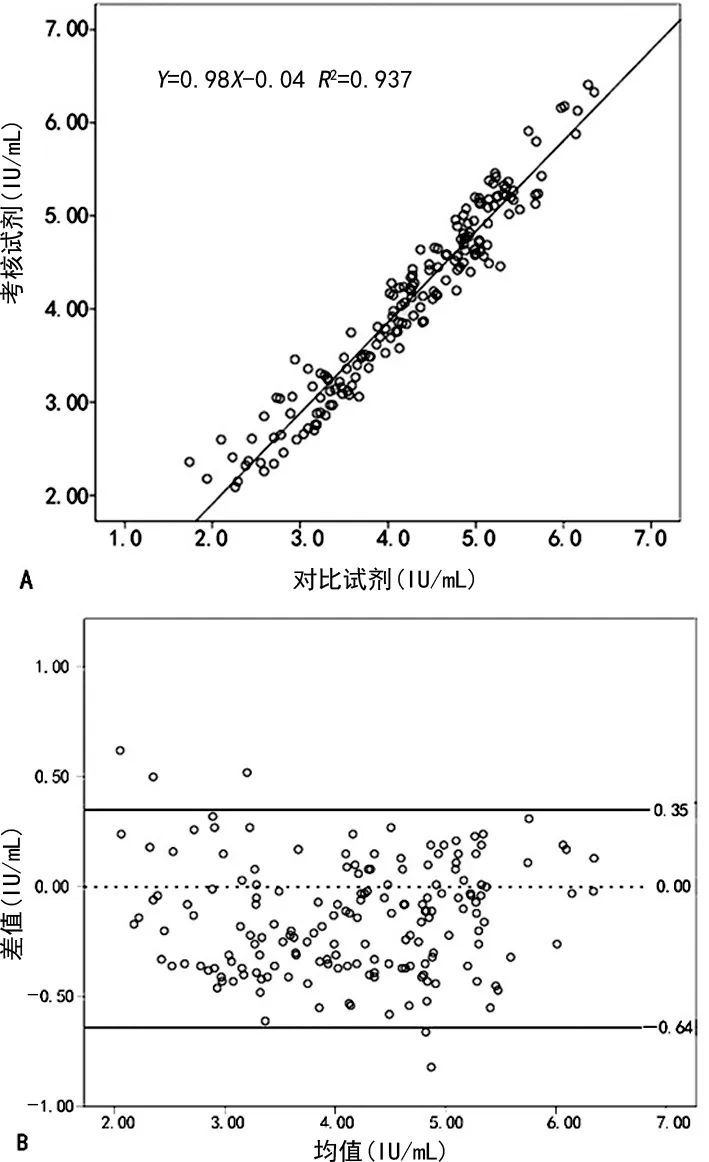
注:A为考核试剂与对比试剂检测HIV-1标本的相关性分析;B为考核试剂与对比试剂检测结果一致性分析。
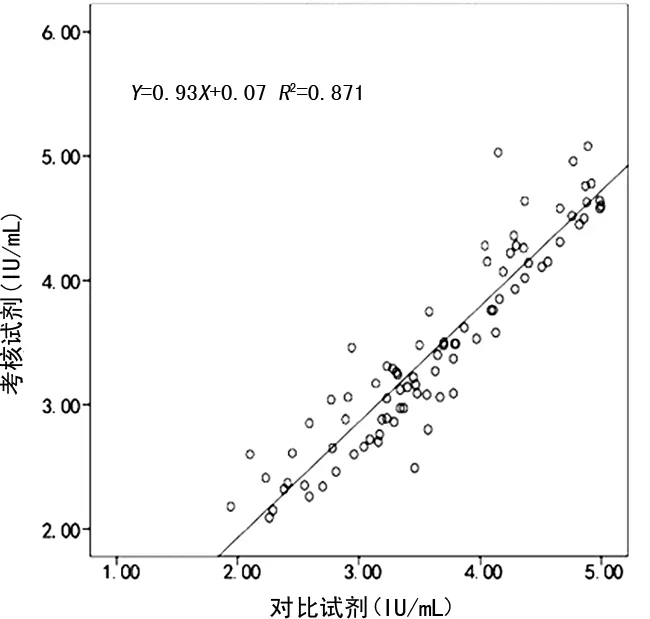
图2 考核试剂与对比试剂检测抗病毒治疗患者标本结果的相关性
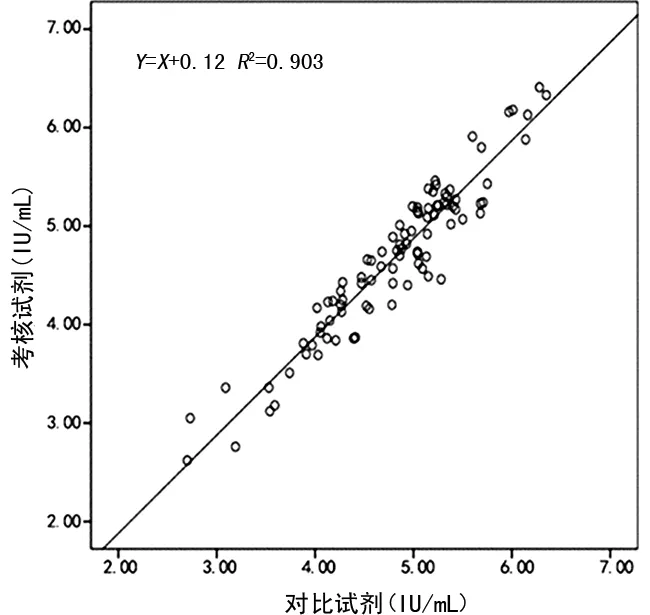
图3 考核试剂与对比试剂检测未抗病毒治疗患者标本结果的相关性
3 讨 论
艾滋病作为全球十大死因之一的传染性疾病,严重威胁着人类的健康,且目前无有效疫苗和彻底治愈的方法[6-7],故防控HIV的流行成为世界各国面临的一项十分重要的任务[8]。治疗艾滋病及HIV携带者是我国现行的防控措施之一[9-10],准确、客观、及时评价抗病毒治疗效果就显得十分重要。有文献报道,早期诊断和有效治疗能使HIV传播的风险降低96%[9],HIV-1病毒载量检测是评价抗病毒治疗效果和早期诊断最有效的方法,然而进口试剂和设备价格昂贵,严重制约了我国HIV-1病毒载量检测工作的开展,因此开发适合我国国情的优质试剂迫在眉睫。
在197例检测标本中,考核试剂和对比试剂在Kappa分析中,Kappa值为0.895(P<0.05),说明2种检测试剂在定性检测方面完全一致。在2种试剂共同的线性范围内,回归分析表现出较好的相关性,相关系数r=0.968(R2=0.937),这与邹静波[6]、MURPHY等[11]、李梅等[12]、孙国清等[13]、丁莉莎等[14]的报道的结果相一致。Bland-Altman一致性分析显示出2种试剂一致性较好。在2种试剂共同的线性范围中,考核试剂有4例标本出现离群值,可能是2种试剂选择的靶基因位点、引物、探针序列及反应体系的不同造成检测结果的差异,同时由于HIV为反转录病毒,基因组的突变率非常高,当待测标本的基因组的靶基因发生突变,即可能造成考核试剂和对比试剂的检测结果的差异。在定性分析中,有2例检测结果不一致,这可能与超出考核试剂的检测限,并且处于对比试剂检测下限,检测结果本来就具有很大的不确定性有关。李繁等[15]的研究也指出,在病毒载量较低时,不同试剂盒加样量的不同会直接导致检测敏感性差异。本次研究发现的差异在临床可接受的范围内,因此,可以认为考核试剂与对比试剂具有良好的一致性。
对我国4种主要流行的HIV-1基因亚型(CRF07-BC、CRF01-AE、CRF08-BC、B/B′)[16-17]检测中,考核试剂与对比试剂的检测结果差异无统计学意义(χ2=0.24,P>0.05),说明该考核试剂能满足我国HIV-1病毒载量的检测要求。
本研究发现,考核试剂与对比试剂对于治疗患者的标本和未治疗患者标本的检测结果具有高度的相关性,相关系数分别为0.933和0.950。这表明该考核试剂能够运用于治疗效果的监测、疾病的进程和感染状况的判断。
综上所述,本研究参与评估的考核试剂在定性、定量、治疗患者和未治疗患者、不同基因亚型等方面的检测能力都与对比试剂具有较好的相关性和一致性。随着国产试剂研发的投入,市场上已经出现了与进口试剂质量相当的国产试剂[18-19],甚至部分国产试剂已经优于部分进口试剂[20]。国产试剂相对于进口试剂而言,具有检测设备开放、所需样本量小、价格低廉等优势,更容易被患者和临床医生所接受。但是国产试剂普遍面临着仪器设备的自动化程度较低、低值的重复性较差等缺点,这些都需要在下一步的研发中进行完善。

