牛LATS1基因启动子转录调控分析
魏大为,张久盘,杨智燕,王兴平,罗仍卓么,昝林森
(1宁夏大学 农学院, 宁夏 银川750021;2.宁夏农林科学院固原分院,宁夏 固原756000;3 西北农林科技大学 动物科技学院,陕西 杨凌 712100; 4 宁夏西海固高端牛产业研究院,宁夏 中卫755000)
我国肉牛产业虽起步较晚、起点较低,但发展势头迅猛。2019年我国牛肉总产量约770.0万吨,同年我国牛肉消费量为923.3万吨[1]。目前我国牛肉消费供不应求,价格持续高位运行,不得不从国外大量进口,2019年牛肉进口量高达165.95万吨,比2018年增加61.99万吨,首次跃居全球首位[1]。据预测,未来5年内,我国牛肉年消费量将突破1 000万吨,如果按照目前的生产水平,至少还有300万吨左右的缺口[1-2]。因此,我国肉牛产业还有很大的发展空间。秦川牛作为我国五大黄牛品种之一,具有耐粗饲、抗逆性强、肉质细嫩且大理石花纹明显等特点[3],但其产肉率低、生长速度缓慢、后躯不够发达等缺点制约了其产业化发展[4]。如何提高秦川牛生长速率,增加产肉量,改良和培育优良的肉牛品种成为目前肉牛产业的重要研究方向。研究表明,动物的骨骼肌与其产肉性能密切相关[5],其发育状况除了与环境及营养水平等有关外,更多地受基因控制[6]。因此,通过筛选功能基因来提高骨骼肌的生长发育水平并改善肉质成为现代肉牛遗传改良的一项重要研究内容。
大肿瘤抑制基因1(LATS1)作为Hippo通路主要成员之一,在组织器官的形成及胚胎干细胞的增殖与分化中扮演着重要角色[7-8]。目前关于LATS1的研究主要集中在其对肿瘤细胞增殖的作用方面[9],而有关其调控畜禽骨骼肌生长发育的报道较少,仅见张玉龙[10]报道,LATS1与湖羊的个体生长性状存在一定的关联性。本研究利用实时荧光定量技术,检测LATS1基因在牛不同组织中的表达情况,同时克隆LATS1基因启动子序列,通过逐段缺失PCR扩增获得缺失片段的启动子,并构建双荧光素报告载体,将其转染小鼠成肌细胞和脂肪细胞,检测LATS1基因的启动子核心区域,进一步通过在线网站预测影响牛LATS1基因的关键转录因子,以期初步阐明其转录调控机制,为牛的分子育种提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 组织样品 采集3头秦川牛公牛(24月龄)血液样本及心脏、肝脏、脾脏、肺脏、肾脏、皮下脂肪、背最长肌、大肠、小肠、大脑、皱胃及睾丸组织,于液氮中保存备用。
1.1.2 主要试剂 总DNA提取试剂盒、总RNA提取试剂盒、PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒、SYBR@PrimixExTaqTMⅡ荧光定量试剂盒、PMD19-T(simple)载体、T4 DNA连接酶、高保真PCR扩增酶GXL、大肠杆菌DH5α感受态细胞,均购自TaKaRa公司;限制性内切酶KpnⅠ、Hind Ⅲ,购自美国NEB公司;DNA胶快速回收试剂盒、质粒提取试剂盒、pGL3-Basic质粒及双荧光素酶基因内参pRL-TK载体、Dual-Luciferase®Reporter Assay System双荧光素酶报告系统,均购自Promega公司;PBS、DMEM培养基,购自Hyclone公司;Lipofectamine 3000 Reagent转染试剂盒,购自Invitrogen公司;胎牛血清、OPTI-MEM培养基,购自Gibco公司。引物由上海生工生物工程股份有限公司合成。
1.2 牛不同组织中LATS1基因mRNA表达水平的检测
提取牛不同组织总RNA,用琼脂糖凝胶电泳和分光光度计检测RNA质量。使用PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒将RNA反转录成cDNA,-20 ℃冰箱保存备用。
选用GAPDH作为内参基因,采用实时荧光定量PCR检测牛不同组织中LATS1基因mRNA的表达水平。根据NCBI公布的牛LATS1基因序列(GenBank登录号:NM_001192866.1)和GAPDH基因序列(GenBank登录号:NM_001034034.2),采用Primer premier 5.0软件设计LATS1和GAPDH引物(表1),用SYBR@PrimixExTaqTMⅡ荧光定量试剂盒进行实时荧光定量PCR,检测LATS1基因在各待测组织中的表达情况。PCR反应体系为20 μL,其中PrimixExTaqⅡ为10 μL,上、下游引物各0.8 μL,ROX Reference DyeⅡ 0.4 μL,cDNA模板2 μL,ddH2O 6 μL。反应在7500 Real Time PCR仪(ABI公司产品)上进行。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,循环40次,进行3个生物学重复试验,采用2-ΔΔCt法分析相对表达量[11],数据使用SPSS软件进行单因素方差分析。
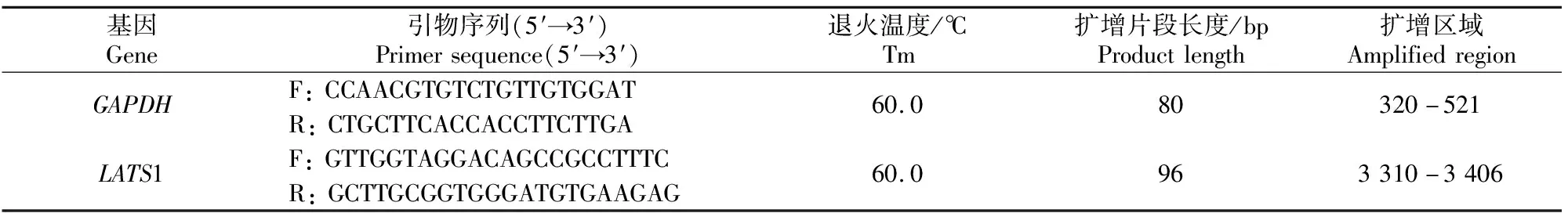
表1 实时荧光定量PCR引物信息
1.3 牛LATS1基因启动子序列分析及蛋白序列进化树构建
利用NCBI(https://www.ncbi.nlm.nih.gov)数据库中海福特牛(Hereford)基因组信息,确定LATS1基因DNA序列。结合NCBI公布的牛LATS1基因转录起始位点及Ensembl(https://asia.ensembl.org/index.html)网站,初步预测牛LATS1基因启动子位置。使用MEGA 5.0(https://www.megasoftware.net/index.php)和Uniprot(https://www.uniprot.org/)软件分析牛LATS1基因结构,并构建不同物种LATS1蛋白进化树。
1.4 牛LATS1基因启动子的克隆
提取牛血液样本基因组DNA,4 ℃保存备用。利用牛LATS1基因的启动子序列(GenBank登录号:NC_037336.1),用Primer 5.0软件设计引物LATS1-PF和LATS1-PR(表2)。以血液基因组DNA为模板,PCR扩增秦川牛LATS1基因启动子区-1783/+167片段。PCR反应体系为50 μL,其中含2×PrimeSTAR GXL Buffer 25 μL,上、下游引物(10 μmol/L)各2 μL,50 ng模板,2 U PrimeSTAR GXL DNA Polymerase,用ddH2O补齐。反应条件:98 ℃预变性5 min;95 ℃ 10 s,60 ℃ 20 s,68 ℃ 15 s,35个循环。将PCR产物用1%琼脂糖凝胶电泳检测后回收纯化,连接于PMD19-T(Simple)载体并转化到大肠杆菌DH5α感受态细胞中,进行单克隆筛选后测序。

表2 牛LATS1基因启动子及其逐段缺失片段克隆引物
1.5 牛LATS1基因启动子核心区分析
1.5.1 启动子逐段缺失片段的克隆 为进一步确定牛LATS1基因启动子核心区域,用Primer premier 5.0软件设计7条用于启动子逐段缺失片段扩增的上游引物LATS1-P1、LATS1-P2、LATS1-P3、LATS1-P4、LATS1-P5、LATS1-P6及LATS1-P7和1条固定的下游引物LATS1-R(上、下游引物5′端分别添加KpnⅠ、Hind Ⅲ双酶切位点,引物信息见表2)。以测序正确的牛LATS1基因启动子区-1783/+167片段作为模板进行启动子逐段缺失PCR扩增(扩增条件及体系同上),对扩增片段进行测序鉴定。
1.5.2 双荧光素酶报告载体的构建 使用内切酶KpnⅠ和Hind Ⅲ在37 ℃下双酶切pGL3-Basic载体1 h,用T4 DNA连接酶在16 ℃恒温仪上与经同样双酶切的7个牛LATS1基因逐段缺失启动子片段连接,将连接产物转化大肠杆菌DH5α感受态细胞,挑选阳性单克隆菌落进行双酶切鉴定。将正确的单克隆扩大培养过夜,使用去内毒素试剂盒提取质粒。重组质粒分别命名为:pLATS1-1783/+167、pLATS1-1449/+167、pLATS1-1149/+167、pLA-TS1-837/+167、pLATS1-555/+167、pLATS1-298/+167和pLATS1-123/+167,并进行纯度和浓度测定。
1.5.3 双荧光素酶报告载体活性分析 用含体积分数10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基培养小鼠成肌细胞(C2C12)和脂肪细胞(3T3-L1)系,按每孔1×105个细胞的量接种至24孔板,置于37 ℃、体积分数5% CO2培养箱中培养,待细胞单层长至70%~80%融合时备用。分别将构建的800 ng牛LATS1基因启动子5′端缺失片段重组质粒和20 ng内参质粒pRL-TK共转染C2C12和3T3-L1细胞,按照Lip3000转染试剂盒说明进行试验操作,以pGL3-Basic质粒为阴性对照,每组试验重复3次。转染48 h后收集细胞。使用Promega公司双荧光检测试剂盒检测萤火虫荧光素酶活性(F值)和海肾荧光素酶活性(R值),通过计算其比值(F/R)确定LATS1基因启动子核心区域。数据采用SPSS软件中两个独立样本t检验进行方差分析。
1.6 关键转录因子预测
通过在线软件Genomatix(http://www.genomatix.de/cgi-bin//mat-inspector)、JASPAR(http://jaspar.genereg.net/)预测启动子核心区潜在转录结合因子,设置阈值大于90%,根据预测结果进行数据库比对并取交集进行筛选,标注牛LATS1基因启动子核心区转录因子结合序列。
2 结果与分析
2.1 牛不同组织LATS1基因的表达规律
LATS1基因mRNA在秦川牛不同组织中的相对表达量如图1所示。
图1显示,LATS1基因在牛12个不同组织中均有表达,以小肠中的表达量为参照,LATS1基因在大脑中的相对表达量极显著高于其他组织(P<0.01);在背最长肌、大肠、皱胃、肾脏的表达量显著高于脾脏、睾丸、皮下脂肪、肺脏、心脏、肝脏及小肠组织(P<0.05)。结果表明,LATS1基因可能与秦川牛器官发育紧密相关,尤其在大脑以及肌肉组织发育中起重要作用。
2.2 牛LATS1基因结构及蛋白序列进化分析
牛LATS1基因位于9号染色体(ENSBTAG00000015076,86860562-86897588),全长37 027 bp。LATS1基因开放阅读框(Open reading frame,ORF)为3 372 bp,包括8个外显子(外显子1-8)和7个内含子(内含子1-7),编码1 123个氨基酸,分子质量为126.19 ku。在线网站预测到牛LATS1为不稳定水溶性蛋白,无潜在的信号肽剪切位点。以NCBI及Ensembl数据库公布的牛LATS1基因信息,确定其转录起始位点胞嘧啶(C)为+1位置,向上游查找2 000 bp的序列,初步预测其启动子区。利用MEGA软件构建不同物种(绵羊、山羊、马、猪、小鼠)LATS1蛋白质序列进化树,结果(图2)表明,LATS1蛋白在不同物种中相似度较高,尤其在复胃动物(牛、绵羊和山羊)间进化保守。
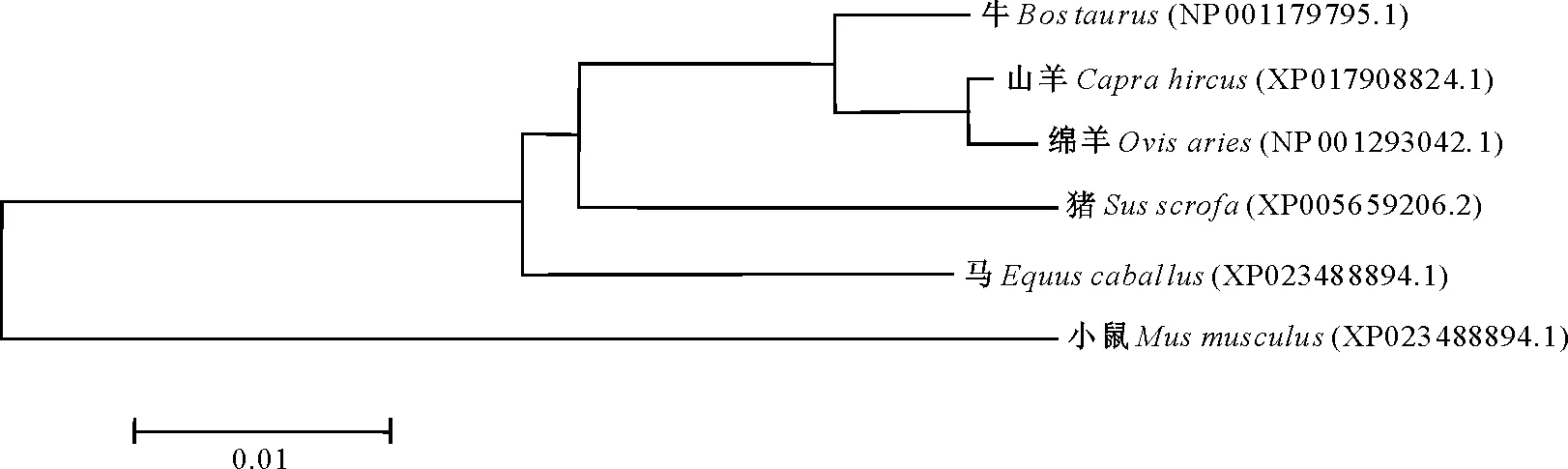
图2 牛LATS1蛋白序列进化树
2.3 牛LATS1基因启动子片段的扩增
据牛LATS1启动子序列信息设计引物PCR扩增其启动子区,结果(图3)获得了约1 950 bp的单一条带,无杂带。目的片段经测序证实其长度为1 950 bp。
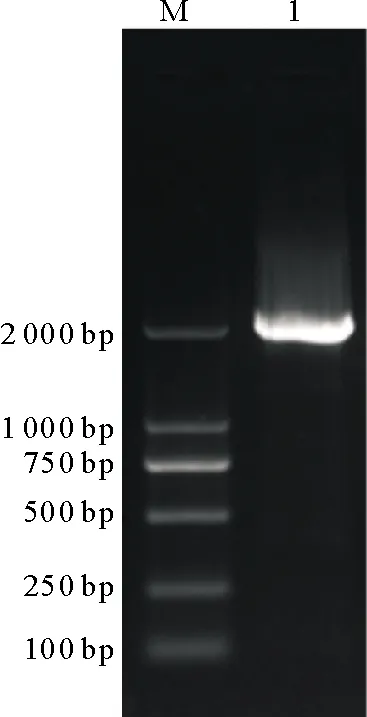
M.DL2000 DNA Marker,1.启动子-1 783/+167片段扩增结果
2.4 牛LATS1基因启动子核心区分析
2.4.1 启动子逐段缺失片段的扩增 使用LATS1-P1/LATS1-R~LATS1-P7/LATS1-R等7对逐段缺失引物进行牛LATS1启动子区扩增,结果(图4)分别获得了1 950,1 616,1 316,1 004,722,465和290 bp的单一条带,与预期片段长度一致。
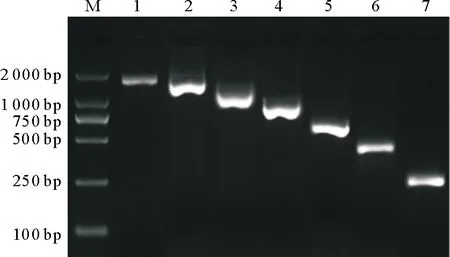
M.DL2 000 DNA Marker;1~7.分别为LATS1-P1/LATS1-R~LATS1-P7/LATS1-R扩增产物,长度分别为1 950,1 616,1 316,1 004,722,465,290 bp
2.4.2 双荧光素酶报告载体的鉴定 重组质粒pLATS1-1783/+167、pLATS1-1449/+167、pLA-TS1-1149/+167、pLATS1-837/+167、pLATS1-555/+167、pLATS1-298/+167和pLATS1-123/+167经KpnⅠ和Hind Ⅲ双酶切鉴定,结果(图5)显示,酶切获得了2条条带,其中包括4 818 bp空载体及1 950,1 616,1 316,1 004,722,465和290 bp目的条带,条带长度与预期一致。进一步对各重组质粒进行纯度和浓度测定,结果显示重组质粒在260 nm处吸光值与280 nm吸光值之比(OD260/OD280)均在1.7左右,质量浓度均高于800 ng/μL,可用于下一步试验。

M.DL2000 DNA Marker;1~8.分别为pGL3-Basic、pLATS1-1783/+167、pLATS1-1449/+167、pLATS1-1149/+167、pLATS1-837/+167、pLATS1-555/+167、pLATS1-298/+167和pLATS1-123/+167质粒的KpnⅠ和Hind Ⅲ双酶切结果
2.4.3LATS1基因启动子核心区的确定 结果(图6)显示,逐段缺失启动子活性片段发现,当缺失LATS1基因启动子区-298/-123片段后,双荧光素报告载体pLATS1-123/+167在C2C12及3T3-L1细胞中的活性较pLATS1-298/+167极显著下降(P<0.01),分别下降了78.2%和69.6%。结果说明,LATS1基因5′端上游1.7 kb序列是启动子区,具有调控基因转录活性功能,-298/-123区域为LATS1基因启动子核心区,且LATS1基因在C2C12细胞系的转录活性高于3T3-L1,这也反映出C2C12细胞系更适合LATS1基因转录活性测定。
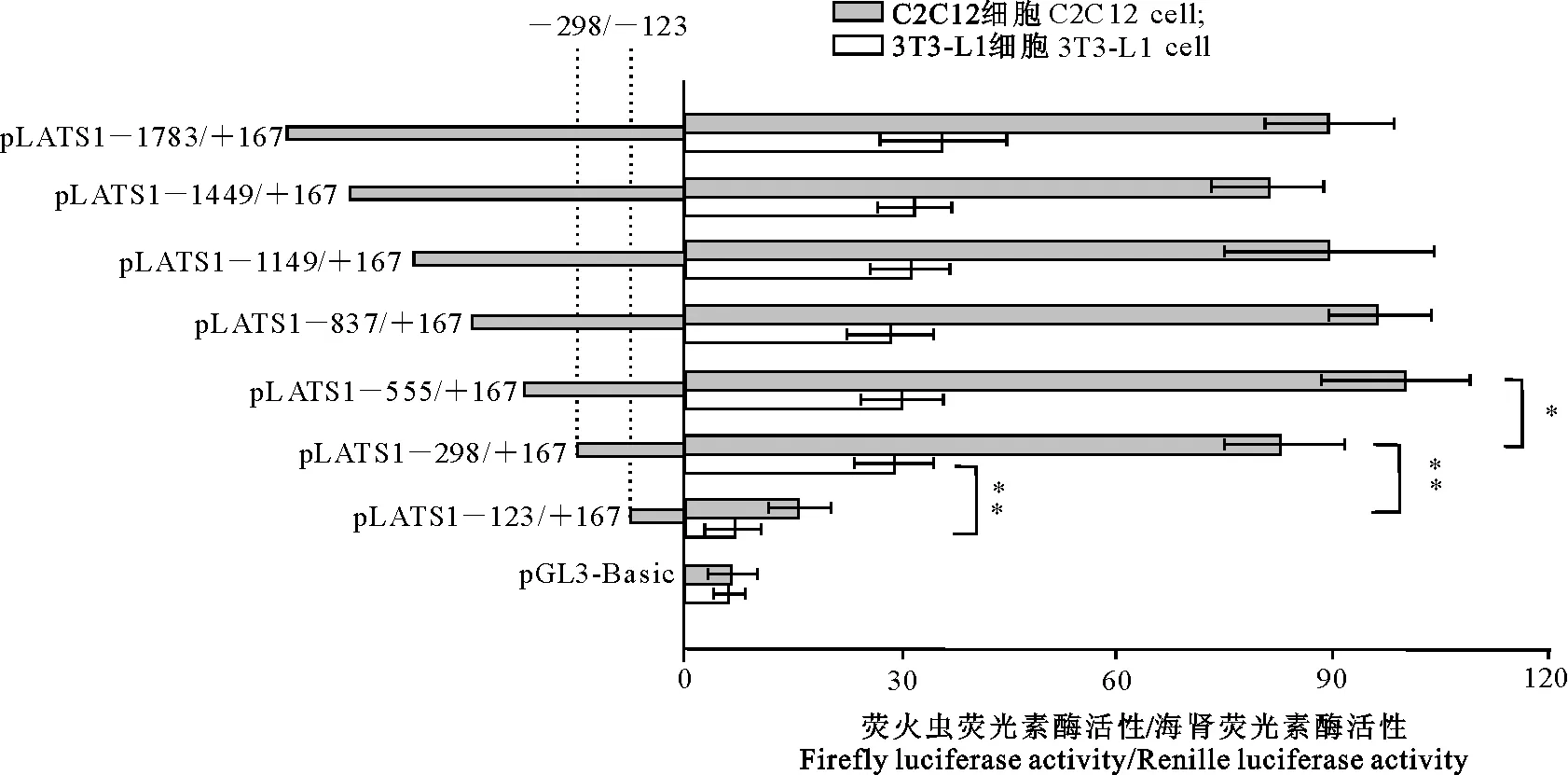
*和**分别表示差异显著(P<0.05)和极显著(P<0.01)
2.5 关键转录因子预测
结合Genomatix、JASPAR软件对牛LATS1基因启动子核心区域(-298/-123片段)的关键转录因子进行预测分析,结果(图7)显示,牛LATS1基因启动子核心区包含肌细胞增强因子2(MEF2A)、转录激活因子5(STAT5)、同源异型盒基因5(HOXA5)、肌细胞决定基因1(Myod1)和靶向叉头框转录因子1(FoxO1)等关键转录因子的结合位点。结果说明,MEF2A、STAT5、HOXA5、Myod1和FoxO1转录因子可能对LATS1基因的转录活性有重要的调控作用。

方框表示转录因子结合位点
3 讨 论
Hippo通路也称为Salvador/Warts/Hippo(SWH)通路,是一个高度保守的传导通路,对细胞増殖、分化和凋亡具有重要的调控作用[12-13]。哺乳动物Hippo信号通路的主要成员有MST1、MST2、Salvador1(Sav1)、LATS1、LATS2、Mob1和Yes相关蛋白基因(YAP/TAZ)[14]。LATS1基因作为Hippo信号通路主要成员之一,参与多种器官组织的发育调控,主要表现在调节心脏体积大小和调控心肌发育[15]。最新研究发现,LATS基因家族除了调控癌细胞增殖和分化外,还可以调控动物肌肉生长发育,如LATS1[10]和LATS2基因[16]对湖羊肌肉生长发育有显著影响。本研究发现,在牛的不同组织中LATS1基因在大脑、背最长肌、大肠、皱胃、肾脏中高表达,且LATS1蛋白在不同物种进化过程中高度保守,由此推测,LATS1基因在个体生长发育过程中扮演着重要角色。
利用逐段缺失双荧光素酶活性的方法检测到LATS1基因启动子核心区位于-298/-123区域,在线软件预测其核心区域有MEF2A、STAT5、HOXA5、Myod1和FoxO1等5个重要转录因子的结合位点。MEF2A是MEF2基因家族中的一员,该基因家族还包括MEF2B、MEF2C和MEF2D[17]。MEF2A是具有碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)结构域的转录因子,在脑、骨骼肌和心肌中高丰度表达,对肌纤维形成、肌纤维稳态、心肌细胞增殖、骨骼肌干细胞和成肌细胞的分化和再生具有促进作用[18-21]。最新研究发现,牛MEF2A基因沉默会抑制成肌细胞分化,并显著下调MYOZ2表达量[22]。综上所述,MEF2A基因对肌肉生长发育过程具有至关重要的调控作用。本研究发现,牛LATS1基因启动子核心区有MEF2A结合位点,据此推测MEF2A对LATS1基因的转录有重要的调控作用。
信号转导及转录激活因子(signal transducer and activator of transcription,STAT)家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6 共7个成员[23],该家族在细胞内信号转导和转录激活中发挥着关键作用[24]。STAT5作为STAT家族的一员,参与调控细胞的增殖、分化和凋亡,也是生长激素(GH)、生长激素释放肽(GHR)、胰岛素样生长因子(IGF)、催乳素以及胰岛素信号通路的重要调控因子[25-27]。研究发现,STAT5基因多态性与鸡的生长和繁殖性状具有一定的相关性[28-29]。HOXA5基因是同源框基因(homeobox genes)家族中重要发育转录因子之一,是个体组织和器官发育所必需的,该基因缺失会导致神经发育异常、肌肉萎缩和新生儿死亡[30]。HOXA5基因在脂肪组织形成和脂肪细胞分化过程中发挥着重要的调控作用,主要参与BMP4/Samd1信号通路,促进白色脂肪组织的棕色化[31]。生肌调节因子(myogenic regulatory factors, MRFs)对肌细胞具有重要的调控作用[32]。Myod1是MRFs家族成员之一,是肌细胞分化、肌纤维形成的重要调控因子,可参与肌细胞增殖、分化以及再生,是肌肉生长发育的核心基因[33]。FoxO1基因是叉头框转录因子家族中一类重要的转录因子,其主要调控细胞凋亡、氧化应激、脂质代谢等[34]。研究发现,FoxO1参与骨骼肌的发育和Ⅰ型纤维正常发生,敲除FoxO1基因的小鼠骨骼肌功能受损,全身肌肉发育不全[35]。综述所述,STAT5、HOXA5、Myod1和FoxO1在个体生长发育以及肌肉形成过程中起着重要的作用。本研究发现,牛LATS1基因启动子核心区有STAT5、HOXA5、Myod1和FoxO1结合位点,据此推断STAT5、HOXA5、Myod1和FoxO1在牛生长发育过程中对LATS1基因具有重要的转录调控作用。

