维生素D干预对大鼠胶原诱导关节炎模型血管功能的影响
付文轶,徐男男,徐内利,张宁
类风湿关节炎(rheumatoid arthritis, RA)是导致关节损伤和肢体残疾最常见的炎症性关节炎。RA的自身免疫和炎性反应可能会促进内皮功能障碍,从而促进动脉粥样硬化的发展[1]。80%的RA患者血管内皮功能受损, 并且与RA的疾病活动相关[2]。RA患者内皮功能障碍可能与肿瘤坏死因子(TNF)-α、白介素(IL)-6、胆固醇(cholesterol,CHOL)、一氧化氮(NO)水平相关[3-6]。已有研究表明TNF-α或IL-6受体拮抗剂可改善RA相关的内皮功能障碍[7-8]。有研究表明维生素D(vitamin D,VD)水平也可能与RA血管功能相关[9-10]。有研究发现VD制剂可能改善慢性肾病患者的血管功能[11-13],活性VD抑制肾素的转录[14]。本研究通过观察维生素D干预对胶原诱导关节炎(collageninduced arthritis,CIA)造模大鼠血管功能的影响,探讨非活性维生素D对类风湿关节炎血管功能的影响。
1 材料与方法
1.1 主要试剂和仪器
冰醋酸(北京索莱宝科技有限公司);鸡Ⅱ型胶原(Sigma);完全氟式佐剂(Sigma);胆维丁乳(国药准字:H10910070 上海信宜金朱药业有限公司);Total 25-OH Vitamin D IVD ELISA Kit(R&D Systems);抗鼠VDR单克隆抗体(Santa Cruz);鼠IgG Kappa结合蛋白偶联辣根过氧化物酶(Santa Cruz);Rat Angiotensin Ⅱ (ANG-Ⅱ) ELISA Kit(CUSABIO);Rat Renin ELISA Kit(CUSABIO);TRIpure 裂解液(Thermo Fisher);Direct-zol RNA MiniPrep PLUS (ZYMO RESEARCH);VDR引物(生工公司);肾素引物(生工公司);β-actin引物(Thermo Fisher);Power SYBRTMGreen PCR Master Mix (SYBR Green);酶标仪(BIO-RAD iMarkTMMicroplate Reader);7500 Real Time PCR System (Thermo Hybaid)。
1.2 实验对象
雌性4周龄体质量100 g左右Wistar大鼠60只,购自辽宁长生生物有限公司,饲养于中国医科大学免疫学教研室的 SPF 清洁级动物实验室。动物实验通过中国医科大学附属盛京医院医学伦理委员会批准。
所有大鼠在适应性饲养3 d后,称重后按体质量分组。空白对照组12只,空白给药组12只,实验组36只,造模CIA模型后,剔除造模不理想大鼠,造模成功者分配于2组实验组,每组12只,分别为造模对照组,造模给药组。
1.3 胶原诱导Wistar大鼠关节炎模型
按照文献[15]方法初次、二次免疫造模。二次免疫造模1周后,评估造模情况,选取造模成功大鼠按体重分配至造模对照组和造模给药组,每组12只。
1.4 药物干预
根据预实验结果,应用胆维丁乳,剂型:8 mL,15 mg,给药组按照30 000 IU/kg给药,对照组给予同等体积生理盐水,应用灌胃针给大鼠灌药。
1.5 取材与标本处理
每组12只大鼠,在初次免疫4周即给药后2周取材,每组剩余6只在初次免疫6周即给药后4周取材。麻醉后分离主动脉,留取血标本,主动脉标本剪成3 mm左右长度,分别于冻存管-80 ℃冰箱和中性福尔马林中浸泡,4 ℃冰箱保存。
1.6 ELISA法检测
大鼠外周血清及主动脉组织中肾素(renin)、血管紧张素Ⅱ(Angiotensin Ⅱ,ANG-Ⅱ):使用Rat Angiotensin Ⅱ (ANG-Ⅱ) ELISA Kit和Rat Renin ELISA Kit所述方法检测血液及主动脉匀浆。
1.7 免疫组化检测
大鼠主动脉组织维生素D受体(vitamin D receptor,VDR): Nikon Eclipse 80显微镜下观察切片,Nikon Digital Sight采集图片。VDR阳性表达产物的免疫组化片呈棕褐色,应用许良中免疫组化十三点评分法半定量分析免疫组化结果。
1.8 qPCR检测VDR及肾素表达
使用Direct-zol RNA MiniPrep PLUS (ZYMO RESEARCH) 提取大鼠主动脉组织RNA,进行浓度测定,反转录RNA获取cDNA,之后qPCR检测VDR及肾素的表达。
1.9 统计学分析
采用SPSS 22.0 统计软件进行统计学分析。分析数据符合正态分布的计量资料以均数±标准差表示,使用单因素ANOVA检验2组数据方差齐性,方差齐则组间比较采用t检验,方差不齐应用Mann-WhitneyU秩和检验;以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠关节炎评分
造模2周时,选择关节炎评分为4分的大鼠分为造模对照组及造模给药物。造模4周时关节炎评分最高,之后逐渐减低。6周观察期内造模对照组及造模给药组无明显差异(图1)。

图 1 各组大鼠关节炎评分及空白组和CIA造模组大鼠典型图Fig 1 Score of Arthritis in each group, and typical diagrams of rat pam in the blank group and CIA modelA:空白组大鼠爪; B:CIA组大鼠爪
2.2 大鼠血清25(OH)VD水平
给药2周及4周分批取材检测大鼠外周血25(OH)VD水平,造模后大鼠血清25(OH)VD水平下降,与空白对照组比较有统计学差异(P<0.05);维生素D制剂干预2周时造模组血清25(OH)VD达到空白对照组水平,4周时略下降(图2)。
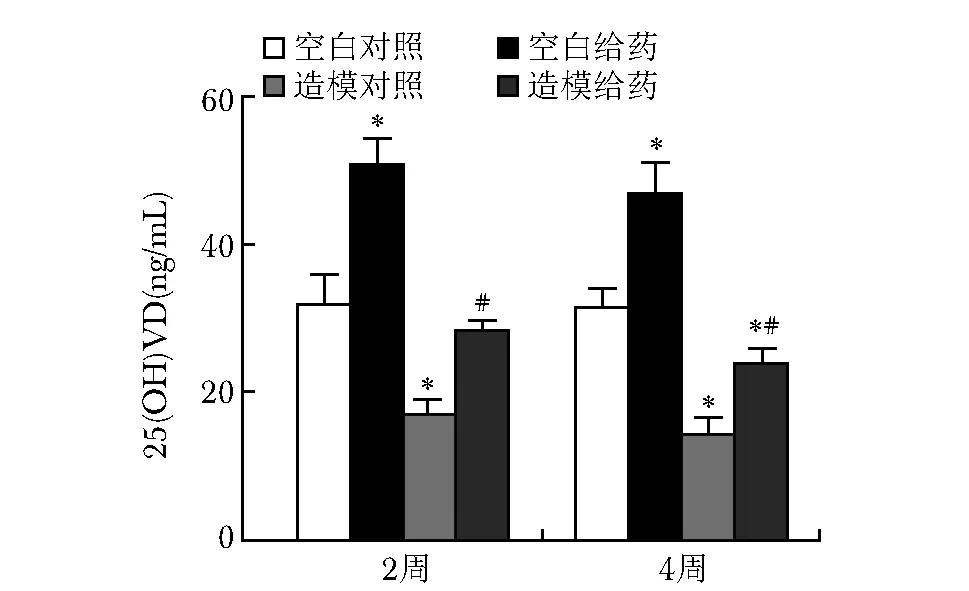
图 2 给药2及4周大鼠外周血25(OH)VD水平Fig 2 25(OH)VD levels in peripheral blood of rats after 2 and 4 weeks of administration与同时期空白对照比较,*P<0.05; 与同时期造模组比较,#P<0.05
2.3 大鼠外周血及主动脉组织肾素、ANG-Ⅱ水平
给药2及4周检测大鼠外周血及主动脉组织肾素、ANG-Ⅱ水平,CIA造模及VD干预未影响大鼠外周血肾素、ANG-Ⅱ水平。而主动脉局部肾素、ANG-Ⅱ水平在CIA造模后增高,VD制剂干预后4周时轻度降低,差异有统计学意义,但仍高于空白对照组(图3)。
2.4 大鼠主动脉VDR表达
造模4及6周时,分别取各组大鼠主动脉组织进行VDR免疫组化,结果经CIA造模,大鼠主动脉VDR表达明显增高,与空白对照比较差异有统计学意义。在4周时造模给药组VDR表达较造模对照组下降,差异有统计学意义。造模6周时造模对照组VDR表达较4周时下降,差异有统计学意义(图4, 图5)。
2.5 qPCR检测大鼠主动脉肾素、VDR表达
给药2及4周时,分别提取各组大鼠主动脉组织RNA,结果显示CIA造模后大鼠主动脉VDR及肾素mRNA水平均升高,与空白对照组比较,差异有统计学意义。VD制剂干预后2及4周均可见VDR及肾素mRNA水平下降,与CIA造模对照组比较,差异有统计学意义。造模6周时CIA造模组VDR比造模4周时下降,差异有统计学意义(图6)。
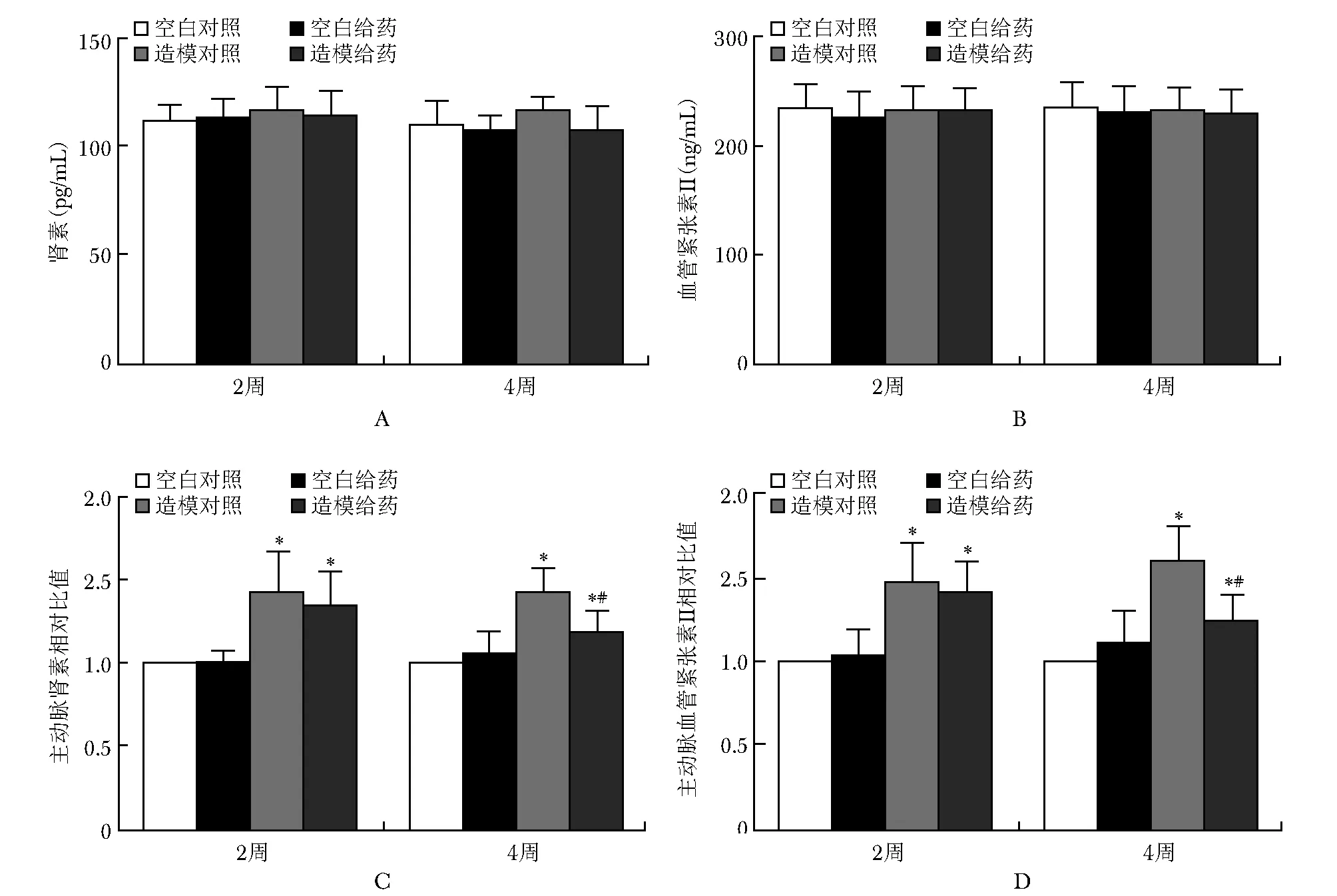
图 3 给药2及4周大鼠外周血及主动脉组织肾素、血管紧张素Ⅱ水平Fig 3 Renin and angiotensin Ⅱ levels in peripheral blood and aorta of rats after 2 and 4 weeks of administrationA: 给药2及4周各组外周血肾素水平;B: 给药2及4周各组外周血血管紧张素Ⅱ水平;C: 给药2及4周各组主动脉肾素水平;D: 给药2及4周各组主动脉血管紧张素Ⅱ水平; 与同时期空白对照比较,*P<0.05; 与同时期造模组相比,#P<0.05

图 4 造模4及6周大鼠主动脉VDR表达Fig 4 Expression of VDR in rat aorta at 4 and 6 weeks after modeling与同时期空白对照比较,*P<0.05;与同时期造模组比较,#P<0.05
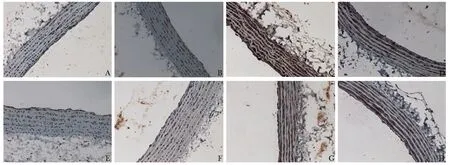
图 5 造模4及6周大鼠主动脉VDR免疫组化Fig 5 VDR immunohistochemistry of rat aorta at 4 and 6 weeks after modelingA: 造模4周空白对照组;B: 造模4周空白给药组;C: 造模4周造模对照组;D: 造模4周造模给药组;E: 造模6周空白对照组; F: 造模6周空白给药组;G: 造模6周造模对照组;H: 造模6周造模给药组(×200)

图 6 给药2及4周大鼠主动脉肾素、VDR mRNA水平Fig 6 mRNA levels of renin and VDR in rat aorta after 2 and 4 weeks of administrationA:给药2及4周大鼠主动脉肾素mRNA水平;B:给药2及4周大鼠主动脉VDR mRNA水平;与同时期空白对照比较,*P<0.05; 与同时期造模对照组比较,#P<0.05
3 讨论
RA 长期慢性炎症负担和自身免疫激活,可能导致血管损伤和动脉粥样硬化斑块形成[16]。RA的大血管和微血管水平都有内皮功能障碍。而VD水平可能与RA血管功能相关[9-10]。大量研究发现RA患者VD缺乏明显[17-19]。本研究通过CIA造模模拟RA,发现和RA患者相同,CIA大鼠血清中25(OH)VD水平下降。
肾素血管紧张素系统是一种激素调节系统,影响血管收缩。经典的肾素由肾脏分泌,肾素激活血管紧张素前体形成血管紧张素Ⅰ,之后水解产生有活性的ANG-Ⅱ从而调节血管舒张。除了经典的途径外,局部组织中如血管壁也发现有肾素及血管紧张素的表达。本研究发现CIA造模对大鼠血清肾素及ANG-Ⅱ水平无影响,而主动脉局部肾素及ANG-Ⅱ水平在造模后升高,VD干预后有所下降,二者变化与主动脉中VDR水平变化一致。
VD对肾素血管紧张素系统的影响机制尚不清楚。既往有研究发现RA伴有高血压患者肾素血管紧张素活性增强[20],RA患者的关节滑膜和滑液中肾素活性增强[21]。已有实验也证实活性VD可抑制肾素血管紧张素系统活性[14,22]。本研究发现CIA大鼠主动脉局部的肾素血管紧张素系统可能受血清VD水平影响。适度补充VD制剂,提高血清25(OH)VD,可能通过局部1α-羟化酶催化为活性VD[23],结合血管局部VDR,形成激素受体复合物,作用于靶基因的特定DNA序列,调节肾素基因的表达,从而减弱局部增高的肾素血管紧张素系统活性,改善局部血管功能[24]。充足的血清25(OH)VD活化也可能通过特定基因调控促进免疫稳态,降低自身免疫反应,降低局部增高的肾素水平。
CIA大鼠主动脉VDR高表达,推测CIA大鼠自身免疫炎症激活血管组织自身稳态修复,高表达VDR通过DNA反应元件影响靶基因表达,调控免疫反应,消耗大量VD,引起血清25(OH)VD水平降低。随造模时间延长,CIA大鼠自身免疫炎症减弱,因此造模对照组VDR表达随时间延长下调。而VD干预后,提升血清25(OH)VD水平,可部分降低组织VDR的高表达,提示可能存在针对VDR的负反馈调节,当血清25(OH)VD缺乏时VDR表达增高,血清25(OH)VD水平回升后,组织中VDR表达相对下调。
总之,CIA大鼠出现血清25(OH)VD水平降低,可能由于自身免疫炎症促使机体维持稳态消耗引起,适量补充VD可能对CIA大鼠血管功能有益。由于CIA造模时限性,无法长期观察CIA大鼠血管形态,需要进一步实验验证VD对CIA大鼠血管功能的作用。

