猪伪狂犬病病毒、猪圆环病毒2型和3型三重PCR检测方法的建立
崔建涛,侯承尧,党钰茗,徐 通,赵 宇,田润博,陈红英* (.河南农业大学 牧医工程学院,河南 郑州 45000;.河南泌阳县农业科学研究所,河南 泌阳 463700)
伪狂犬病病毒(pseudorabies virus,PRV)属于疱疹病毒科,α-疱疹病毒亚科,可以感染各个年龄段猪,引起生长猪呼吸系统疾病、妊娠母猪繁殖障碍、仔猪神经症状并导致高死亡率,特别是15日龄内仔猪,死亡率高达100%[1]。20世纪70年代,我国从匈牙利引入PRV弱毒疫苗Bartha-K61株,该疫苗在1990—2011年间广泛应用,有效控制了猪伪狂犬病在我国的流行。然而,2011年底,我国大部分地区包括接种Bartha-K61疫苗的猪群大规模暴发猪伪狂犬病,给我国养猪业带来了巨大的经济损失[2]。
猪圆环病毒(porcine circovious,PCV)是目前发现的最小的动物病毒,包括PCV1、PCV2和PCV3三种基因型,其中PCV1对猪群没有致病性[3],断奶后多系统衰竭综合征主要由PCV2引起,同时也会侵害猪的淋巴系统,造成免疫抑制[4]。2016年,美国PALINSKI等[5]和PHAN等[6]几乎同时发现PCV3,PCV3与PCV密切相关,患病仔猪表现多方面功能紊乱,导致母猪死亡和流产。
由于PRV、PCV2和PCV3均可引起母猪繁殖障碍和呼吸系统疾病,临床上很难区分这3种病毒是单一感染还是混合感染,有报道称PRV、PCV2与PCV3同时感染猪群时,临床表现变得复杂且病猪死亡率增加[7-8]。本试验建立能够同时检测PRV、PCV2和PCV3的三重PCR方法,为这3种疾病的防控提供灵敏、特异和准确的诊断方法。
1 材料与方法
1.1 病毒株和临床样品PRV强毒株(PRV HN2012)、PCV2、猪细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)均由郑州市猪重大疫病防控重点实验室保存。对本实验室保存的病料样品进行PCR扩增并测序,鉴定为PCV3阳性病料样品作为阳性对照。
2015年1月-2019年12月间,从河南、河北和山西等地多个猪场患有母猪繁殖障碍或/和呼吸系统疾病的猪中采集74份临床组织样品(包含心脏、肝脏、脾脏、肺脏、肾脏、淋巴结和脑)。
1.2 主要试剂病毒DNA快速纯化试剂盒和凝胶回收试剂盒均购自生工生物工程(上海)股份有限公司;Trizol和反转录试剂均购自南京诺唯赞生物科技有限公司;2×Ftaq PCR Master Mix购自北京庄盟国际生物科技有限公司;二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;pMD18®-T载体、X-gal、IPTG、琼脂糖等均购自宝生物工程(大连)有限公司。
1.3 引物设计与合成从GenBank中下载PRV gE基因序列(KF042383、KF017615、KF130880)、PCV2全基因(HQ395054、KX828217、MF616426)和PCV3全基因(KX778720、KX966193、MK340753),利用Meg Align(DNA Star)软件进行同源性分析,找出高度保守区域。应用引物设计软件Primer 5.0,设计3对特异性引物,预期扩增片段长度分别为PRV 429 bp、PCV2 273 bp和PCV3 344 bp。引物由上海生工生物工程技术服务有限公司合成(表1)。

表1 三重PCR引物序列
1.4 病毒核酸的提取按照Trizol说明书提取PRRSV、CSFV、PEDV和TGEV的总RNA,按照反转录试剂说明书将其反转录为cDNA,于-80℃保存备用;根据病毒DNA快速纯化试剂盒说明书,分别进行PRV、PCV2、PCV3和PPV的DNA提取,于-80℃保存备用。
1.5 PRV、PCV2和PCV3质粒标准品制备利用引物对PRVF/R、PCV2F/R和PCV3F/R分别进行PRV、PCV2和PCV3单项PCR扩增。反应体系为:2×Ftaq Master Mix 10 μL,ddH2O 8 μL,上、下游引物各为0.5 μL,模板量为1 μL。反应程序为:95℃ 5 min;94℃ 30 s、56℃ 25 s、72℃ 30 s,共35个循环;72℃ 10 min。PCR产物经2%琼脂糖凝胶电泳检测后,用DNA凝胶回收试剂盒回收PCR产物,连接至pMD18-T载体、构建重组质粒pMD18-PRV、pMD18-PCV2和pMD18-PCV3,经PCR鉴定、测序加以验证。利用紫外分光光度计检测3种阳性质粒浓度,分别计算其拷贝数。
1.6 PRV、PCV2和PCV3三重PCR的建立
1.6.1三重PCR方法反应条件的优化 通过对退火温度(52~62℃)、3种引物比例、DMSO的加入量进行优化,优化的方法是控制变量法,在其他因素均保持不变的条件下,对某一因素的反应条件进行优化,最终确定三重PCR的最佳反应条件。
1.6.2三重PCR方法的特异性试验 应用优化后的三重PCR方法,以PRV、PCV2、PCV3、PPV、PRRSV、PEDV、TGEV、CSFV的DNA或cDNA为模板,进行PCR扩增,扩增产物用2%琼脂糖凝胶电泳检测该方法的特异性。
1.6.3三重PCR方法的灵敏度试验 将构建好的阳性质粒pMD18-PRV、pMD18-PCV2和pMD18-PCV3等体积混合后进行10倍系列稀释,并将各个稀释度的标准质粒作为模板通过已优化条件的三重PCR方法进行扩增,以检测该方法的灵敏度。
1.6.4三重PCR方法的重复性试验 对采自不同地区的同时感染PRV、PCV2和PCV3的5份阳性病料样品DNA进行三重PCR检测,并做3次重复。以确定该检测方法的重复性与可靠性。
1.7 临床样品的检测用建立的三重PCR方法检测2015—2019年采自河南、河北和山西等地部分猪场患有母猪繁殖障碍或/和呼吸系统疾病的74份临床组织样品,并与单项PCR检测方法比较,以确定该方法的准确性。
2 结果
2.1 三重PCR,双重PCR及单项 PCR扩增结果及优化通过对反应体系和扩增条件的优化,最终确定三重PCR的反应体系为25 μL。2×Ftaq Master Mix 12.5 μL,ddH2O 5.5 μL,DMSO 1 μL,PRV、PCV2和PCV3上、下游引物均为0.5 μL(25 μmol/L),PRV、PCV2和PCV3的混合DNA为3 μL。三重PCR的反应程序为:95℃ 5 min;95℃ 30 s、56℃ 25 s、72℃ 30 s,共35个循环;72℃ 10 min。
单项PCR的反应产物经2%琼脂糖凝胶电泳后,分别在400、250和350 bp附近有1条特异性条带(图1),与预期扩增片段大小相符。将回收的PCR产物分别连接到载体pMD18-T进行测序,所测的序列与GenBank上的参考序列比对,其同源性在98%以上,表明PCR产物为PRV、PCV2和PCV3的特异的目的片段。

M.DL2000 DNA Marker;1.PRV、PCV2和PCV3混合模板扩增结果;2.PCV2和PCV3混合模板扩增结果;3.PCV2和PRV混合模板扩增结果;4.PCV3和PRV混合模板扩增结果;5~7.PCV2、PCV3和PRV扩增结果;8~14.阴性对照
2.2 三重PCR特异性结果以建立的三重PCR方法对PRV、PCV2、PCV3、PPV、PRRSV、PEDV、TGEV和CSFV核酸进行PCR扩增,电泳结果显示,能扩增出PRV的429 bp片段、PCV2的273 bp片段和PCV3的344 bp片段,而其他猪病原核酸以及阴性对照均无特异性条带,表明该方法具有良好的特异性(图2)。

M.DL2000 DNA Marker;1.PRV、PCV2和PCV3三重PCR扩增结果;2~7.PEDV、TGEV、PRRSV、PPV、CSFV、E.coli扩增结果;8、9.阴性对照
2.3 三重PCR灵敏度结果经紫外分光光度计分别检测标准质粒pMD18-PRV、pMD18-PCV2和pMD18-PCV3浓度,经计算分别为1.25×1010、6.93×1011和9.12×1010拷贝/μL。将标准质粒等体积混合并进行10倍稀释后进行三重PCR扩增,同时设立阴性对照。结果显示,PRV、PCV2和PCV3的最低检测值分别为1 250.0,693.0和91.2拷贝/μL,表明该方法具有良好的灵敏性(图3)。

M.DL2000 DNA Marker;1~10.PRV、PCV2和PCV3混合质粒稀释10-1 ~10-10后扩增结果;11.阴性对照
2.4 三重PCR重复性试验结果通过已建立的三重PCR方法对采自不同地区同时感染PRV、PCV2和PCV3的5份阳性病料样品DNA进行三重PCR检测,并做3次重复,每次PCR扩增结果均为PRV、PCV2和PCV3阳性,阴性对照无条带,表明该方法具有良好可重复性。
2.5 临床诊断结果应用建立的三重 PCR 方法,对74份临床样品进行检测。结果显示,三重PCR与单项PCR检测符合率为100%,其中PRV、PCV2和PCV3各检出22、53和43份,其检出率分别为29.73%(22/74)、71.62%(53/74)和58.11%(43/74)(表2),同时感染PRV和PCV2为19份,其检出率为25.69%(19/74),同时感染PRV和PCV3为16份,其检出率为21.62%(16/74),同时感染PCV2和PCV3为33份,其检出率为44.59%(33/74),同时感染PRV、PCV2和PCV3为12份,其检出率为16.22%(12/74),表明在患有母猪繁殖障碍或/和呼吸系统疾病的样品中存在PRV、PCV2和PCV3(表2)。
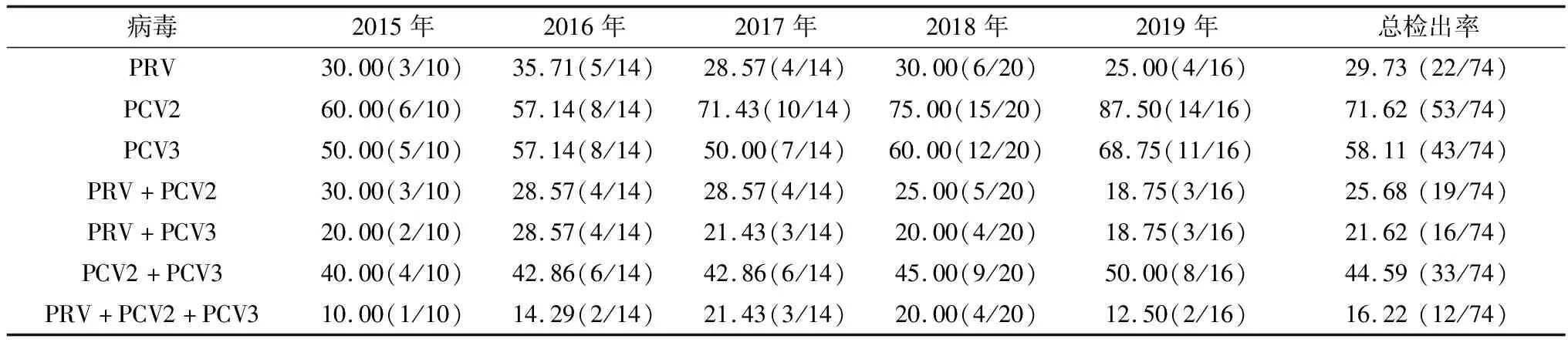
表2 不同年份临床样品检出率 %
3 讨论
自2011年底以来,猪伪狂犬病的再次暴发已严重影响我国养猪业的发展[2]。随后,我国政府在2012年提出PRV根除计划。自2013年后,PRV感染率持续下降[9],但是目前猪伪狂犬病仍然在我国大多数省份流行,且各个地区PRV阳性检出率存在一定差异[10]。尽管有的地区PRV感染率处于较低水平,但是仍未达到根除。我国猪群中PCV2感染情况也不容乐观,李婧雅等[11]对浙江地区的142份病料进行PCR检测,其检出率为56.3%,表明浙江地区的PCV2感染已相当严重。自PCV3被发现以来,PCV3在世界范围内逐渐流行,并在我国多个省份多个猪场存在[7-8,12]。此外,以前研究报道猪群中存在PRV、PCV2与PCV3同时感染[7-8],且PRV、PCV2和PCV3都是猪场常见病原体,影响着我国养猪业的健康发展。
多重PCR方法于1988年提出[13],并用于混合感染的鉴别诊断,该方法具有独特的优势和很好的应用价值。多重PCR不仅具有单项PCR所具有的特异性和敏感性,还能缩短检测时间,节省试剂的用量。影响PCR扩增效率的因素有很多,其中引物对于PCR扩增的敏感性和特异性至关重要。本试验为确保PCR反应的特异性,分别选择了PRV的gE基因、PCV2和PCV3的Rep基因,并针对其保守序列设计了3对特异性的引物,扩增的目的片段大小分别为429、273和344 bp,相邻病原体的片段大小相差约80 bp,具有一定的长度梯度,凝胶电泳时能够较直观的区分不同的病原体。另外,PRV基因组G+C含量高达73%左右[14],PCR中变性温度较高,很难与其他病毒在同一条件进行普通PCR反应,有研究表明PCR扩增体系中加入DMSO,可显著提高PCR扩增的特异性和扩增效率[15],因此本研究在其反应体系中加入适量DMSO,降低了核酸链的Tm值,使其容易变性,解决了因GC含量过高,不能正常扩增出PRV野毒株gE基因的问题,也不影响普通模板的扩增,使反应更容易进行。
特异性试验结果表明,只有PRV、PCV2和PCV3的三重PCR产物出现目的条带,其他猪病原核酸(PPV、PRRSV、PEDV、TGEV、CSFV)均无条带,表明该方法的特异性较高。灵敏度试验结果表明,PRV的最低检测限为1 250拷贝/μL,与吴旭锦等[16]建立的PRV套式PCR方法灵敏度相当。PCV2的最低检测限为693拷贝/μL,与杨宗照等[17]所建立的多重PCR方法的灵敏度基本一致,PCV3的最低检测限为91.2拷贝/μL,与徐朋丽等[18]所建立的普通PCR方法以及郝占武等[19]建立的PCV3 qPCR方法检测下线相当。试验结果还显示该三重PCR方法重复性好,且与单项PCR检测符合率为100%。表明所建立的三重PCR具有准确、灵敏和特异特点,能为PRV、PCV2和PCV3的临床诊断提供准确和可靠的检测结果。
本研究采用建立的三重PCR方法,对2015年-2019年河南、河北和山西等地部分猪场患有母猪繁殖障碍或/和呼吸系统疾病的74份临床样品进行检测,PRV检出率为29.73%,且2015、2016、2017、2018和2019年分别为30.00%、35.71%、28.57%、30.00%和25.00%,高于孙颖等[10]对2018年我国28个省、市、自治区规模化猪场各年龄段疑似猪伪狂犬病发病猪的1 328份组织样品的PRV检出率(6.93%),这可能因为试验的样品量小,或者不同的试验组所使用的引物特异性不同而造成。PCV2和PCV3的检出率分别为71.62%和58.11%,与徐朋丽等[20]报道的PCV2和PCV3检出率相当。2015、2016、2017、2018和2019年,PCV2检出率分别为60.00%、57.14%、71.43%、75.00%和87.50%,PCV3检出率分别为50.00%、57.14%、50.00%、60.00%和68.75%,可见PCV2和PCV3于2018年后呈现明显增高的趋势。此外,PRV和PCV2同时感染的检出率是25.69%,PRV和PCV3同时感染的检出率是21.62%,PCV2和PCV3同时感染的检出率是44.59%,PRV、PCV2和PCV3同时感染的检出率是16.22%。表明PRV阳性率较高,PRV仍未达到根除,PCV2和PCV3的检出率依然较高,且PRV、PCV2和PCV3之间双重或三重混合感染也相当严重,提示应加强对PRV、PCV2和PCV3的临床诊断和监测。
随着我国养猪业的规模化发展,多种病原混合感染日益严重。PRV、PCV2和PCV3不仅能够引起猪呼吸系统疾病,而且都能够引起母猪繁殖障碍,危害严重,而临床上很难区分是由PRV、PCV2或/和PCV3感染所引起的,因此,本试验建立了一种特异、灵敏和准确的PRV、PCV2和PCV3三重PCR检测方法,可达到单重PCR的检测效果,而且极大地节约试验成本,更符合对疾病快速诊断的要求,降低了检测工作者的任务量,为我国的PRV、PCV2和PCV3的监测和防控提供技术保障。

