干扰素调节因子2 结合蛋白2 在斑马鱼胚胎早期发育过程中的表达谱分析
王海红,高 硕,朱 军,周 隽
上海交通大学医学院附属瑞金医院中法生命科学和基因组研究中心,上海200025
干扰素调节因子2 结合蛋白2(interferon regulatory factor 2 binding protein 2,IRF2BP2)因首先被发现可与干扰素调节因子2(interferon regulatory factor 2,IRF2)结合并作为其转录辅因子而得名[1]。在人类基因组中只有1 个IRF2BP2 基因(基因ID 359948,定位于染色体1q42.3),由于剪接方式不同其可产生2 种转录物——IRF2BP2a 和IRF2BP2b。而在斑马鱼基因组中则有2 个横向同源基因,被分别命名为irf2bp2a(基因ID 335866,定位于13 号染色体)和irf2bp2b(基因ID 406614,定位于11 号染色体)。IRF2BP2 基因属于IRF2BP 家族,该基因在物种进化中极为保守,其蛋白质结构含有1个位于N端的C4 型锌指结构域和1 个位于C 端的C3HC4 型环指结构域。这种特殊的结构特征为该蛋白家族所特有,不同于任何其他已知类型的转录调节因子。目前已知IRF2BP2 蛋白的锌指结构域具有与家族成员形成同聚体或异聚体的能力,环指结构域具有与其相互作用蛋白结合的能力[2]。
人类IRF2BP2 基因在多种组织中广泛表达,在骨髓中的表达丰度最高。多项研究发现IRF2BP2 在多种生理或病理造血发育过程中发挥功能。IRF2BP2可抑制T细胞受体(T cell receptor,TCR)诱导的CD4阳性T淋巴细胞的激活与克隆增殖[3]。在对原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)患者进行全基因组外显子测序的结果中发现了高突变性的IRF2BP2 基因[4]。近年来有报道[5-8]指出IRF2BP2 与人类血液肿瘤有重要联系,在4 例早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者中检测到IRF2BP2-维甲酸受体α(retinoic acid receptor α,RARα)这一新型融合基因。此外,Irf2bp2基因敲除小鼠由于红系发育异常而导致胚胎致死[9]。除造血系统外,人类多组织RNA印迹法(Northern blotting)分析发现IRF2BP2 mRNA 在心脏和骨骼肌中也高度表达;IRF2BP2可作为一个缺血诱导的调控因子参与缺血状态下心脏和骨骼肌血管的再生过程[10]。
模式生物斑马鱼在发育生物学研究中具有诸多优势。人类IRF2BP2 和斑马鱼Irf2bp2 蛋白在N 端和C 端有着几乎相同的锌指和环指结构域[2]。进化分析进一步显示这2个基因来自于共同的祖先[10],使得我们利用斑马鱼作为模型探讨irf2bp2 基因在发育过程中的生物学作用成为可能。我们对irf2bp2 的2 个横向同源基因在胚胎期和幼虫期的斑马鱼的时空表达谱进行分析,这将为研究其在发育中的生物学功能提供线索。
1 对象与方法
1.1 斑马鱼品系与基本培养条件
本研究使用的斑马鱼系的遗传背景为图宾根(Tubingen,TU),饲养于上海交通大学医学院附属瑞金医院鱼房。饲养条件:温度设定为28.5 ℃,pH 值控制在6.5~7.5,水循环系统的电导率设定为400~500 μS/cm。整个动物实验符合动物福利原则,并获得上海交通大学医学院附属瑞金医院动物伦理委员会审批。
1.2 质粒构建和探针制备
用于全胚胎原位杂交(whole mount in situ hybridization,WISH)的irf2bp2a 和irf2bp2b 探针质粒均以野生型斑马鱼胚胎[混合时相,受精后24 h(24 h post fertilization,24 hpf)、48 hpf 以及受精后3 d(3 d post fertilization,3 dpf)] cDNA 为模板,经PCR 反应扩增获得。引物序列见表1。探针质粒首先进行酶切,回收后使用SP6 RNA 聚合酶或T7 RNA 聚合酶试剂盒(赛默飞,美国)合成反义RNA探针。
1.3 mRNA WISH检测
使用斑马鱼irf2bp2a和irf2bp2b基因的反义RNA探针分 别 在 单 细 胞 期、6 hpf、12 hpf、24 hpf、30 hpf、36 hpf、48 hpf、72 hpf 和5 dpf 进 行mRNA WISH 检 测。用正义RNA 探针进行原位杂交的胚胎作为阴性对照。胚胎的体位包括侧视、俯视和腹视。使用5-溴-4-氯-3-吲哚基- 磷 酸 盐/四 唑 硝 基 蓝(5-bromo-4-chloro-3-indolyl phosphate/tetranitroblue, BCIP/NBT) 显 色 试 剂 盒(AR1023,武汉博士德生物工程有限公司)染色结束后将胚胎放入甲基纤维素中,在DM4 型正置显微镜(莱卡,德国)下观察并拍照。
1.4 实时定量PCR
以TRIzol 试剂(赛默飞,美国)提取斑马鱼胚胎总RNA,之后用单链cDNA合成反转录试剂盒(赛默飞,美国)将其反转录为cDNA。反应结束后用分光光度仪测量浓度。应用ChamQ Universal SYBR qPCR Master Mix(赛默飞,美国) 试剂盒进行实时定量PCR (real-time quantitative PCR,qPCR)。引物序列见表2。使用ABI ViiA7 仪器内预设的程序进行PCR 反应。待程序结束后,导出每组PCR 反应的CT值,以β-actin 为内参处理数据并绘制图表。irf2bp2a和irf2bp2的表达水平以2-ΔCT表示。

表2 qPCR引物序列Tab 2 Primer sequences for qPCR
1.5 统计学方法
应用SPSS 25.0 软件进行数据的统计分析,定量数据以±s表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 irf2bp2a在斑马鱼早期胚胎发育中的表达谱分析
WISH 检测结果显示irf2bp2a 基因有明显的母源表达(图1A)。进入原肠胚期后,在6 hpf 的胚胎中irf2bp2a 呈较弱的躯干泛表达(图1B),而在胚胎体节初期(12 hpf)同样呈现躯干泛表达(图1C)。在咽囊期初期(24 hpf)irf2bp2a 主要在视网膜、晶状体、端脑、小脑、中脑、中后脑交界、后脑以及听囊和嗅囊中表达,并伴随一定的肌节弱表达(图1D)。在咽囊期的前几个小时,胚胎继续保持开始于15 hpf(结果未显示)的快速伸长状态,但随后伸长速度突然下降,而在此过程中很多器官发育趋于完善。连续性地收集了30 hpf和36 hpf时相的胚胎,观察irf2bp2a 的表达情况,发现在30 hpf 其主要表达在胚胎咽、胸鳍、后部造血岛、肌节、听囊和嗅囊中(图1E)。在脑组织中,irf2bp2a 的最强表达出现在端脑、中脑和后脑;由于irf2bp2a的表达,可观察到中脑(其后部除外)有一条显著的水平沟将中脑顶盖(沟的背侧)和中脑被盖(沟的腹侧)分开(图1E2)。irf2bp2a 在36 hpf的表达情况与30 hpf较相似,但其在后部造血岛以及菱脑节的表达更为显著,此时已很难观察到其在肌节的表达(图1F)。在24~72 hpf可以观察到相似的irf2bp2a表达情况,但其在头部区域的表达从特定地集中于中后脑区域转变为整个脑组织(包括菱脑节)的泛表达(图1G)。值得注意的是,在48 hpf 的胚胎中,irf2bp2a 在肝脏区域、咽以及咽囊区域有明显表达(图1G2)。在72 hpf,irf2bp2a 依然在脑组织中呈现泛表达状态(图1H),同时也出现在嗅囊、下颌以及咽弓处(图1H2)。到5 dpf,irf2bp2a在所有部位的表达都显著降低,但在鱼鳔和表皮处依然有较弱的表达(图1I)。
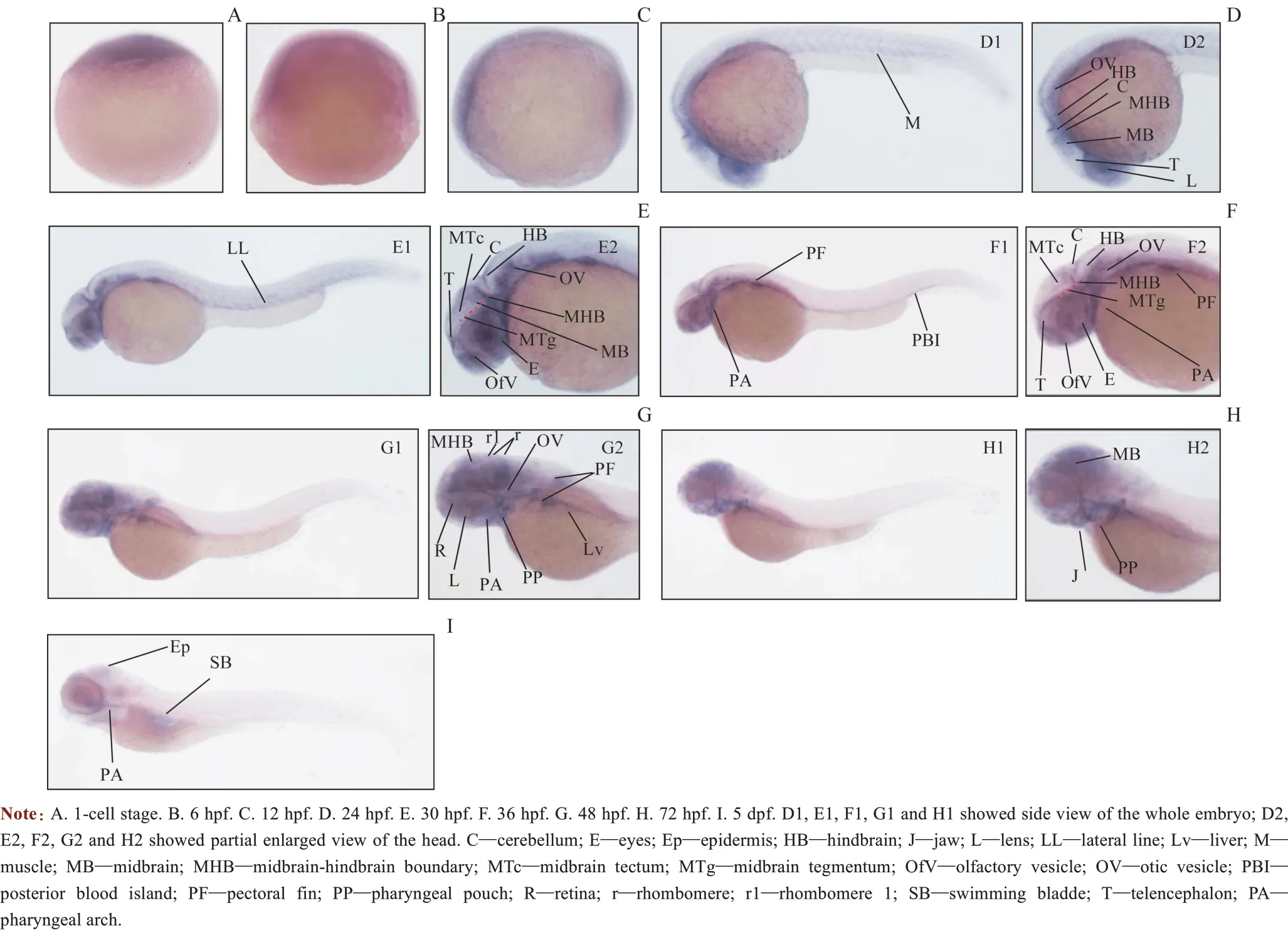
图1 WISH检测斑马鱼irf2bp2a基因在胚胎中的表达Fig 1 Expression of irf2bp2a analyzed by WISH during zebrafish embryogenesis
2.2 irf2bp2b在斑马鱼早期胚胎发育中的表达谱分析
与irf2bp2a 不同的是,irf2bp2b 并没有明显的母源表达(图2A),其在单细胞期以及6 hpf 时都显示出较微弱的表达(图2B),直至12 hpf 在躯干呈现泛表达(图2C)。在24 hpf,irf2bp2b 在肌节、胸鳍、原肛和头部区域表达,其中头部区域主要集中在晶状体、视网膜、端脑、中脑、后脑、中后脑交界、听囊和嗅囊(图2D)。在36 hpf,irf2bp2b 在肌节中的表达减少,主要集中在晶状体、胸鳍、听囊、嗅囊、咽囊和咽弓区域(图2E)。从尾部横断切面观察,发现其在表皮及斯坦尼小体处表达(图2E3)。斯坦尼小体是一个涉及钙离子调控的小器官,通常均匀地分布在两侧,但左右两侧不对称的情况也时有出现。在48 hpf,观察到irf2bp2b 在脑组织中的表达进一步减弱;有趣的是,其在中脑组织中出现了明显的表达,而在眼、听囊、嗅囊、咽弓、下颌以及胸鳍部位依然能观察到irf2bp2b 的表达(图2F)。在所有时相中,仅在48 hpf 检测到irf2bp2b 在心脏区域表达(图2F3,腹面观),而irf2bp2a 在心脏部位未曾检测到表达。到72 hpf可以观察到irf2bp2b在所有部位的表达开始减弱,头部区域仅中脑、咽弓、咽囊处有较弱的表达(图2G)。5 dfp的WISH 检测结果显示,irf2bp2b 的表达情况与72 hpf 相似,且irf2bp2b开始在鱼鳔中出现(图2H)。
2.3 irf2bp2 基因在斑马鱼早期胚胎发育中表达水平的检测分析
在对irf2bp2的2个横向同源基因进行WISH 分析后,利用qPCR 分析irf2bp2a 和irfbp2b 分别在单细胞期、6 hpf、12 hpf、24 hpf、30 hpf、36 hpf、48 hpf、72 hpf和5 dpf 时相的胚胎整体表达水平。在胚胎发育期各时相都检测到了irf2bp2a 和irf2bp2b 基因的表达,但表达水平各不相同(图3A、B)。irf2bp2a 基因在单细胞期有强烈的母源表达,而irf2bp2b 的表达水平在6 hpf 最弱,与WISH 结果相一致。从6 hpf 到5 dpf,irf2bp2a 的表达水平在24 hpf 时达到峰值,之后表达水平逐渐下降。irf2bp2b 从6 hpf 到5 dpf 的表达趋势与irf2bp2a 相似,并且在24 hpf 达到峰值。值得注意的是,从整体的表达水平来比较,irf2bp2b 的表达水平要略高于irf2bp2a(图3C)。
3 讨论
作为一个泛表达的转录辅因子,IRF2BP2 可以和多个转录因子结合,并在不同的生理和病理过程中发挥功能。例如,生理状态下IRF2BP2 基因在成人心肌和骨骼肌表达[10],而在人类过度肥大的左心室中可发现IRF2BP2 蛋白表达水平明显提高[11];在小鼠中irf2bp2 的功能丧失性突变可以促进心脏肥厚性反应,而IRF2BP2的过表达则显示出强烈的保护性作用[11]。在斑马鱼胚胎发育过程中,通过WISH实验我们发现irf2bp2的2个横向同源基因中只有irf2bp2b 在48 hpf 的胚胎心脏区域表达,而在斑马鱼躯干肌节中均检测到了2 个同源基因的表达,但irf2bp2b 的表达要强于irf2bp2a 基因。此外,我们还发现只有irf2bp2a 基因在48 hpf 的胚胎肝脏区域有明显表达。这些结果提示斑马鱼irf2bp2a 和irf2bp2b 可能在心脏和肝脏发育中具有不同功能,而在肌节发育过程中的功能相似。
另外,检索人类蛋白质图谱(The Human Protein Atlas)数据库中IRF2BP2 的表达,发现IRF2BP2 在多种造血细胞中表达,提示IRF2BP2 在造血发育过程中具有重要作用。有报道[12]显示IRF2BP2可作为一个在巨噬细胞极化过程中的重要调控因子,小鼠和人类中IRF2BP2基因的缺失会降低巨噬细胞炎症水平和动脉粥样硬化的易感性。 常见变异性免疫缺陷(common variable immunodeficiency,CVID)是一种重要的原发性免疫缺陷疾病。IRF2BP2 的单基因缺陷是引起这种疾病的原因之一[13-14]。此外,IRF2BP2 被发现与原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)的发生相关[4]。还有报道[9]提示IRF2BP2 和辅因子核心结合因子α2(core binding factor α2,ETO2)相互作用并参与红细胞终末分化,并且IRF2BP2 缺失小鼠会因红系发育异常而导致胚胎死亡。在我们的研究中,WISH 检测结果显示斑马鱼irf2bp2a 在后部造血岛表达;而后部造血岛是在30 hpf 时相的一个造血区域,提示irf2bp2a可能在造血发育过程中发挥功能。
在小鼠小胶质细胞中Irf2bp2 的缺失不仅会影响抗焦虑药对新生小鼠的治疗效果[15],而且会加重局灶性缺血性脑损伤后的炎症反应和功能性缺失[16]。另外有研究[17]发现,小鼠Irf2bp2 的缺失会导致高脂肪饮食相关的脑损伤病情恶化以及肝脏血脂异常。在斑马鱼胚胎发育中irf2bp2a 和irf2bp2b 基因最显著的表达出现在脑部区域,但二者的表达水平和持续时间不同。irf2bp2a 在脑组织区域中的表达水平和持续时间都要强于irf2bp2b。这些结果提示,irf2bp2 基因在脑组织发育过程中可能也有着重要作用。
本研究主要通过WISH技术对斑马鱼irf2bp2的2个横向同源基因进行了时空表达分析,并揭示了二者在表达谱上的相似性和不同之处,这将为今后的功能研究提供一定的线索与提示。

