胰门板降低技术在胰腺段胆总管囊肿切除术中的应用
王 伟,许鑫森,杨传鑫,陈 炜,王 坚
1.上海交通大学医学院附属仁济医院胆胰外科,上海200127;2.上海交通大学附属第六人民医院肝胆胰外科,上海200233
对于董氏分型为C2 型(即Todani分型为Ⅰ、Ⅳb 型)和D 型(即Todani分型为Ⅳa 型)的胆总管囊肿而言,安全彻底地切除胰腺段囊状扩张的胆管是防止术后残余囊肿发生癌变、治愈该两型囊肿的关键手段之一[1-2]。由于胆总管囊肿患者的扩张胆管周围多有炎性粘连,且胰腺段胆管深埋于胰头后方,在分离胰腺段扩张胆管过程中易损伤胰腺和主胰管,因此该问题成为了此类胆管囊肿手术的难点[3]。与肝脏包绕胆管、肝动脉和门静脉形成肝门结构类似,胰腺也包绕进入胰腺实质的胆总管胰腺段,我们将此结构称为“胰门”,将敞开“胰门”显露胆总管胰腺段的操作技术称为“胰门板降低技术”。在手术过程中,该技术可全程显露胆总管胰腺段直至胆胰管汇合部。基于此,本研究回顾性分析15例董氏分型为C2型的胆总管囊肿患者的临床病理资料,探讨胰门板降低技术在胆总管囊肿切除术中的应用价值。
1 对象与方法
1.1 研究对象
选择2016 年1 月—2019 年12 月于上海交通大学医学院附属仁济医院胆胰外科收治的董氏分型为C2 型的胆总管囊肿患者。纳入标准:①采用胰门板降低技术施行胆总管囊肿切除治疗。②临床病理资料完整。排除标准:①病变胆管发生癌变。②合并有改变存活状况的胆囊癌和肝内胆管癌。最终,共纳入15 例患者(男性6例、女性9 例),年龄为(35.5±11.6)岁;其中,术前有8 例患者表现出中上腹痛、背痛、发热、黄疸等临床症状中的一种或多种。本研究符合《赫尔辛基宣言》的要求,所有纳入研究的患者及家属均在术前签署了知情同意书。
1.2 研究方法
1.2.1 术前评估 除常规检查外,所有患者均需在术前行肝功能检测[包括谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、碱性磷酸酶(alkaline phosphatase,AKP)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)、总胆红素(total bilirubin,TBil) 和直接胆红素(direct bilirubin,DBil)等水平],肿瘤标志物检测[包括 甲 胎 蛋 白(alpha-fetoprotein, AFP)、 癌 胚 抗 原(carcinoembryonic antigen, CEA) 及 糖 类 抗 原199(carbohydrate antigen 199,CA199)等水平],腹部CT 检查及核磁共振胆胰管成像(magnetic resonance cholangiopancreatography,MRCP)检查。同时,主刀医师需通过腹部CT 和MRCP 检查判断患者的胆总管囊肿类型及胆总管囊肿与主胰管的汇合方式。
1.2.2 手术过程及其指标观察 手术过程如下:①术中探查。仔细探查囊肿的大小、界限及与周围组织关系;纵行切开囊肿前壁,联合胆道镜探查囊肿黏膜情况,怀疑癌变时应及时行术中冰冻病理检查。②游离胆总管囊肿后壁。游离胰头-十二指肠区域,将胆总管囊肿连同胰头及十二指肠一并托起;如有胰腺组织桥式包绕胆管(即胰舌叶)则需切断,并对其断面予以缝扎。③离断胆总管囊肿上方的胆管。解剖肝十二指肠韧带,充分显露肝门部胆管,于扩张胆管上方横行切断肝管,注意保护右肝动脉;锐性分离胆总管囊肿并向右后下方牵引胆总管囊肿至十二指肠上缘,仔细断扎来自门静脉和肝动脉的小分支。④采用胰门板降低技术游离胰腺段胆总管囊肿。离断并结扎十二指肠球部与胆总管之间的小血管,逐步下翻十二指肠球部,显露被十二指肠遮挡的胆总管前壁和胰腺;游离胃十二指肠动脉,断扎胃十二指肠动脉的胆管分支;继续沿胰腺与胆总管之间的解剖间隙,采用小功率电刀进行分离并逐步下翻胰腺,电凝与断扎所遇胆总管与胰腺之间的小血管,显露胰腺段胆总管直至胆胰管汇合处。⑤胆胰管汇合处处理及胆总管囊肿切除。对于主胰管与囊肿远端的正常胆管汇合者,于胆总管末端狭窄处离断,残端予以缝扎(图1A);对于主胰管与囊肿汇合者,需在胰管开口上方离断囊肿并将囊壁剪成喇叭状,间断缝合关闭以维持完整的胰液引流通道(图1B),最终移除胆总管囊肿。若术中发现主胰管损伤,需立即于主胰管损伤处放入口径合适的支撑导管,其一端置入远端的正常主胰管内,另一端置入近端的十二指肠内,然后以6-0 普迪思缝线(polydioxanone suture,PDS)修补主胰管的裂口。⑥采用5-0 PDS 行胆管空肠黏膜对黏膜单层连续吻合。

图1 胰腺段胆总管囊肿与主胰管的汇合方式示意图Fig 1 Schematic diagram of junction between intrapancreatic choledochal cyst and main pancreatic duct
观察并记录术中胆总管囊肿类型、胆总管囊肿与主胰管汇合方式、手术成功率、手术时间及术中输血率。
1.2.3 术后处理及其指标分析 术后,常规向患者行预防感染、抑制胃酸和胰液分泌等治疗。严密观察患者腹部体征、腹腔引流情况,待腹部超声或CT 复查确认无腹腔积液后可拔除引流管。随后,收集并分析患者的首次下床活动时间、首次肛门排气时间、恢复饮水时间、术后并发症、病理学检查结果及转归情况。
1.2.4 随访及其指标分析 采用门诊方式对所有入组患者进行随访,记录患者的存活状况以及是否出现腹痛、畏寒、发热、黄疸等临床表现;常规行肝功能和肿瘤标志物检测,通过腹部超声、MRI或CT 检查判断有无远期并发症(胆肠吻合口狭窄、胆管扩张和胆管癌变)。随访时间的终点为2019年12月。
1.3 统计学方法
采用SPSS 22.0 软件对研究数据进行统计分析。符合正态分布的定量资料以±s表示,符合偏态分布的定量资料以M (Q1,Q3) 表示。定性资料以频数(百分比)表示。
2 结果
2.1 术前评估
对本研究纳入的15 例患者进行术前评估,其肝功能检测结果如下:GPT 为13.5(8.8,50.3)U/L,GOT 为16.0(12.8,26.8)U/L,AKP 为63.5(59.5,88.5)U/L,γ-GT 为23.5 (11.8,204.8) U/L,TBil 为13.4 (8.9,24.5)μmol/L,DBil 为4.7(3.3,10.7)μmol/L;肿瘤标志物检测结果显示,AFP、CEA 水平均属于正常生理范围,有4 例患者的CA199 水平高于正常生理范围。腹部CT 和MRCP 检查结果显示:①胆总管囊肿类型方面,均为董氏分型C2型胆总管囊肿,其中6例(40.0%)患者伴有囊肿内结石。②汇合方式方面,有7 例(46.7%)患者呈现主胰管与囊肿远端的正常胆管汇合(图2A、B),8例(53.3%)呈现主胰管与囊肿汇合(图2C、D)。
2.2 手术情况
术中,15 例患者均被证实为董氏分型C2 型胆总管囊肿,且患者的主胰管与囊肿的汇合方式与术前评估相一致;所有患者均经胰门板降低技术成功切除胰腺段胆总管囊肿(具体手术过程见图3),术中均未输血,亦未发生病变胆管残留、主胰管损伤,手术时间为(170.0±22.7)min。

图2 董氏分型为C2型的胆总管囊肿患者的术前影像学评估Fig 2 Preoperative imaging evaluation of patients with choledochal cyst (Dong type C2)
2.3 术后情况
术后,15例患者的首次下床活动时间为(4.0±0.8)d,首次肛门排气时间为(2.6±0.5) d,恢复饮水时间为(2.0±0.8)d。其中,有8 例(53.3%)患者发生术后并发症,分别为生化级胰漏1 例、B 级胰漏1 例、胃瘫1 例、生化级胰漏合并胆漏1 例、肠梗阻1 例、生化级胰漏合并肠梗阻1 例、腹腔积液伴感染1 例、伤口感染1 例;经腹腔引流、抗感染、营养支持、换药等治疗后,该8例患者分别于术后12、19、24、52、29、35、12、28 d 痊愈出院。其余7 例(46.7%)患者恢复平稳,未出现并发症,于术后7~12 d痊愈出院。
2.4 术后病理学检查
15 例患者的病理学检查结果均为胆总管囊肿伴黏膜慢性炎,其中有13 例合并慢性胆囊炎。在该13 例中,有1例伴胆囊腺瘤、上皮轻-中度不典型增生,2例伴胆囊胆固醇性息肉,2例伴胆囊腺肌症。
2.5 随访情况
15 例患者均获得术后随访,随访时间为5~48 个月。随访期间,所有患者均生存良好,未出现腹痛、畏寒、发热、黄疸等临床表现,肝功能和肿瘤标志物检测结果显示所有指标基本属于正常生理范围,无胆肠吻合口狭窄、胆管扩张和胆管癌变发生。
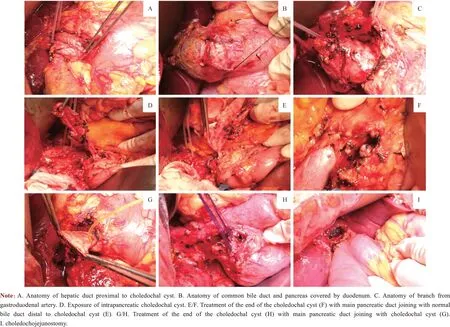
图3 采用胰门板降低技术行胆总管囊肿切除Fig 3 Resection of choledochal cyst through the lowering of intrapancreatic plate approach
3 讨论
胆总管囊肿的手术原则是彻底去除病变胆管组织,实现胆胰分流,达到解决胆汁淤滞、胆道感染和防止癌变的目的,因此囊肿彻底切除联合肝管空肠吻合术是较为公认的治疗胆总管囊肿的手术方式[1-3]。对于胰腺段胆总管囊肿,常规采用挖地雷似地剜除式切除术,但该手术在实际操作中很难彻底切除囊肿且风险较大,因此有不少医者采用该方法行囊肿部分或大部切除术时,易出现部分胰腺段囊性扩张胆管残留,从而使残留囊壁癌变,并引起残留囊性扩张胆管内胰液潴留,进而导致蛋白栓、结石及术后急性胰腺炎等并发症发生[2,4-5]。因此,安全彻底地切除包括胰腺段在内的囊性扩张胆管且不损伤主胰管,对于防止残留胰腺段囊肿癌变、减少术后胰腺并发症等十分必要。
了解胰腺段囊性扩张胆管的解剖层次和血供特点,对指导手术切除至关重要。相关文献[6]报道,胰腺内囊性扩张胆管由内向外由黏膜层、固有层及纤维结缔组织层组成,其血供主要来自胰十二指肠上的动脉分支;这些血管分支可形成血管丛,分布于囊性扩张胆管的纤维结缔组织层表面,包绕囊性扩张胆管并向壁内深入,形成两个壁内血管丛,分布于纤维结缔组织层与固有层之间以及固有层与黏膜层之间。因此,我们在行胰腺段囊性扩张胆管切除时结扎胃十二指肠动脉,阻断胰腺段囊肿血供,从而减少分离过程中的出血。在胰腺段囊性扩张胆管的纤维结缔组织层与前方的胰腺实质之间,如同肝门板与前方肝实质一样,存在天然的解剖间隙,其可为显露胰腺段胆管提供天然的解剖路径。基于此,本课题组将胰腺段囊性扩张胆管的纤维结缔组织层视为胰门板,运用胰门板降低技术(如同降低肝门板一样),沿胰腺段胆管与胰腺组织之间进行分离,仔细结扎切断囊肿和胰腺之间的小血管,逐步下翻胰腺来实现胰腺段胆管囊肿的游离直至胆胰管汇合处。该方法不仅可以全程显露胰腺段胆管,控制术中出血,还有助于识别狭小的胆管末端和胆胰管汇合方式,以增加手术的安全性。
胰腺段胆总管囊肿切除术中还应注意主胰管大致走行方向、胆管下段狭窄段的长度,特别是胆胰管汇合方式,以避免主胰管损伤、术后难治性胰漏发生和急性胰腺炎的发作[7]。根据本研究纳入的胰腺段胆总管囊肿患者情况,我们将其胆胰管汇合方式分为2类,一类是主胰管与胆总管囊肿远端的正常胆管汇合,另一类是主胰管与胆总管囊肿汇合。研究[8-9]显示,术前CT、MRCP、内镜下逆行胰胆管造影术和皮肝穿刺胆道造影术检查有助于观察胆胰管全貌,对指导处理胆胰管连接部和避免主胰管损伤有重要的参考价值;且在以往的临床实践中,临床医师主要根据术前影像资料或术中胆胰管造影所示的胆胰管连接部形态,结合囊内插入探针引导或胆道镜引导等方法识别、确认胆管末端及主胰管开口[10]。而通过上述方法确认胆胰管的汇合方式是间接的,或相对盲目。本研究采用的胰门板降低技术可全程显露胰腺段胆管直至胆胰管汇合处,能够在直视下探查胆胰管的汇合方式,有利于完整切除胆胰管连接部以上胆管,并最大限度地避免主胰管损伤;同时,在充分显露胆胰管汇合处的情况下,即使发生主胰管损伤,也可及时发现并加以修复,以避免胰漏的发生。
在胆管囊肿完整切除后,临床医师应常规仔细检查胆管壁情况,如见异常隆起、胆管腔内见黏冻样物质而疑似癌变时,应及时行术中冰冻病理检查;如为癌变,需即刻施行胰十二指肠切除术,以实现对胰腺段胆管囊肿癌变的根治。对于囊肿切除后的胰腺创面,可在术中予以间断缝合关闭,以避免创面渗血、消除肉眼未能发现的细小胰漏,并于术后酌情使用生长抑素类药物来减少胰漏[2,10];但当创面过大或过深导致缝合困难时,则可予大网膜填塞,同时勿过早拔除引流管,持续敞开冲洗引流,从而减少胰漏的发生[2]。
综上所述,胰门板降低技术可以全程显露胰腺段胆总管直至胆胰管汇合处,是安全彻底切除胰腺段囊性扩张胆管的重要保障。该技术在治疗胰腺段胆总管囊肿的实际应用过程中安全可行,疗效满意,或将成为切除胰腺段胆总管囊肿的一种新方法。

