NaCl胁迫对白玉兰形态及生理特性的影响
金荷仙 沈徐悦 陈蓉蓉 吴 振 申亚梅 张冬梅
(1. 浙江农林大学风景园林与建筑学院,临安 311300;2. 上海市园林科学规划研究院,上海 200232)
我国是世界白玉兰(Magnolia denudata Desr.)的起源中心与分布中心[1],现广泛栽培于全国各大城市园林中。目前关于白玉兰的研究主要集中在繁育[2~5]、解剖[6]及抗寒性[7]方面,常鹏杰等[8]对白玉兰在盐胁迫下目的基因表达的内参基因筛选进行深入探讨,除此之外,未见对其相关耐盐性研究报道。
上海地区分布着总面积约630 km2的滨海盐渍土,土壤含盐量较高,盐分组成以NaCl为主,1 m土体平均含盐量为0.4%~0.6%,局部表土含盐量高达4.6%[9],在其盐渍土上常见的耐盐人工植被主要有木麻黄(Casuarina equisetifolia)、乌桕(Sapi⁃um sebiferum)等树种[10],观花植物应用较少,白玉兰作为上海市的市花尚未见其应用,因此对其耐盐性进行研究具有重要意义。本文调查NaCl胁迫下苗木受盐害症状,并研究NaCl 胁迫对白玉兰幼苗叶片细胞膜透性,丙二醛、叶绿素、可溶性糖、可溶性蛋白、脯氨酸含量和SOD、POD 活性的影响,为白玉兰在盐化土壤的推广种植提供参考。
1 材料与方法
1.1 材料
供试植物白玉兰由嵊州市秋叶苗木开发有限公司提供,为当年生实生苗,于2019 年4 月购入,定植于V(泥炭土)∶V(珍珠岩)∶V(蛭石)=1∶1∶1的花盆中(花盆上口径6 cm,下口径5 cm,高8 cm),每盆1 株。放置于浙江农林大学园林学院教学实验基地温室内,进行常规管理。
于2019 年6 月挑选生长基本一致的幼苗,转移至浙江农林大学园林学院人工气候室中,环境条件为光照时间14 h·d-1;光下温度28℃,暗中温度25℃;空气相对湿度68%~75%,置于配置1/2 Hoagland 营养液的玻璃培养瓶(上口径6 cm,下口径6 cm,高14 cm)每瓶1 株进行水培,每3 d更换一次1/2 Hoagland营养液。
1.2 方法
1.2.1 试验设计
待幼苗恢复正常生长后,于2019 年7 月开始NaCl 胁迫处理,NaCl 处理液用1/2 Hoagland 营养液配制,设置0(CK)、100(T1)、200(T2)、300(T3)mmol·L-14个NaCl浓度处理;在处理期间以设定的NaCl 浓度每3 d 更换1 次NaCl 处理液;每处理5株,3 次重复。分别于NaCl 胁迫的第1、3、5、7 d 清晨,采集各处理植株从下至上的第3 至第7 位叶片,每5 株混合后用电子天平(精度0.01 g)取5.0 g进行相应生理指标测定。
1.2.2 盐胁迫危害调查
于NaCl 胁迫后第1、3、5、7 d 观察植株的表观症状。盐害症状分为5 个级别。0 级:无症状;1 级:植株叶片出现皱缩;2 级:植株叶片出现变黄焦枯;3级:植株出现落叶;4级:植株枯死。
1.2.3 叶片生理指标测定
用乙醇提取法[11]测定叶绿素含量,用电导仪法[11]测定相对电导率,用硫代巴比妥酸法[11]测定丙二醛含量,用蒽酮比色法[11]测定可溶性糖含量,用考马斯亮蓝G-250 染色法[11]测定可溶性蛋白含量,用磺基水杨酸法[11]测定脯氨酸含量,用氮蓝四唑法[11]测定超氧化物歧化酶活性,用愈创木酚法[11]测定过氧化物酶活性。每个指标均重复测定3次。
1.3 数据处理
用Excel、SPSS19.0 进行数据收集、处理;用单因素方差分析对实验数据进行显著性检验,Dun⁃can新复极差法进行多重比较。
2 结果与分析
2.1 盐害症状分析
由表1 可以看出,随着NaCl 胁迫时间的延长,白玉兰受害症状加重,最高受害等级为2级。

表1 NaCl胁迫下白玉兰受盐害症状等级Table 1 Salt-damaged grade of M. denudata under NaCl stress
在盐胁迫第3 天,T3 处理下植株叶片出现皱缩;在盐胁迫第7 天,T2 处理下植株叶片出现皱缩,T3处理下植株叶片出现变黄焦枯(见图1)。
2.2 NaCl胁迫对叶绿素含量的影响
随着NaCl 胁迫时间的延长,白玉兰的叶绿素和叶绿素a 含量(见图2~3)在T1 和T2 处理下呈先升后降趋势,T3 处理下呈下降的趋势,叶绿素b 含量(见图4)在不同处理下均呈先升后降趋势。在胁迫的各个时期,叶绿素含量、叶绿素a 含量和叶绿素b含量在不同处理下均与对照均无显著差异。胁迫中期(3 d),叶绿素含量和叶绿素a 含量在T1和T2 处理下达到峰值,叶绿素含量分别较对照上升了12.05%和19.21%,叶绿素a 含量分别较对照上升了9.42%和19.00%,叶绿素b 含量在不同处理下均达到峰值,分别较对照上升了17.74%、19.67%和7.48%。胁迫末期(7 d),叶绿素含量、叶绿素a 含量和叶绿素b 含量在不同处理下均与对照接近,且有小于对照的趋势,其中叶绿素含量和叶绿素a 含量在T3 处理下分别较对照下降了7.76%和4.45%。
2.3 NaCl胁迫对相对电导率、丙二醛含量的影响
由图5 可见,随着胁迫时间的延长,白玉兰的相对电导率在不同处理下总体均呈上升趋势。在胁迫的各个时期,不同处理与对照均无显著差异。在胁迫末期T1、T2和T3处理下分别较对照上升了4.08%、10.87%和28.86%。
NaCl 胁迫下,白玉兰的丙二醛含量在不同处理下也均呈上升趋势(见图6)。在胁迫的各个时期,T1 和T2 处理均与对照无显著差异,在胁迫末期,T3 处理较对照有显著的上升。在胁迫末期T1、T2 和T3 处理下分别较对照上升了29.00%、34.11%和51.18%。
2.4 NaCl胁迫对渗透调节物质含量的影响
随着NaCl 胁迫时间的延长,白玉兰的可溶性糖含量和可溶性蛋白含量在不同处理下均呈先升后降趋势,脯氨酸含量呈上升趋势(见图7~9)。胁迫初期(1 d)可溶性糖含量在T1 处理下与对照间存在显著差异,比对照高74.74%,脯氨酸含量在T2 处理下与对照间存在显著差异,比对照高27.22%,可溶性蛋白含量与对照无显著差异。胁迫中期可溶性糖含量在T2 处理下与对照间存在显著差异,比对照高70.18%,可溶性蛋白含量在T1 和T2 处理下与对照间存在显著差异,分别比对照高18.38%和17.48%,脯氨酸含量与对照无显著差异。胁迫后期(5 d)可溶性糖含量在T2 和T3 处理下与对照间存在显著差异,分别比对照高77.84%和33.80%,可溶性蛋白含量和脯氨酸含量与对照无显著差异。胁迫末期脯氨酸含量在T2处理下与对照间存在显著差异,比对照高25.92%,可溶性糖含量和可溶性蛋白含量与对照无显著差异。
2.5 NaCl胁迫对抗氧化酶活性的影响
随着NaCl 胁迫时间的延长,白玉兰的SOD 活性和POD 活性在不同处理下均呈先升后降趋势(见图10~11)。胁迫初期POD 活性在T3处理下与对照间存在显著差异,比对照高7.29%,SOD 活性与对照无显著差异。胁迫中期SOD 活性在T3 处理下与对照间存在显著差异,比对照高9.70%,POD 活性在不同处理下均与对照间存在显著差异,分别比对照高29.72%、14.70%和14.89%。胁迫后期POD 活性在不同处理下均与对照间存在显著差异,分别比对照高66.42%、66.58%和61.30%,SOD 活性与对照无显著差异。胁迫末期POD 活性在不同处理下均与对照间存在显著差异,分别比对照高25.04%、15.12%和19.06%,SOD 活性与对照无显著差异。
2.6 各指标间相关性分析
由表2可知,盐胁迫下白玉兰叶绿素与可溶性糖和SOD 呈显著正相关(P≤0.05);相对电导率与丙二醛呈极显著正相关(P≤0.01);可溶性蛋白与可溶性糖呈极显著正相关。说明在盐胁迫下,相对电导率和丙二醛含量增加,各指标相互作用以应对盐害。
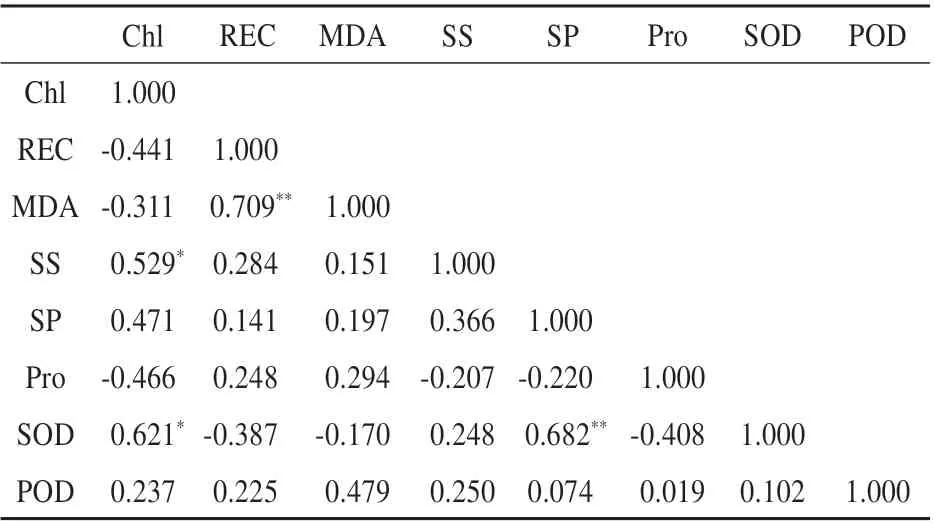
表2 NaCl胁迫下白玉兰幼苗指标间的相关性分析Table 2 The correlation analysis of indexes of M. denu‐data seedlings under NaCl stress
3 讨论
土壤中过量的NaCl 会抑制植物的生长发育[12],盐胁迫下植物生长状况受到的影响可通过盐害等级直观体现[13]。本试验中,在胁迫结束时,T2 和T3 处理下植物受盐害的症状明显,但均能成活,说明高浓度的盐胁迫会抑制白玉兰幼苗的生长。
细胞膜的稳定程度与植物对盐胁迫的耐受性有关[14]。盐胁迫会导致植物体内活性氧升高,膜脂过氧化加剧,造成细胞膜系统的损害[15]。相对电导率是衡量细胞膜透性的重要指标,丙二醛含量的高低可以衡量细胞膜受损伤的程度[16],反映细胞膜质过氧化水平。本实验中,白玉兰叶片的相对电导率和丙二醛含量在不同处理下较对照均有所上升,说明盐胁迫下造成了膜质过氧化伤害,细胞膜受到破坏。这与袁军伟等[17]对赤霞珠葡萄的研究结果一致。
叶绿体是植物光合作用的场所,而叶绿素是体现植物光合特性的重要指标[18]。盐胁迫影响植物叶绿素的合成,叶绿素含量的高低会影响植物的生长[19]。本试验中,白玉兰叶片的叶绿素含量在T1和T2处理下随着胁迫时间的延长先升后降,说明在中低浓度的NaCl 胁迫范围内,胁迫初期会促进白玉兰自身叶绿素的合成,随着胁迫时间的延长,过量的盐进入植物细胞,植株体内叶绿素的合成受到抑制,叶绿素含量有所下降。这与佘汉基等[20]对狗牙花和鹅掌藤的研究结果一致。而叶绿素含量在T3 处理下呈下降趋势,说明高浓度的NaCl处理对白玉兰幼苗叶片中叶绿素的破坏程度较大,在胁迫初期就抑制了叶绿素的合成。
盐胁迫下,植物细胞体内通过可溶性蛋白、可溶性糖、脯氨酸等小分子有机物的合成和积累进行渗透调节。植物体内的可溶性糖不仅作为渗透调节剂发挥作用,还作为合成其他有机溶质的碳骨架和能量来源[12],盐胁迫下可溶性糖含量的积累是植物进行渗透调节以适应盐胁迫的重要策略[21];可溶性蛋白含量的增加可以维持功能蛋白的数量和细胞渗透势[22],而脯氨酸的积累能使植物在盐胁迫中保护大分子物质,清除羟基自由基[23]。本试验中白玉兰叶片的可溶性糖含量和可溶性蛋白含量在不同处理下均随着胁迫时间的延长先升后降,脯氨酸含量有所上升。盐胁迫的初期,植物通过增加体内可溶性糖和可溶性蛋白含量以调节自身的渗透平衡,而随着NaCl 胁迫时间的延长,可溶性糖和可溶性蛋白含量有所下降,说明植物在盐胁迫中受到损伤,生理代谢被破坏。当盐胁迫时间延长时,可溶性糖、可溶性蛋白含量不再增加,而游离脯氨酸含量持续增加,成为主要的渗透调节物质,在保护大分子物质的同时清除羟基自由基,从而保护植物细胞。可溶性蛋白、可溶性糖、脯氨酸的变化均与李硕等[24]对番茄的研究结果一致。
盐胁迫破坏植物体内的氧化还原体系的平衡,诱导出具有破坏能力的活性氧,SOD、POD 等活性氧酶促清除剂能平衡活性氧的毒害[25]。本试验中,白玉兰叶片的SOD 活性和POD 活性在NaCl胁迫下均随着胁迫时间的延长先升后降,在胁迫初期,白玉兰通过SOD、POD 的协同作用以清除NaCl胁迫下产生的活性氧,缓解氧化伤害,而酶活性的耐受度有限,随着胁迫时间的延长,植物细胞膜系统被破坏,导致体内代谢紊乱,SOD 和POD 活性下降,这与高帆等[26]对美味猕猴桃实生苗的研究结果一致。
通过对盐胁迫下白玉兰的受害状况观察及生理指标分析,得知白玉兰具有一定的耐盐性,但其对盐环境的适应能力有一定的范围,在短时间的低盐环境下可以通过增加叶绿素、渗透调节物质和酶活性以保护细胞免受损伤,而在300 mmol·L-1的NaCl胁迫下叶片变黄焦枯,细胞膜受损明显,植物生长受到不可逆的伤害。因此,白玉兰可在轻度盐土地区栽植。

