钛种植体表面新型DNA水凝胶递送地塞米松诱导巨噬细胞M2极化的研究
陈芳浩 何奕德 李哲 闫宁 宋文 张玉梅
巨噬细胞的功能状态对种植体植入后的炎症转归和后期骨结合的形成具有重要的调节作用[1-2],主要是通过向M1/M2不同方向极化实现的,其中M2型巨噬细胞分泌促进组织愈合的细胞因子,有利于新骨形成[3]。地塞米松(Dex)是糖皮质激素类小分子药物,也是公认的巨噬细胞M2极化的强效药物[4]。
DNA水凝胶是近些年来研究较为热门的凝胶材料,其三维网络结构可容纳大量的水和药物分子,是良好的药物缓释载体[5]。然而前期报道的DNA凝胶是利用双链DNA骨架中的带负电荷的磷酸基团,与带正电荷的纳米硅片之间的静电作用交联形成DNA物理水凝胶[6]。然而纳米硅片来源有限,在体内蓄积可能产生毒性。壳聚糖(CS)是天然的阳离子高分子材料,体内可降解,生物相容性良好。本研究推测,采用壳聚糖替换纳米硅酸盐作为交联剂也可与DNA形成凝胶,且具备更为优良的应用前景。
本研究旨在合成一种新型的、良好生物相容性的DNA-CS水凝胶,加载于钛纳米管表面及管腔中以递送Dex,通过免疫荧光染色和RT-qPCR检测M1、M2型巨噬细胞标志物CD86、CD163[7]在蛋白和基因水平的表达情况,探索其对巨噬细胞极化方向的影响。
1 材料与方法
1.1 主要材料与试剂
纯钛试件(10 mm × 10 mm × 1 mm,宝鸡弘森钛制品有限责任公司); 400~7000目碳化硅砂纸(勇士,德国); 40%氢氟酸、85%磷酸、丙酮、无水乙醇、冰乙酸(天津市富宇精细化工有限公司);壳聚糖(相对分子质量100~300 kDa,ACROS,北京伊诺凯科技有限公司);地塞米松(北京索莱宝科技有限公司);高糖DMEM培养基、胎牛血清(HyClone,美国);CCK-8试剂盒、Triton X-100、Hoechst 33342(上海碧云天生物技术有限公司);小鼠巨噬细胞系RAW264.7细胞(ATCC,美国);大鼠抗小鼠CD86抗体、Alexa Flour标记驴抗大鼠二抗(Abcam, 英国);兔抗小鼠CD163抗体、ATTO标记羊抗兔二抗、絮状鲑鱼精双链DNA(Sigma, 美国); TRIzol RNA 提取试剂(Invitrogen,美国);Prime ScriptTMRT Master Mix、SYBR®Premix Ex TaqTMII(Takara,日本)。
1.2 主要仪器
阳极氧化电源(香港龙威);全波长酶标仪(BioTek,美国);双级旋片式真空泵(北京飞越); S-4800场发射扫描电镜(Hitachi,日本);ATR FT-IR(Shimadzu,日本);激光共聚焦显微镜(尼康A1 plus,日本);CFX96实时荧光定量PCR仪(Bio-Rad,美国)。
1.3 DNA-CS水凝胶的制备及表征
将鲑鱼精双链DNA溶解于去离子水中,37 ℃恒温过夜,形成2%DNA水溶液。90℃水浴加热45 s,37 ℃恒温保持2 h,形成DNA预凝胶。将等体积的0.5% CS溶液加入DNA预凝胶中,混匀10 s,37℃恒温过夜,形成DNA-CS水凝胶。采用扫描电镜、红外光谱进行表征检查。
1.4 钛纳米管表面DNA-CS凝胶加载及Dex释放
凝胶制备中加入CS溶液的同时加入Dex,使其在终凝胶中的浓度为1 mg/mL,形成负载Dex的水凝胶。取200 μL混匀的水凝胶滴加于钛纳米管[8]表面(NT+Dex@Gel),在真空箱中抽真空3 min,37 ℃恒温过夜。使用浓度为1 mg/mL的Dex溶液,等体积滴加于钛纳米管表面,作为对照组(NT+Dex)。SEM观察表面及纵剖面形貌。将负载Dex的钛片(NT+Dex、NT+Dex@Gel)置于24 孔板中,每孔加入1 mL PBS,置于37 ℃恒温摇床上,每隔一定时间取出100 μL,再补充等体积的新鲜PBS,在240 nm处测其吸光度值进行定量。
1.5 CCK-8检测
选择小鼠巨噬细胞系RAW264.7细胞作为实验细胞,将试样分成3 组:NT、NT+Gel、NT+Dex@Gel组,分别置于24 孔板底,每组设4 个复孔。将RAW264.7按照3×104细胞/孔接种至钛试样表面。培养至1、3、5 d时换用含10% FBS、10% CCK-8的无酚红高糖DMEM培养基,在37 ℃恒温培养箱内孵育1 h,吸取上清用酶标仪测定在450 nm处的吸光度。
1.6 免疫荧光染色
试样表面细胞培养5 d后,4%多聚甲醛室温固定30 min,0.2% Triton X-100透化10 min,1%胎牛血清室温封闭30 min;使用一抗(大鼠抗小鼠CD86抗体、兔抗小鼠CD163抗体,稀释比均为1 ∶500)4 ℃孵育过夜,之后用荧光二抗(Alexa Flour标记驴抗大鼠二抗、ATTO标记羊抗兔二抗,稀释比分别为1 ∶300、1 ∶200)室温孵育2 h, Hoechst复染细胞核,PBS漂洗后封片,置于激光共聚焦显微镜下观察。
1.7 RT-qPCR检测
试样表面细胞培养5 d后,Trizol法提取总RNA,按照 cDNA 反转录试剂盒(Prime ScriptTMRT Master Mix)的反转录体系进行反转录。使用SYBR®PremixExTaqTMII和CFX96型实时荧光定量PCR仪扩增cDNA并检测M1、M2极化标志物CD86、CD163的mRNA表达水平。管家基因选取GAPDH。相关基因的引物序列见表1。
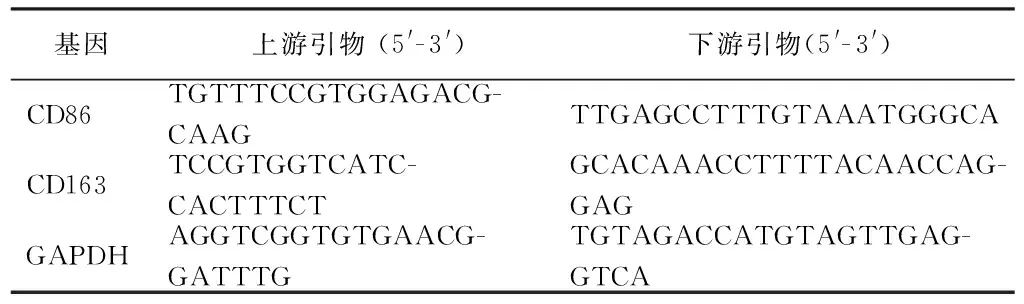
表1 引物序列
1.8 统计分析
2 结 果
2.1 DNA水凝胶的表征

2.2 钛种植体表面DNA水凝胶涂层的构建
加载凝胶后可见纳米管口覆盖有凝胶薄层,部分遮挡了原有的纳米阵列形貌(图2A),侧面观察管口处管壁表面覆盖有凝胶,其外形由锐利变得圆钝,管壁增厚,管腔中沉积有从管口延伸至管底的凝胶(图2B)。
将Dex标准品的浓度与其在240 nm处的吸光度值进行线性拟合,并绘制Dex的校准曲线(图3A)。NT+Dex、NT+Dex@Gel组的体外释放曲线如图3B示,每个时间点凝胶涂层组Dex的释放速度减慢,延长了半数释放量的天数。
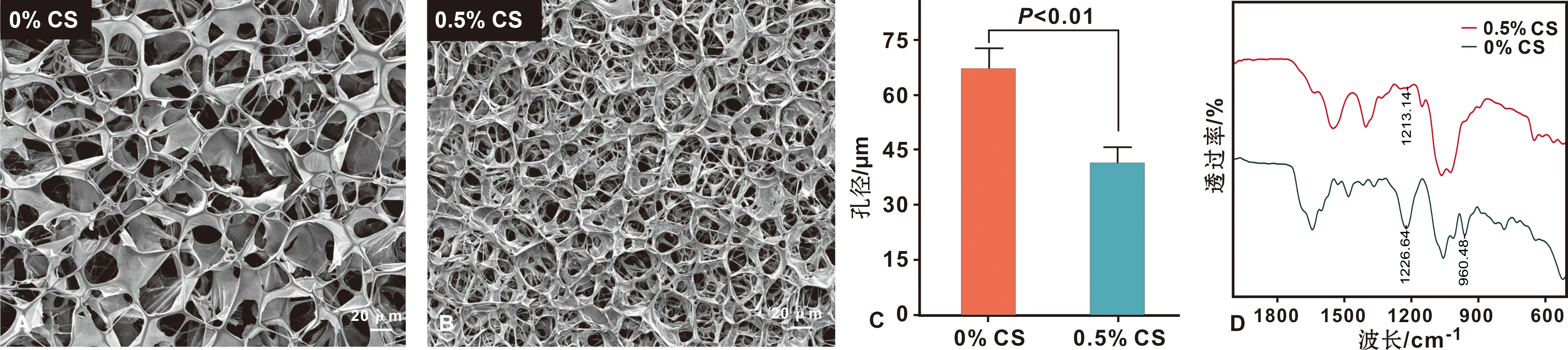
图1 扫描电镜下DNA预凝胶(A)、终凝胶(B)的表面形貌,孔径统计(C)和红外光谱图(D)

图2 扫描电镜下钛纳米管管口(A)及纵剖面形貌(B)
2.3 修饰后钛种植体表面细胞相容性检测
细胞活性测试CCK-8结果如图4示。随着培养时间的延长,各组细胞增殖呈上升趋势,含凝胶组未见抑制细胞增殖作用。第1、5 天时,NT+Dex@Gel组的细胞活性显著强于NT组。
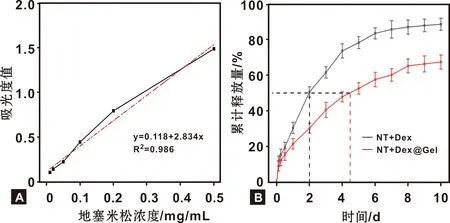
图3 Dex标准曲线(A)、体外释放曲线(B)
2.4 修饰后钛种植体表面对巨噬细胞极化方向的影响
细胞培养5 d后,通过免疫荧光染色将CD86(M1)、CD163(M2)和细胞核进行染色,激光共聚焦显微镜观察(图5A),与NT、NT+Gel组相比,NT+Dex@Gel组细胞的CD86荧光强度非常弱、CD163的荧光强度非常强。对免疫荧光染色结果进行半定量分析(图5B),显示NT+Dex@Gel组细胞的CD86平均荧光强度显著降低,CD163平均荧光强度显著升高。

图4 RAW264.7细胞增殖(CCK-8实验)
细胞培养5 d后,RT-qPCR检测M1、M2巨噬细胞标志物CD86、CD163的mRNA表达水平(图6)。与NT、NT+Gel组相比,NT+Dex@Gel组中CD86的mRNA表达水平显著降低,而CD163的mRNA表达水平显著升高,与免疫荧光染色结果的变化趋势一致。
3 讨 论
DNA水凝胶是一种以DNA为骨架分子形成的三维亲水性网络,按其交联方式可分为物理水凝胶和化学水凝胶。物理交联是由分子间的非共价相互作用产生的,包括互补DNA之间的氢键作用、金属与DNA的配位作用,以及DNA与阳离子(聚)电解质之间的静电作用等。例如Xing等[9]证实可以完全通过碱基配对构建纯净的DNA水凝胶。与化学交联相比,物理交联制备过程相对简单,结合力较弱,避免了毒性交联剂的使用,因此具有良好的生物相容性和生物降解性。本研究中我们首先拟探明壳聚糖分子能否替代纳米硅酸盐与DNA交联形成凝胶,其依据在于壳聚糖分子带有大量正电,与带负电的DNA分子可发生静电结合,事实上已有大量的研究将壳聚糖作为基因转染载体转运质粒DNA分子,主要包括基于壳聚糖的纳米粒[10]以及壳聚糖凝胶[11]等。通过特定分子量范围的壳聚糖以及浓度、混合方式等参数的筛选优化,成功制备出质地均一、粘度可控和具有可注射性的DNA水凝胶。
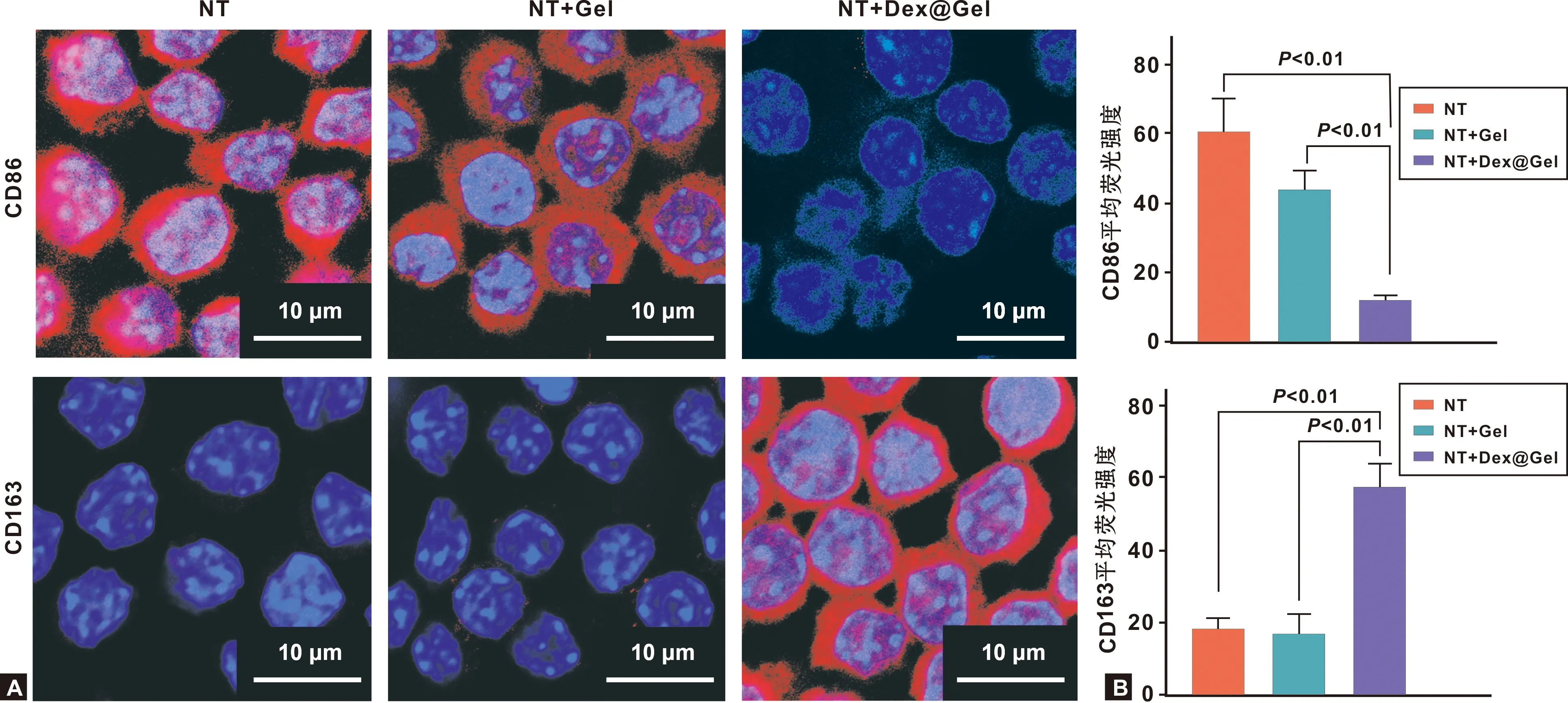
图5 M1、M2巨噬细胞标志物CD86、CD163的免疫荧光染色(A)和半定量分析(B)
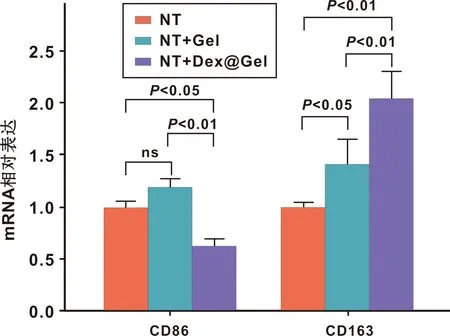
图6 RAW264.7细胞中的CD86、CD163的mRNA表达水平
植入材料表面加载水凝胶是实现材料表面特定生物活性的重要途径,通过水凝胶中药物的高效负载,可直接实现特定的生物功能。例如De Giglio等[12]在钛种植体表面制备了聚丙烯酸酯基水凝胶加载环丙沙星的复合涂层,利用抗生素直接实现抗菌特性。然而单纯的物理吸附加载量有限,与基底的结合较弱。本研究中首先在钛基底表面构建了纳米管结构[8],利用真空抽吸[13]的方法将凝胶注入到纳米管的管腔中,SEM观察可见管腔内被凝胶充满。该方法充分发挥了纳米管腔的高容积作用,显著提高了凝胶的加载量,从而提高了地塞米松的浓度,并实现了一定缓释的特点。
本研究中制备的凝胶修饰钛种植体表面在常用的巨噬细胞系RAW264.7中未产生细胞毒性,且负载Dex后具有一定的促进增殖作用。这表明Dex可能对巨噬细胞具有一定的促增殖作用[14]。巨噬细胞在种植体植入早期通过分泌趋化因子和细胞因子,在组织修复与改建中发挥重要作用,M2向分化程度影响着炎症转归及组织再生修复的进展,且其极化方向具有可塑性。本研究将地塞米松包裹在DNA水凝胶中,可显著诱导RAW264.7细胞向M2方向极化。与NT组相比,NT+Gel组的CD163在基因水平表达升高,但蛋白水平表达差异不明显,这可能是因为检测的时间点不够全面,延长培养时间或许基因和蛋白的变化规律会趋于一致。也可能是在转录后的翻译水平存在其他调控机制,使得最终在蛋白水平没有表达升高,这需要更深入的研究。可以推测,这种M2方向极化的作用在体内可以减轻材料表面的炎症反应,促进组织的快速修复。另一方面,Dex还具有强效的促进成骨细胞分化的能力[15],是体外成骨诱导的重要因子之一,Dex的局部应用可能对细胞向成骨方向分化也具有积极意义。
综上所述,利用DNA与壳聚糖之间的静电作用形成水凝胶,加载于钛纳米管的管腔中,提高了地塞米松的载药量及缓释效果,具有良好的生物相容性,促进巨噬细胞M2极化,从而为实现早期骨结合创造了有利条件。

