有机酸溶剂体系中壳聚糖膜性能的研究进展
钟燕琴,杨明亮,吕静祎,2,葛永红,2,米红波,2,陈敬鑫,2
有机酸溶剂体系中壳聚糖膜性能的研究进展
钟燕琴1,杨明亮1,吕静祎1,2,葛永红1,2,米红波1,2,陈敬鑫1,2
(1.渤海大学 食品科学与工程学院,辽宁 锦州 121013;2.生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
有机酸溶剂体系对壳聚糖的成膜性能至关重要,探讨其潜在的分子机制,可为壳聚糖膜的相关研究提供理论参考。综述壳聚糖的化学组成和成膜机制,以及壳聚糖在不同有机酸溶剂体系中成膜的力学性能、溶胀性、氧气透过率、水蒸气透过率等特性。有机酸溶剂体系可为壳聚糖的溶解提供更多的质子,从而促进壳聚糖分子在水中的溶解。此外,有机酸分子结构中羧酸和羟基数量、碳链长度不同,其与壳聚糖分子间形成的氢键和离子作用力不同,进而可在很大程度上影响壳聚糖的成膜性能。有机酸溶剂体系对壳聚糖膜的性能具有较为显著的影响,这有助于提高其作为可食用膜在改善食品品质和保鲜方面的适用性。
壳聚糖;有机酸;膜性能
2015—2018年全球塑料需求量年均增长率为3.9%[1],预计到2050年塑料将占总石油消耗量的20%[1-3]。包装特别是食品包装,是塑料的主要应用领域之一[4]。石油基聚合物具有较为优良的特性,然而其应用的主要障碍来自它们对环境会造成严重危害,并对人类健康产生不利影响[5]。随着塑料聚合物薄膜所带来的环境问题日益凸显,可食用和生物可降解食品包装薄膜的开发和应用受到了人们的关注[6-7]。壳聚糖具有无毒、生物降解性、稳定性、商业可获得性、抗氧化和抗菌性能等特征,是一种极具潜力的包装生物聚合物[8-14]。壳聚糖薄膜已被用作多种食品的包装及贮藏保鲜,以提高食品的安全性和货架期[15-18]。
壳聚糖(2-氨基-2-脱氧-D-吡喃葡萄糖)的化学式为(C6H11O4N),是甲壳素的衍生物,由甲壳素在碱性介质中脱乙酰得到[19]。甲壳素是自然界中仅次于纤维素的第2丰富的天然多糖,主要存在于虾、蟹、昆虫等节肢动物的外骨骼中,其结构有序、层次分明的纤维结构中有结晶的纳米纤维,可起到遮蔽作用[20-22]。甲壳素由β-(1-4)连接的2-乙酰氨基-2-脱氧- D-吡喃葡萄糖残基的均聚物组成[21]。甲壳素在结构上与纤维素链相似,但其主链中可用的氨基在结构修饰方面比纤维素具有更高的潜力[23]。壳聚糖和甲壳素都是氨基葡萄糖与N-乙酰氨基葡萄糖单体的无规则共聚物[23-25],区别在于主干上乙酰基的数目不同[26]。由于葡萄糖胺单体在pH小于6.0下C2带正电荷,壳聚糖比甲壳素具有更好的溶解性和抗菌活性。壳聚糖具有抗菌特性的原因之一是其带正电荷的氨基与带负电荷的微生物细胞膜相互作用,导致微生物的蛋白质和其他胞内成分的泄漏[22]。目前,壳聚糖被认为是一种适合制造生物降解塑料的生物材料[27]。然而,壳聚糖生物膜的主要缺点是在潮湿环境和稀酸性溶液中的溶解度高、吸湿能力强、力学性能较弱等[22,26]。
壳聚糖分子间和分子内的氢键和半晶体结构使其难以溶于水和大多数有机溶剂[28]。一般来说,壳聚糖可溶于pH<6.0的稀酸性溶液中,其溶解度取决于酸性介质中聚合物链上氨基的质子化,该质子化可导致其分子内部的氢键网络被正电荷间的静电斥力破坏[24]。壳聚糖材料具有水合增黏的特性,可以作为可食用、可降解的薄膜或涂料,但壳聚糖膜的高透湿性和力学性缺陷限制了其应用。改变pH值或溶剂可以对壳聚糖膜进行改性,提高膜的阻隔性和力学性能[29]。
有机酸溶剂与壳聚糖分子间的静电作用、氢键或疏水作用均会影响壳聚糖膜的结构和性能,其中主要影响因素为静电相互作用[30-34],因此,有机酸溶剂体系可在很大程度上影响壳聚糖的成膜性能,这些信息对于阐明壳聚糖膜的结构和性能的关系至关重要[35],故文中综述有机酸溶剂体系对壳聚糖成膜性能的影响及其潜在的分子机制。
1 壳聚糖的化学组成及成膜机制
1.1 壳聚糖的化学组成
壳聚糖是由甲壳素经脱乙酰化程度达到50%左右而得到[36-41](图1)。壳聚糖的分子结构是线性的,由氨基葡萄糖和N-乙酰氨基葡萄糖通过β-(1-4)糖苷键连接[35-39],其中氨基葡萄糖单元的数量超过60%[36]。通常,壳聚糖可溶解于pH<6的酸性溶液,使其多糖链上的氨基带正电荷,成为阳离子聚合物[40]。
1.2 壳聚糖的溶解性
壳聚糖为弱碱,不溶于纯水和有机溶剂[13,42],但可溶于pH<6的稀酸性水溶液[43]。壳聚糖溶解发生在D-氨基葡萄糖重复单元C-2位置上的—NH2功能质子化,并在酸性介质中转化为聚电解质。壳聚糖之所以溶于pH<6的稀酸性溶液,这是因为壳聚糖具有pKa值为6.3的初级氨基,可以被认为是一种弱碱。氨基的存在意味着pH值可极大地改变壳聚糖的荷电状态和性质[44]。当pH值很低时,氨基会发生质子化并带正电荷,这使得壳聚糖成为一种水溶性阳离子聚电解质;当pH值高于6时,壳聚糖的氨发生脱质子化,聚合物失去电荷,使壳聚糖变得不溶。pKa值在pH值为6.0~6.5时发生可溶—不可溶转变[24]。在稀酸性有机酸溶液中,壳聚糖的氨基被质子化,形成壳聚糖-氨配合物[45](图2)。含电荷基团的数量越多,其溶解度越大[46]。
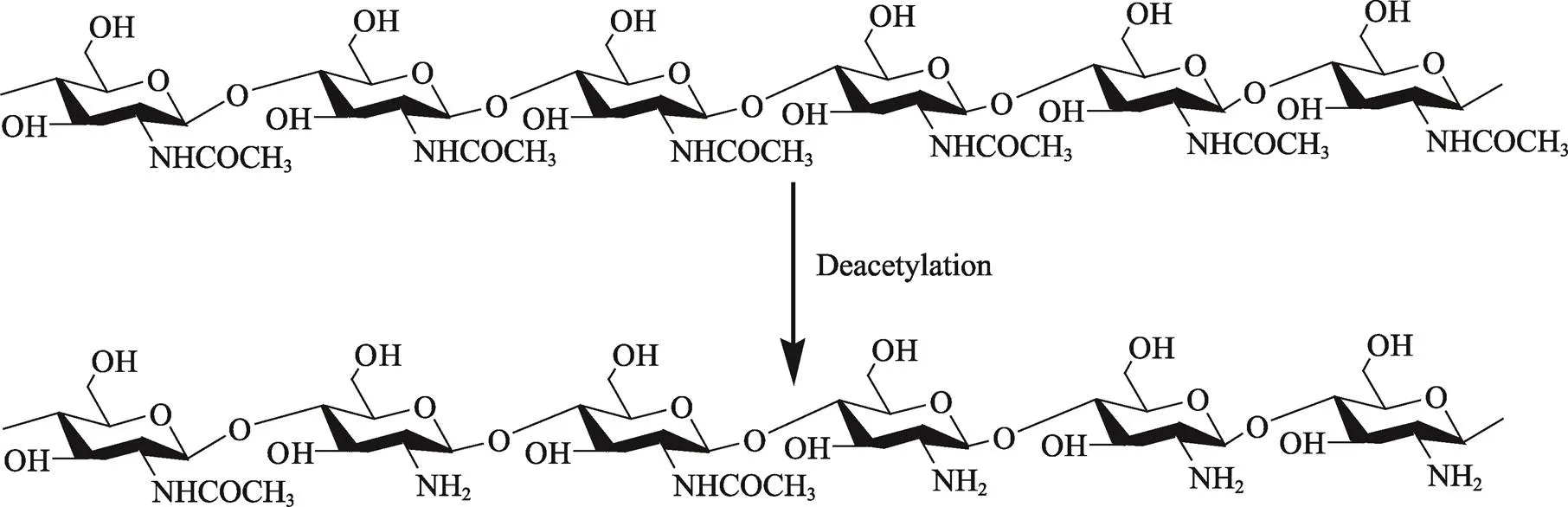
图1 甲壳素经脱乙酰化制得壳聚糖
1.3 壳聚糖与有机酸的成膜机制
多糖膜主要是由于聚合物链发生断裂和重组而形成,其重组过程主要是通过溶剂的蒸发而使得聚合物链间形成亲水键合、氢键、电解质交联或离子交联等一系列相互作用来实现[47]。
壳聚糖溶解于酸性溶液得到壳聚糖溶液,将其浇铸在聚苯乙烯板等表面上,溶剂蒸发后,容易得到一层可从聚乙烯板上分离的膜[48]。薄膜的形成归因于在干燥过程中形成的链缠结和分子间的相互作用,如静电和氢键(在干燥过程中,壳聚糖浓度的增加诱导了氢键的形成),这些在多糖的结构中起着重要的作用[49]。高分子量的壳聚糖由于分子内和分子间的氢键更多而具有良好的成膜性能[50-51](图3)。壳聚糖可以通过外部交联剂形成水凝胶或膜,也可以进行自交联。壳聚糖的自交联结构 是由于分子间和分子内氢键或疏水的相互作用而形成[52]。
2 有机酸溶剂对壳聚糖膜性能的影响
2.1 有机酸溶剂对壳聚糖膜厚度的影响
在膜制备过程中,由于溶剂蒸发过程中聚合物密度和蒸汽界面发生变化,产生聚合物密度梯度。这个梯度作为一个屏障,阻止酸溶剂的进一步蒸发,因此,不同有机酸溶剂体系制备的壳聚糖膜的厚度有所差异[53]。Cadogan等[45]利用醋酸、抗坏血酸、柠檬酸、乙醇酸、马来酸、草酸、酒石酸作为溶剂溶解壳聚糖以成膜。如表1所示,与其他有机酸相比,柠檬酸作为溶剂制备所得到的壳聚糖膜厚度最大,这可能是由溶剂蒸发过程中聚合物密度梯度较低造成。Pavoni等[54]用乳酸制备的淀粉/壳聚糖共混膜比用醋酸制备的淀粉/壳聚糖共混膜厚度更高,这可能是由于乳酸的增塑作用[47]。此外,乳酸结构中额外羟基的存在可导致聚合物链分子间空隙的增加,产生更大的材料柔韧性[53]。酸的解离常数(pKa)值低,越能促进壳聚糖分子的解离[55]。与醋酸(pKa=4.75)相比,乳酸的解离常数(pKa=3.85)低,更有利于壳聚糖分子的解离,导致溶液中—NH3+基团数量增加,聚合物链间的斥力增加,从而产生更大体积的空隙,而这些空隙可以被酸性溶液填充[56]。
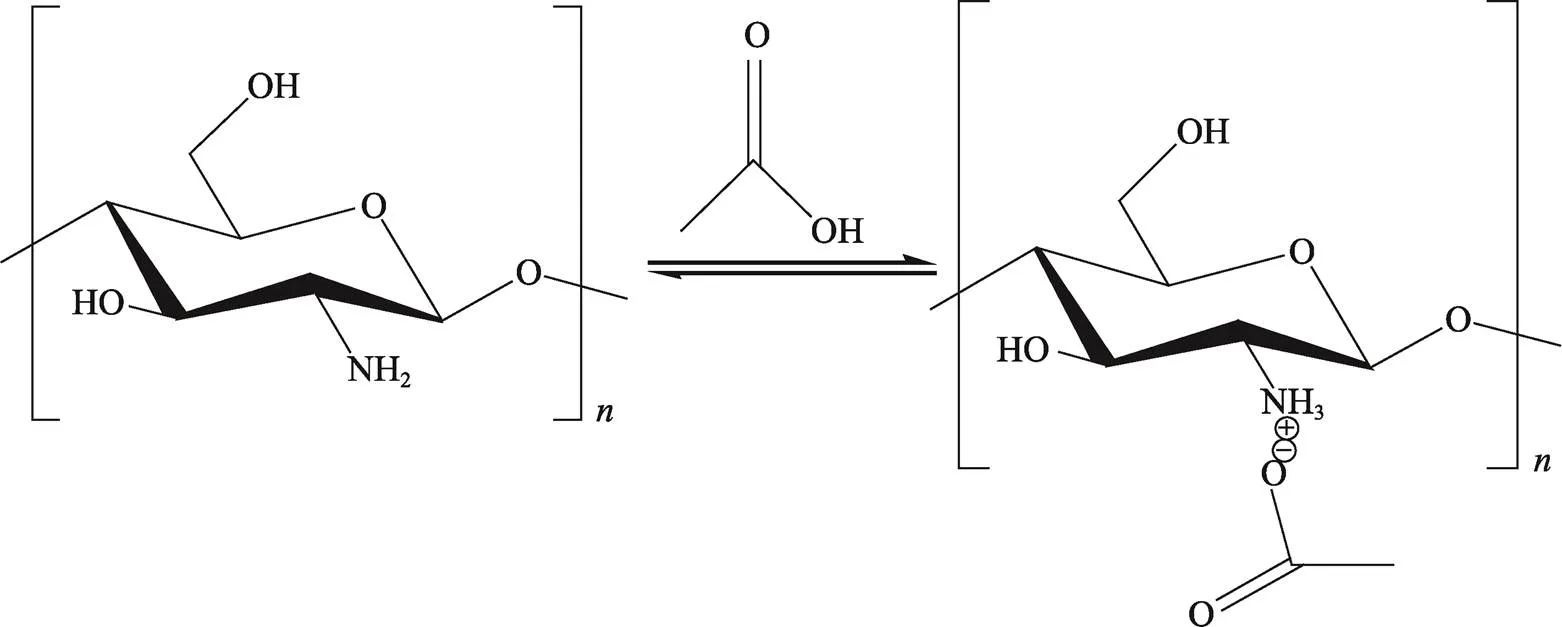
图2 以醋酸溶解壳聚糖为例
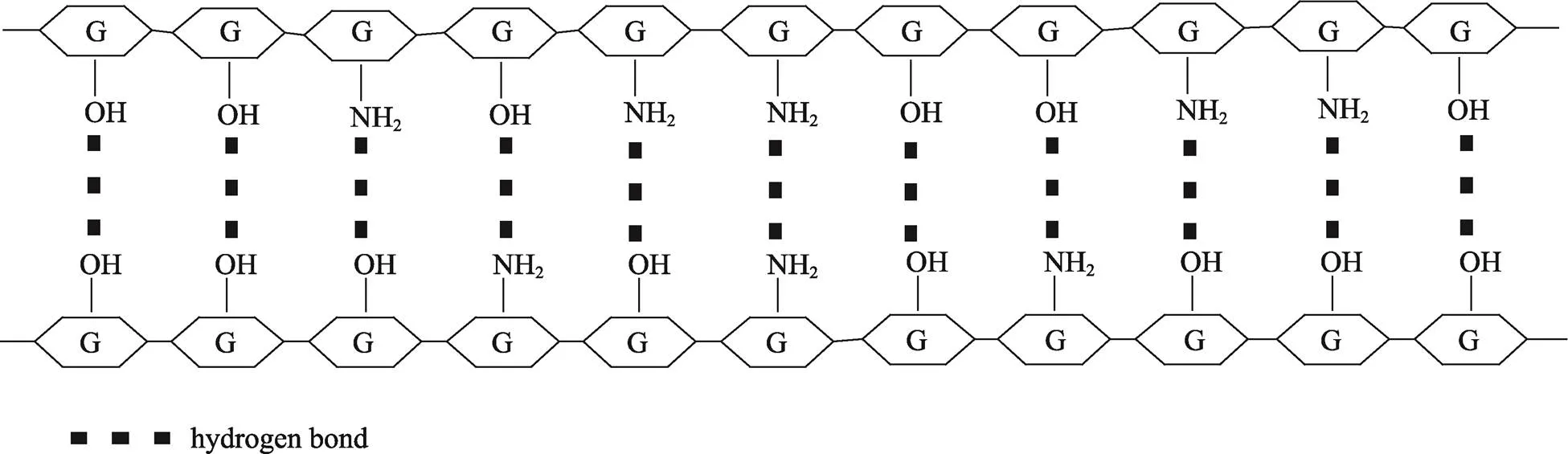
图3 壳聚糖膜形成过程中的氢键形成
表1 溶剂体系对壳聚糖膜力学性能的影响

Tab.1 Effect of solvent systems on the mechanical properties of chitosan films
2.2 有机酸溶剂对壳聚糖膜力学性能的影响
在运输、搬运和储存过程中,通常需要高力学性能来保持包装的完整性。理想的包装材料应具有足够的机械强度和柔韧性[57]。基于不同有机酸溶剂条件下,壳聚糖膜的力学性能可通过离子相互作用的有效性以及聚合物相邻链间的氢键形成来阐明[45]。
2.2.1 有机酸溶剂对壳聚糖膜抗拉强度的影响
醋酸溶解壳聚糖制备的膜中存在很强的分子内和分子间氢键,从而增强膜的抗拉强度。Vimaladevi等[58]发现醋酸溶解壳聚糖形成的膜比丙酸溶解壳聚糖形成的膜抗拉强度大。Park等[59]提出在醋酸溶液中壳聚糖分子形成二聚体,从而增强分子间的相互作用,因此在醋酸溶液中所制备壳聚糖膜的拉伸强度最高,这些结果与Park[60-61]、Chen[62]等的观察结果一致。Pavoni等[63]也发现醋酸溶解壳聚糖形成的膜具有较高的拉伸强度和弹性模量,但其断裂伸长率较低,这种行为可能归因于壳聚糖结构的组织和链缠结的程度,而链缠结的程度取决于壳聚糖的溶解度以及分子间相互作用。这也表明,在一定程度上,薄膜的断裂伸长率随着薄膜拉伸强度的增加而降低[64]。
共轭碱的稳定性和氧化反应影响壳聚糖膜的抗拉强度。Cadogan等[45]发现使用柠檬酸、草酸和马来酸制备的壳聚糖膜表现出较高的抗拉强度,可能是由于共轭碱的稳定性和羧基的氧化造成的(表1)。如果共轭碱的稳定性好,就会促进羰基之间的相互作用,与壳聚糖上的氨基发生反应,这个过程被称为还原胺化[65]。例如,酒石酸和抗坏血酸等有机酸进行还原胺化的可能性更大,则其制备所得壳聚糖膜表现出更高的抗拉强度。抗坏血酸是一种易氧化的有机酸,它既可提供溶解壳聚糖所需的质子,还具有交联壳聚糖以提高其膜抗拉强度的潜力[45]。Hwang等[38]研究了乙醇酸、苹果酸和抗坏血酸对壳聚糖膜力学性能的影响,提出抗坏血酸的氧化是膜力学性能得以提高的主要原因。氧化反应后,抗坏血酸分子上出现3个羰基[66]。这些羰基可能与分离的壳聚糖链上氨基发生反应(还原胺化反应),以交联壳聚糖膜的分子结构,从而提高壳聚糖膜的机械强度。经抗坏血酸制备的壳聚糖膜比苹果酸和乙醇酸所得膜的机械强度更高,这是因为该膜中存在更多的离子相互作用或氢键使膜形成更大的分子结构。三聚磷酸盐对壳聚糖的交联作用也是基于此原理[67-68]。
2.2.2 有机酸溶剂对壳聚糖膜断裂伸长率的影响
有机酸溶剂溶解壳聚糖能力、有机酸结构中羟基的存在、碳链的长度与壳聚糖形成的氢键和离子作用力不同,进而导致壳聚糖膜的断裂伸长率不同。
有机酸溶解壳聚糖能力不同,在参与壳聚糖分子间氢键时所能用的氢原子不同,所以膜的断裂伸长率不同。Cadogan等[45]研究表明,使用柠檬酸作为溶剂所制备的壳聚糖膜表现出最大的断裂伸长率为56%,而醋酸、草酸表现出较小的断裂伸长率分别为20%和19%。这是因为柠檬酸的氢键形成能力最强,而由于醋酸和草酸在参与壳聚糖分子间氢键时所能用的氢原子最少,因此不会显著增加膜的弹性。Park等[59,61]也发现柠檬酸作为溶剂制得壳聚糖膜具有较高的断裂伸长率,这可能是由于壳聚糖在柠檬酸溶液中具有较高的溶解度。
乳酸具有一定的增塑作用[47],其所含羟基可与壳聚糖的羟基形成氢键,而氢键被认为更容易移动的键合类型[69],因此乳酸可有效提高壳聚糖膜的断裂伸长率。Caner等[70]发现(表1),7.5%乳酸制备的壳聚糖膜的断裂伸长率为51.31%,而其他有机酸制备膜的平均伸长率仅为24.57%~32.19%。Cruz等[71]认为乳酸结构中羟基的存在所导致聚合物链间分子间隙的增加,也是产生更大材料柔韧性的原因之一。Pavoni等[63]用乳酸制备的壳聚糖膜的弹性模量为0.81 MPa,断裂伸长率为220%,这说明乳酸表现出一定的增塑剂作用。Chen等[41]使用同时含有羧基和羟基的有机酸溶剂制备的多孔壳聚糖膜具有更大的断裂伸长率。醋酸制备所得膜的断裂伸长率为115%,而乙醇酸制备所得膜的断裂伸长率可达170%,这也可能是由于羟基的存在使得壳聚糖与羟基之间形成的更多氢键。由于氢键是一种容易移动的键合类型,因此乙醇酸所得壳聚糖膜的分子排列比醋酸更具有可动性,表现出更高的断裂伸长率。同样,苹果酸与琥珀酸所制备壳聚糖膜的比较研究中也出现类似效果,苹果酸较琥珀酸增加了一个羟基,苹果酸制备所得壳聚糖膜的伸长率为182%,而琥珀酸制备所得壳聚糖膜的断裂伸长率为120%。
壳聚糖膜的断裂伸长率随二元羧酸碳原子数的增加而增加。—COOH基团和壳聚糖的—NH2基团之间的质子交换产生的氢键和离子相互作用为壳聚糖膜提供了物理交联[72-73],二元羧酸上含有2个羧基,可以与壳聚糖链上的氨基相互作用,使壳聚糖分子发生离子交联[74](见图4),二元羧酸碳链越长,离子交联效果越好,断裂伸长率显著提高。同时,碳链越长也意味着可形成更灵活的网络。例如,辛二酸(=6)所制备的壳聚糖膜的断裂伸长率高于丁二酸(=2)[57]。这与Chen[41]结论一致,随着二元羧酸碳原子数的增加,其壳聚糖膜的交联结构也变得更大,而较大的结构有助于提高膜的抗拉强度 和拉伸性能。值得注意的是,虽然氢键和离子相 互作用可提高壳聚糖的力学性能,但过多的交联度则会限制分子的运动和柔韧性,进而降低膜的力学性能[75]。
2.3 有机酸溶剂对壳聚糖膜溶胀性的影响
有机酸的碳原子数越少,其所含羧基和羟基与水分子发生相互作用概率增加,所制备壳聚糖膜的溶胀度更大。由于壳聚糖具有高度的亲水性,其膜的溶胀率通常大于1000%。Cadogan等[45]研究表明,不同有机酸溶剂体系所制备壳聚糖膜的溶胀作用强弱依次:乙醇酸>抗坏血酸>柠檬酸>酒石酸>草酸。其中,具有最低碳原子数的乙醇酸表现出最大的溶胀性,其原因是乙醇酸具有高亲水性和强氢键形成能力。此外,溶胀率随着羧基数目的增加而增加。由于壳聚糖中氨基与水的羟基之间的强氢键作用,羧基数目对壳聚糖膜的溶胀率影响相对较小。
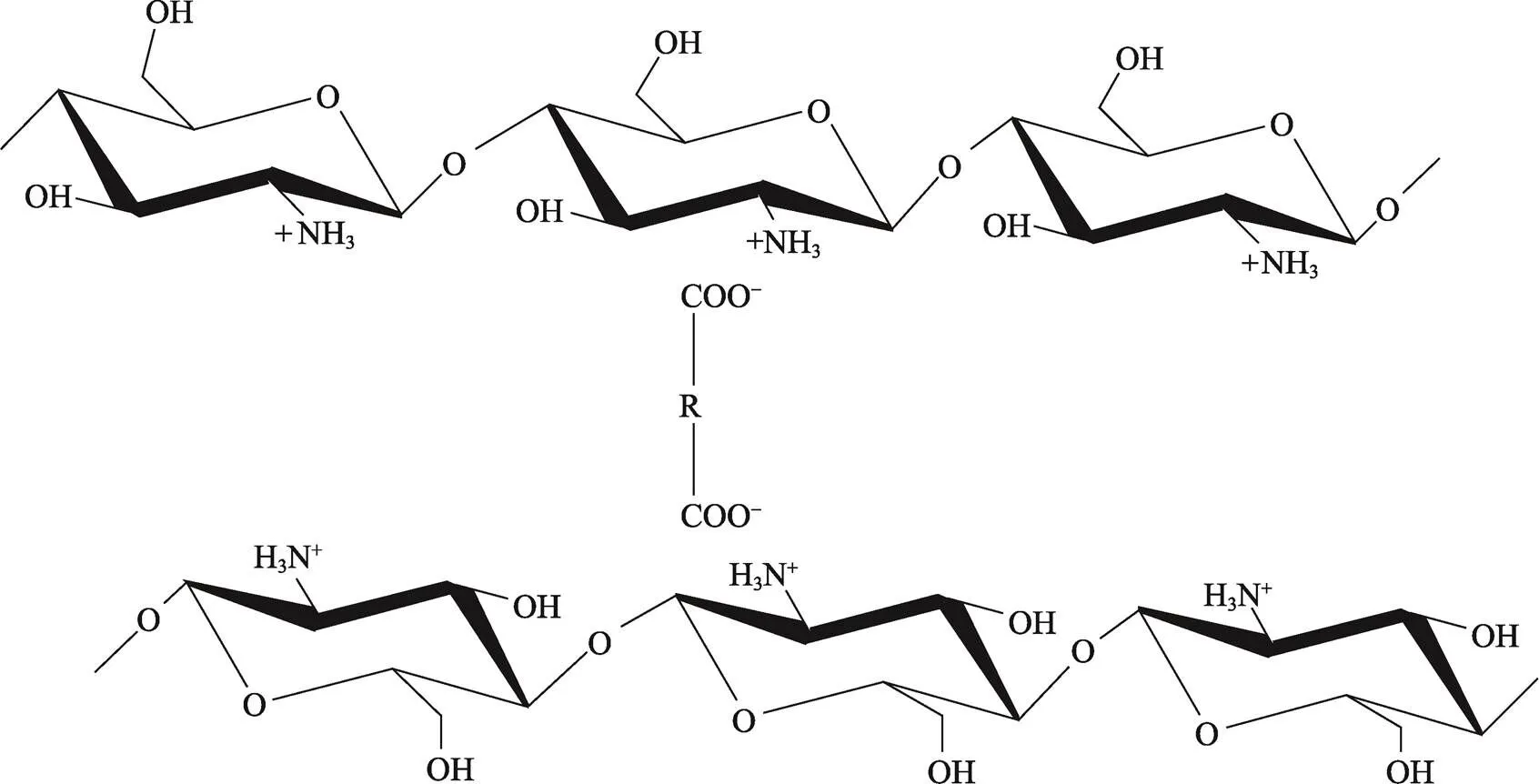
图4 壳聚糖与二元羧酸的离子交联
新制备的壳聚糖膜易在去离子水和盐酸缓冲溶液中溶胀、软化、直至溶解[76]。有机酸溶剂体系制备所得壳聚糖膜的吸水率和溶解率大小依次为:柠檬酸>苹果酸>乙醇酸>乳酸≈甲酸>醋酸>丙酸。丙酸制得壳聚糖膜的溶解时间略长于其他膜。除柠檬酸制备所得壳聚糖膜外,其余壳聚糖膜在磷酸盐缓冲溶液中均可保持完整。经过湿热处理(温度为60 ℃和相对湿度为75%)后,3种介质中多数有机酸制备所得壳聚糖膜的吸水率和溶解率随着处理时间的延长明显降低。其衰减量依次为:磷酸缓冲液>去离子水>盐酸缓冲液。经过48 h处理后,柠檬酸和苹果酸所制备壳聚糖膜在去离子水和盐酸缓冲液中能完全溶解,而醋酸和丙酸所制备壳聚糖膜的溶解性 较弱。
膜吸水包含2个过程:即膜材料的吸水作用和膜孔隙对水分子的滞留作用。对于孔隙率相近的膜,其孔隙对水分子的滞留作用强弱相差不大,因此吸水能力的强弱主要取决于膜材料本身对水的吸附作用。研究表明,与醋酸相比,乙醇酸、草酸、琥珀酸、苹果酸、己二酸等其他有机酸制备壳聚糖膜具有较强的吸水能力[41]。醋酸制备所得壳聚糖膜的吸水性为1500%,而其他有机酸所制备的多孔壳聚糖膜的吸水性可达1800%~2000%。对于一元酸来说,乙醇酸比醋酸多一个羟基,该羟基增强了乙醇酸所制备壳聚糖膜结合水分子的能力,导致壳聚糖膜吸收更多的水分。与一元羧酸不同,二元羧酸制备的壳聚糖膜可通过离子交联作用形成较大空间结构,即一个有机酸分子的2个羧基与壳聚糖的氨基相互作用而产生更大的空间结构,进而提高其膜的吸水性。此外,羧基本身有亲水性,可增强壳聚糖膜的结合水的能力,因此,可用通过二元羧酸代替一元羧酸来提高壳聚糖多孔膜的吸水性(表2)[38]。
表2 溶剂体系对壳聚糖膜溶胀性的影响
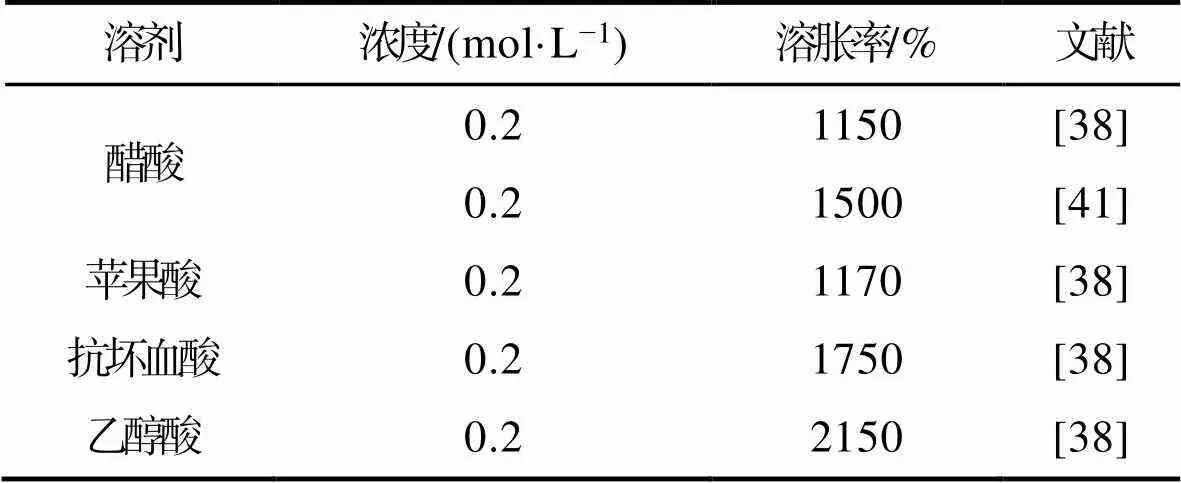
Tab.2 Effect of solvent systems on swelling of chitosan films
2.4 有机酸溶剂对壳聚糖的氧气透过率的影响
壳聚糖膜的氧气透过率(Oxygen Permeability,OP)与壳聚糖分子量无明显相关性,而受到酸溶剂种类的显著影响[60]。丙酸和甲酸所制备壳聚糖膜的OP值高于醋酸,而醋酸所制备壳聚糖膜的OP值高于乳酸[58,70]。
资料显示,壳聚糖膜的OP值为0.39× 10−10~7.11×10−10cm3/(m2·d·kPa)[47]。以苹果酸为溶剂制备的壳聚糖膜表现出较好的氧阻隔性能,OP值为0.39×10−10~1.88×10−10cm3/(m2·d·kPa),而用柠檬酸制备的壳聚糖膜的氧阻隔性较差,OP值为3.26×10−10~4.84×10−10cm3/(m2·d·kPa)。醋酸和丙酸浓度相同,但氧气透过率不同,可能是壳聚糖的本身性质、添加量、制作过程不同而导致差异。
2.5 有机酸溶剂对壳聚糖水蒸气透过率的影响
对于食品体系来说,适当阻隔食品中水分、氧气、二氧化碳和芳香化合物的透过,可延长食品保质期,改善食品品质[61]。
壳聚糖膜的水蒸气透过率(Water Vapor Permeability,WVP)与其相对分子质量、溶剂类型、膜的厚度等有关。资料显示,以甲酸和乳酸为溶剂的壳聚糖膜表现出较差的水蒸气阻隔性能,其WVP分别为0.73 g·m/(m2·d·kPa)和0.56 g·m/(m2·d·kPa),明显高于醋酸[61,77]。Vimaladevi[58]和Caner[70]发现丙酸溶解壳聚糖所制得的膜WVP较醋酸高。
研究表明,二元羧酸制备的壳聚糖膜的WVP值较一元酸低[57]。例如,以丁二酸、己二酸、辛二酸和葵二酸为溶剂制备的壳聚糖膜的WVP分别为醋酸制备壳聚糖膜的1/5.2、1/6.5、1/6.8和1/3.8倍。这可能是二元羧酸的2个羧基与壳聚糖上的氨基离子作用及其产生的交联聚合物,可降低聚合物的自由体积造成其所得壳聚糖膜WVP较低[41]。值得注意的是,葵二酸(碳链为8时)制备所得壳聚糖膜较其他二元羧酸(丁二酸、己二酸、辛二酸)的WVP高,但仍然远远低于醋酸,这可能是因为葵二酸的高疏水性阻止了均相壳聚糖溶液的初始形成,造成壳聚糖膜的不均一性。
Park等[60]研究了醋酸、柠檬酸、苹果酸和乳酸溶解壳聚糖形成的壳聚糖膜的WVP,结果显示,其WVP大小依次为苹果酸<醋酸<柠檬酸<乳酸,其中苹果酸溶解壳聚糖制得膜的WVP为2.24×10−2g·m/(m2·d·kPa)(表3)。
表3 溶剂体系对壳聚糖薄膜水蒸气透过率的影响
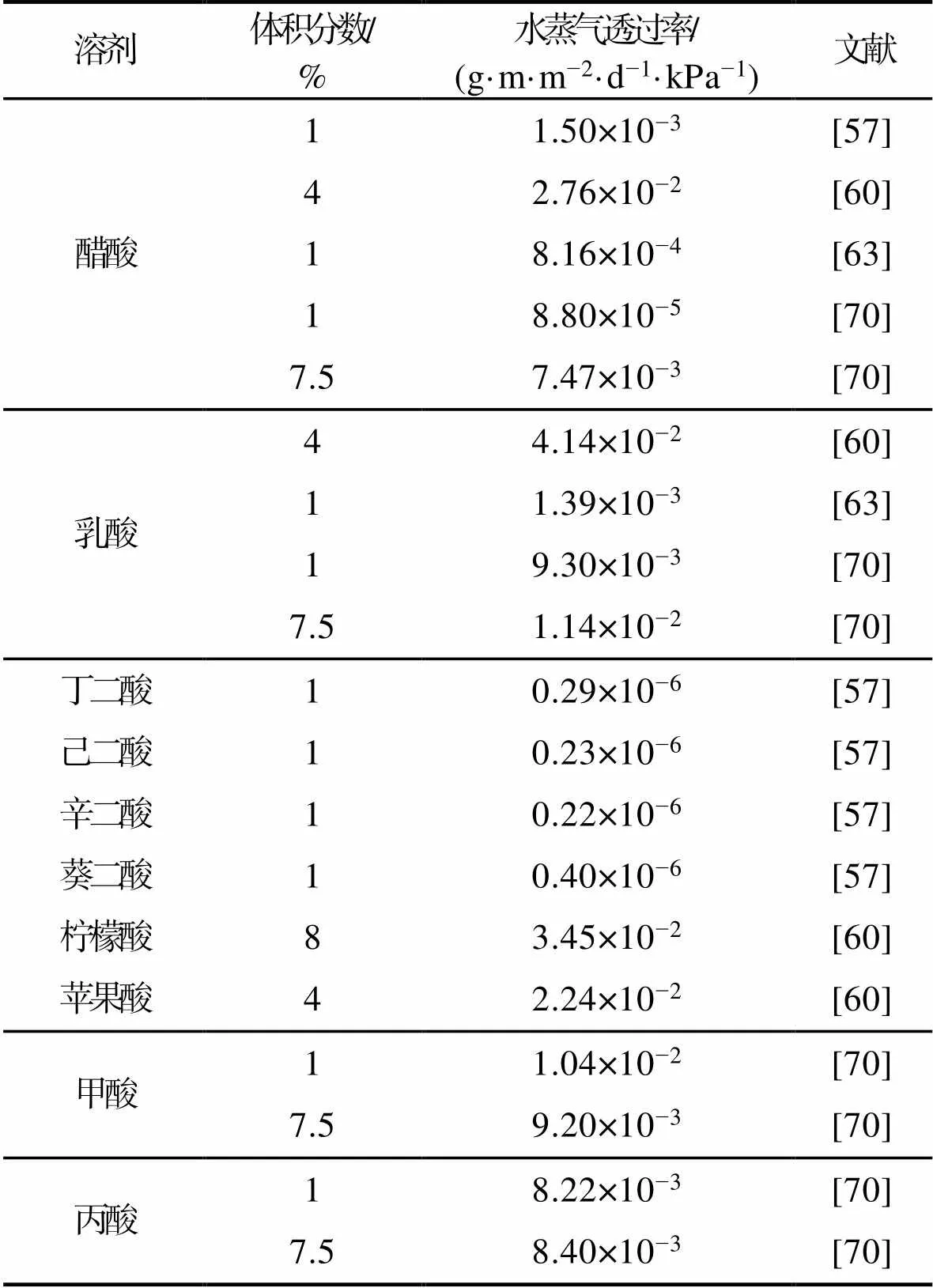
Tab.3 Effect of solvent systems on the water vapor permeability of chitosan films
3 结语
有机酸溶剂体系可为壳聚糖的溶解提供更多的质子,从而促进壳聚糖分子在水中的溶解。与醋酸不同,二羧酸、三羧酸和多元羧酸还可通过离子交换作用实现壳聚糖分子间的交联,且其所带有的官能团(如羟基)可与壳聚糖发生氢键作用,从而改变壳聚糖膜的力学性能和功能特性。与其他有机酸溶剂体系相比,醋酸制得的壳聚糖膜溶胀率较低;辛二酸制的壳聚糖膜的水蒸气透过率较低;而乳酸可显著改善壳聚糖膜的力学性能,并降低氧气透过率。壳聚糖几乎是自然界唯一的阳离子多糖,壳聚糖基膜因其抗菌性和屏障作用,可用于保存和延长食品的货架期,在未来改善食品品质和保鲜方面具有很大的应用前景。目前,关于壳聚糖复合膜的生产和加工的相关学术研究较多,但较差的力学性能限制了其在工业规模上的实际应用,因此如何提高壳聚糖膜性能的实际适用性仍将在未来很长时期内作为众多学者专家研究的热点之一。
[1] 许江菱, 钟晓萍, 朱永茂, 等. 2015—2016年世界塑料工业进展[J]. 塑料工业, 2017, 45(3): 1-44.
XU Jiang-ling, ZHONG Xiao-ping, ZHU Yong-mao, et al. Progress of the World's Plastics Industry in 2015-2016[J]. China Plastics Industry, 2017, 45(3): 1-44.
[2] NEWELL R G, QIAN Y, RAIMI D. Global Energy Outlook 2015[R]. National Bureau of Economic Research, 2016.
[3] CUI S, BORGEMENKE J, QIN Y, et al. Bio-Based Polycarbonates from Renewable Feedstocks and Carbon Dioxide[M]. UK: John Wiley & Sons, 2019: 183-208.
[4] CUI H, SURENDHIRAN D, LI C, et al. Biodegradable Zein Active Film Containing Chitosan Nanoparticle Encapsulated with Pomegranate Peel Extract for Food Packaging[J]. Food Packaging and Shelf Life, 2020, 24: 2214-2894.
[5] HOLCAPKOVA P, STLOUKAL P, KUCHARCZYK P, et al. Anti-Hydrolysis Effect of Aromatic Carbodiimide in Poly (Lactic Acid)/Wood Flour Composites Part A Applied Science and Manufacturing[J]. Composites Payt A: Applied Science and Manufacturing, 2017, 103(10): 283-291.
[6] GALIANO F, BRICEÑO K, MARINO T, et al. Advances in Biopolymer-Based Membrane Preparation And Applications[J]. Journal of Membrane Science, 2018, 564(7): 562-586.
[7] 孙炳新, 谷宏, 韩春阳, 等. 高直链玉米淀粉全降解片材的制备[J]. 包装工程, 2009, 30(4): 37-39.
SUN Bing-xin, GU Hong, HAN Chun-yang, et al. Preparation of Total Biodegradable Sheet with High Amylose Corn Starch[J]. Packaging Engineering, 2009, 30(4): 37-39.
[8] HAGHIGHI H, LICCIARDELLO F, FAVA P, et al. Recent Advances on Chitosan-Based Films for Sustainable Food Packaging Applications[J]. Food Packaging and Shelf Life, 2020, 26: 100551-100567.
[9] HU F, SUN T, XIE J, et al. Functional Properties and Preservative Effect on Penaeus Vannamei of Chitosan Films with Conjugated or Incorporated Chlorogenic Acid[J]. International Journal of Biological Macromolecules, 2020, 159: 333-340.
[10] WILLIAMS P A. Renewable Resources for Functional Polymers and Biomaterials: Polysaccharides, Proteins and Polyesters[M]. London: the Royal Society of Chemistry, 2011: 1-50.
[11] NARASAGOUDR S S, HEGDE V G, CHOUGALE R B, et al. Influence of Boswellic Acid on Multifunctional Properties of Chitosan/Poly(vinyl alcohol) Films for Active Food Packaging[J]. International Journal of Biological Macromolecules, 2020, 154: 48-61.
[12] LIU X, XU Y, ZHAN X, et al. Development and Properties of New Kojic Acid and Chitosan Composite Biodegradable Films for Active Packaging Materials[J]. International Journal of Biological Macromolecules, 2020, 144: 483-490.
[13] 范林林, 李萌萌, 冯叙桥, 等. 壳聚糖涂膜对鲜切苹果贮藏品质的影响[J]. 食品科学, 2014, 35(22): 350-355.
FAN Lin-lin, LI Meng-meng, FENG Xu-qiao, et al. Effect of Chitosan Treatment on Quality of Fresh-Cut Apple during Cold Storage[J]. Food Science, 2014, 35(22): 350-355.
[14] 李海浪. 壳聚糖衍生物的制备及其在药物载体中的应用研究[D]. 上海: 中国科学院研究生院(上海应用物理研究所), 2014: 1-20.
LI Hai-lang. Preparation of Chitosan Derivatives and Their Application in Drug Carriers[D]. Shanghai: Graduate School of Chinese Academy of Sciences (Shanghai Institute of Applied Physics), 2014: 1-20.
[15] 李知函. 壳聚糖基生物质抑菌材料的制备及其应用研究[D]. 广州: 华南理工大学, 2016: 3-11.
LI Zhi-han. Preparation and Application of Chitosan Based Biomass Antibacterial Material[D]. Guangzhou: South China University of Technology, 2016: 3-11.
[16] PARK S I, ZHAO Y. Incorporation of a High Concentration of Mineral or Vitamin into Chitosan-Based Films[J]. Journal of Agricultural and Food Chemistry, 2004, 52(7): 1933-1939.
[17] SUYATMA N E, TIGHZERT L, COPINET A, et al. Effects of Hydrophilic Plasticizers on Mechanical, Thermal, and Surface Properties of Chitosan Films[J]. The Archives of Bone and Joint Surgery, 2005, 53(10): 3950-3957.
[18] WU Tao, ZIVANOVIC S, DRAUGHON F A, et al. Physicochemical Properties and Bioactivity of Fungal Chitin and Chitosan[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 3888-3894.
[19] ELSABEE M Z, ABDOU E S, NAGY K S A, et al. Surface Modification of Polypropylene Films by Chitosan and Chitosan/Pectin Multilayer[J]. Carbohydrate Polymers, 2008, 71(2): 187-195.
[20] MOURYA V K, INAMDAR N N. Chitosan-Modifications And Applications: Opportunities Galore[J]. Reactive and Functional Polymers, 2008, 68(6): 1013-1051.
[21] JAYAKUMAR R, NWE N, TOKURA S, et al. Sulfated Chitin and Chitosan as Novel Biomaterials[J]. International Journal of Biological Macromolecules, 2007, 40(3): 175-181.
[22] DUTTA P K, DUTTA J, TRIPATHI V S. Chitin and Chitosan: Chemistry, Properties and Applications[J]. Journal of Scientific & Industrial Research, 2004, 63(1): 20-31.
[23] KLEMM D, KRAMER F, MORITZ S, et al. Nanocelluloses: a New Family of Nature-Based Materials[J]. Angewandte Chemie International Edition, 2011, 50(24): 5438-5466.
[24] PILLAI C K S, PAUL W, SHARMA C P. Chitin and Chitosan Polymers: Chemistry, Solubility and Fiber Formation[J]. Progress in Polymer Science, 2009, 34(7): 641-678.
[25] ELSABEE M Z, ABDOU E S. Chitosan Based Edible Films and Coatings: A Review[J]. Materials Science & Engineering C, Materials for Biological Applications, 2013, 33(4): 1819-1841.
[26] ARANAZ I, MENGÍBAR M, HARRIS R, et al. Functional Characterization of Chitin and Chitosan[J]. Current Chemical Biology, 2009, 3(2): 203-230.
[27] CHEN Chu-chu, LI Da-gang, SHAO Xu. High-Performance Nanocomposite Films: Reinforced with Chitosan Nanofiber Extracted from Prawn Shells[J]. Journal of Materials Science, 2014, 49(3): 1215-1221.
[28] TIAN Q, LIU S, SUN X, et al. Theoretical Studies on the Dissolution of Chitosan in 1-Butyl-3-Methylimidazolium Acetate Ionic Liquid[J]. Carbohydrate Research, 2015, 408: 107-113.
[29] PARK J W, CHOI K H, PARK K K. Acid-Base Equilibria and Related Properties of Chitosan[J]. Bulletin of the Korean Chemical Society, 1983, 4: 68-72.
[30] LAKEHAL I, MONTEMBAULT A, DAVID L, et al. Prilling and Characterization of Hydrogels and Derived Porous Spheres from Chitosan Solutions with Various Organic Acids[J]. International Journal of Biological Macromolecules, 2019, 129: 68-77.
[31] DEMARGER-ANDRE S, DOMARD A. Chitosan Carboxylic Acid Salts in Solution and in the solid state[J]. Carbohydrate Polymers, 1994, 23(3): 211-219.
[32] KHOURI J, PENLIDIS A, MORESOLI C. Heterogeneous Method of Chitosan Film Preparation: Effect of Multifunctional Acid on Film Properties[J]. Journal of Applied Polymer Science, 2020, 137(18): 48648.
[33] VELÁSQUEZ-COCK J, RAMÍREZ E, BETANCOURT S, et al. Influence of the Acid Type in the Production of Chitosan Films Reinforced with Bacterial Nanocellulose[J]. International Journal of Biological Macromolecules, 2014, 69: 208-213.
[34] ZHONG Y, SONG X, LI Y. Antimicrobial, Physical and Mechanical Properties of Kudzu Starch-Chitosan Composite Films as a Function of Acid Solvent Types[J]. Carbohydrate Polymers, 2011, 84(1): 335-342.
[35] QIAO C, MA X, WANG X, et al. Structure and Properties of Chitosan Films: Effect of the Type of Solvent Acid[J]. LWT-Food Science and Technology, 2021, 135(7): 109984-109990.
[36] KISHIDA A, IKADA Y, DUMITRIU S. Polymeric Biomaterials[M]. New York: Marcel & Decker Inc, 2002: 133-145.
[37] HWANG Y H, LIU T Y K F H, LAI J Y, et al. Improvement in the Properties of Chitosan Membranes Using Natural Organic Acid Solutions as Solvents for Chitosan Dissolution[J]. Journal of Bioscience and Bioengineering, 2007, 27(12): 23-28.
[38] HARISH PRASHANTH K V, THARANATHAN R N. Chitin/Chitosan: Modifications and Their Unlimited Application Potential-an Overview[J]. Trends in Food Science and Technology, 2007, 18(3): 117-131.
[39] CHATELET C, DAMOUR O, DOMARD A. Influence of the Degree of Acetylation on some Biological Properties of Chitosan Films[J]. Biomaterials, 2001, 22(3): 261-268.
[40] LIN TENG SHEE F, ARUL J, BRUNET S, et al. Solubilization of Chitosan by Bipolar Membrane Electroacidification[J]. Journal of Agricultural and Food Chemistry, 2006, 54(18): 6760-6764.
[41] CHEN Po-hui, KUO Ting-yun, LIU F H, et al. Use of Dicarboxylic Acids to Improve and Diversify the Material Properties of Porous Chitosan Membranes[J]. Journal of Agricultural and Food Chemistry, 2008, 56(19): 9015-9021.
[42] QIN C, LI H, XIAO Q, et al. Water-Solubility of Chitosan and Its Antimicrobial Activity[J]. Carbohydrate Polymers, 2006, 63(3): 367-374.
[43] RITTHIDEJ G C. Nasal Delivery of Peptides and Proteins with Chitosan and Related Mucoadhesive Polymers[M]. London: Academic Press, 2011: 47-68.
[44] YI H, WU L Q, BENTLEY W E, et al. Biofabrication with Chitosan[J]. Biomacromolecules, 2005, 6(6): 2881-2894.
[45] CADOGAN E I, LEE C H, POPURI S R, et al. Effect of Solvent on Physico-Chemical Properties and Antibacterial Activity of Chitosan Membranes[J]. International Journal of Polymeric Materials and Polymeric Biomaterials, 2014, 63(14): 708-715.
[46] RINAUDO M. Chitin and Chitosan: Properties and Applications[J]. Progress in Polymer Science, 2006, 31(7): 603-632.
[47] BUTLER B L, VERGANO P J, TESTIN R F, et al. Mechanical and Barrier Properties of Edible Chitosan Films as Affected by Composition and Storage[J]. Journal of Food Science, 1996, 61(5): 953-956.
[48] NIAMSA N, BAIMARK Y. Preparation and Characterization of Highly Flexible Chitosan Films for Use as Food Packaging[J]. American Journal of Food Technology, 2009, 4(4): 162-169.
[49] BECERRA J, SUDRE G, ROYAUD I, et al. Tuning the Hydrophilic/Hydrophobic Balance to Control the Structure of Chitosan Films and Their Protein Release Behavior[J]. AAPS PharmSciTech, 2017, 18(4): 1070-1083.
[50] PATERSON M, KENNEDY J F. Chitin Handbook; European Chitin Society; RAA Muzzarelli, MG Peter (Eds.); Grottammare, Italy, 1997, xv+ 528 pages, ISBN 88-86889-01-1, US $95.00[J]. Carbohydrate Polymer, 1999, 39(4): 383-389.
[51] URAGAMI T, MATSUDA T, OKUNO H, et al. Structure of Chemically Modified Chitosan Membranes and Their Characteristics of Permeation and Separation of Aqueous Ethanol0 Solutions[J]. Journal of Membrane Science, 1994, 88(3): 243-251.
[52] GARTNER C, LÓPEZ B L, SIERRA L, et al. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-Ray Diffraction[J]. Biomacromolecules, 2011, 12(4): 1380-1386.
[53] TSIGE M, GREST G S. Solvent Evaporation and Interdiffusion in Polymer Films[J]. Journal of Physics-Condensed Matter, 2005, 17(49): 4119-4132.
[54] PAVONI J M F, LUCHESE C L, TESSARO I C. Impact of Acid Type for Chitosan Dissolution on the Characteristics and Biodegradability of Cornstarch/Chitosan Based Films[J]. International Journal of Biological Macromolecules, 2019, 138: 693-703.
[55] SAKAI Y, HAYANO K, YOSHIOKA H, et al. A Novel Method of Dissolving Chitosan in Water for Industrial Application[J]. Polymer Journal, 2001, 33(8): 640-642.
[56] GHASEMI A, MOHTASHAMI M, SHEIJANI S S, et al. Chitosan-Genipin Nanohydrogel as a Vehicle for Sustained Delivery of Alpha-1 Antitrypsin[J]. Research in Pharmaceutical Sciences, 2015, 10(6): 523-534.
[57] MEDIMAGH R, ALOUI H, JEMLI M, et al. Enhanced Functional Properties of Chitosan Films Cross-Linked by Biosourced Dicarboxylic Acids[J]. Polymer Science Series A, 2016, 58(3): 409-418.
[58] VIMALADEVI S, PANDA S K, XAVIER K A, et al. Packaging Performance of Organic Acid Incorporated Chitosan Films on Dried Anchovy (Stolephorus Indicus)[J]. Carbohydrate Polymers, 2015, 127: 189-194.
[59] PARK S Y, PARK H J, LIN X Q, et al. Characterization of Chitosan Film and Structure in Solution[M]. New York: Elsevier, 2000: 199-204.
[60] PARK S Y, JUN S T, MARSH K S. Physical Properties of PVOH/Chitosan-Blended Films Cast from Different Solvents[J]. Food Hydrocolloids, 2001, 15(4-6): 499-502.
[61] PARK S Y, MARSH K S, RHIM J W. Characteristics of Different Molecular Weight Chitosan Films Affected by the Type of Organic Solvents[J]. Journal of Food Science, 2002, 67(1): 194-197.
[62] CHEN J L, ZHAO Y. Effect of Molecular Weight, Acid, and Plasticizer on the Physicochemical and Antibacterial Properties of Β-Chitosan Based Films[J]. Journal of Food Science, 2012, 77(5): 127-136.
[63] PAVONI J M F, SANTOS N Z, MAY I C, et al. Impact of Acid Type and Glutaraldehyde Crosslinking in the Physicochemical and Mechanical Properties and Biodegradability of Chitosan Films[J]. Polymer Bulletin, 2021, 78(2): 981-1000.
[64] RHIM J W, GENNADIOS A, HANDA A, et al. Solubility, Tensile, and Color Properties of Modified Soy Protein Isolate Films[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 4937-4941.
[65] SATO S, SAKAMOTO T, MIYAZAWA E, et al. One-Pot Reductive Amination of Aldehydes and Ketones with α-Picoline-Borane in Methanol, in Water, and in Neat Conditions[J]. Tetrahedron, 2004, 60(36): 7899-7906.
[66] CLAYDEN J, GREEVES N, WARREN S, et al. Organometallic Chemistry[J]. Oxford University Press Inc, 2001, 20(5): 1311-1343.
[67] BHUMKAR D R, POKHARKAR V B. Studies on Effect of pH on Cross-Linking of Chitosan with Sodium Tripolyphosphate: A Technical Note[J]. AAPS PharmSciTech, 2006, 7(2): 138-143.
[68] SHU X Z, ZHU K J. A Novel Approach to Prepare Tripolyphosphate/Chitosan Complex Beads for Controlled Release Drug Delivery[J]. International Journal of Pharmaceutics, 2000, 201(1): 51-58.
[69] JOESTEN M D, SCHAAD L J. Hydrogen Bonding[M]. New York: M Dekker, 1974: 20-50.
[70] CANER C, VERGANO P J, WILES J L. Chitosan Film Mechanical and Permeation Properties as Affected by Acid, Plasticizer, and Storage[J]. Journal of Food Science, 1998, 63(6): 1049-1053.
[71] CRUZ R C A L, DINIZ L G M, LISBOA H M, et al. Effect of Different Carboxylic Acids as Solvent on Chitosan Fibers Production by Wet Spinning[J]. Materia-Rio De Janeiro, 2016, 21(2): 525-531.
[72] 胡天娇, 陆晔婷, 彭亚倩, 等. 柠檬酸交联处理对壳聚糖纤维的增强作用[J]. 丝绸, 2020, 57(12): 15-20.
HU Tian-jiao, LU Ye-ting, PENG Ya-qian, et al. Effect of Cross-Linking Treatment with Citric Acid on Enhancement of Chitosan Fiber[J]. Silk, 2020, 57(12): 15-20.
[73] FALAMARZPOUR P, BEHZAD T, ZAMANI A. Preparation of Nanocellulose Reinforced Chitosan Films, Cross-Linked by Adipic Acid[J]. International Journal of Molecular Sciences, 2017, 18(2): 396.
[74] GHOSH A, ALI M A. Studies on Physicochemical Characteristics of Chitosan Derivatives with Dicarboxylic Acids[J]. Journal of Materials Science, 2012, 47(3): 1196-1204.
[75] MITRA T, SAILAKSHMI G, GNANAMANI A, et al. Adipic Acid Interaction Enhances the Mechanical and thermal Stability of Natural Polymers[J]. Journal of Applied Polymer Science, 2012, 125(S2): 490-500.
[76] RITTHIDEJ G C, PHAECHAMUD T, KOIZUMI T. Moist Heat Treatment on Physicochemical Change of Chitosan Salt Films[J]. International Journal of Pharmaceutics, 2002, 232(1/2): 11-22.
[77] KIM K M, SON J H, KIM S K, et al. Properties of Chitosan Films as a Function of pH and Solvent Type[J]. Journal of Food Science, 2006, 71(3): 119-124.
Research Progress of Chitosan Film-Forming Properties in Organic Acids Solvent Systems
ZHONG Yan-qin1, YANG Ming-liang1, LYU Jing-yi1,2, GE Yong-hong1,2, MI Hong-bo1,2, CHEN Jing-xin1,2
(1.College of Food Science and Engineering, Bohai University, Jinzhou 121013, China; 2.National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Jinzhou 121013, China)
The organic acid solvent system is very significant for the film-forming properties of chitosan. The work aims to explore its potential molecular mechanism to provide a theoretical reference for the related research of chitosan films.The chemical composition and film-forming mechanism of chitosan, as well as the mechanical properties, swelling property, oxygen permeability and water vapor permeability of chitosan films were reviewed in different organic acid solvent systems.Theorganic acid solvent system can provide more protons for the dissolution of chitosan and realize the solubility of chitosan in water. In addition, the number of carboxylic acids and hydroxyl groups in the molecular structure of organic acids, the length of carbon chain, the hydrogen bond and ionic force between organic acids and chitosan were different, which can greatly affect the film-forming performance of chitosan. Theorganic acid solvent system has a crucial effect on the performance of chitosan film, which helps to enhance its applicability in improvement of food quality and preservation.
chitosan film; organic acid; film properties
TB484;S377
A
1001-3563(2022)05-0023-10
10.19554/j.cnki.1001-3563.2022.05.004
2021-06-30
辽宁省博士科研启动基金(2020-BS-238);辽宁省科技特派团项目(2021JH5/10400025);辽宁省教育厅科学研究项目(LJKZ1025)
钟燕琴(1995—),女,渤海大学硕士生,主攻果蔬加工及贮藏工程。
陈敬鑫(1985—),男,博士,渤海大学副教授,主要研究方向为农产品加工及贮藏。