miR-182靶向调控PI3K/AKT/FOXO3a信号通路对胶质瘤干细胞生物学行为的影响及其机制研究
贾晓琼 孙秋颖 刘晓宇 信涛
胶质瘤是临床较为常见的原发性恶性颅脑肿瘤疾病,病灶组织呈浸润性生长,故外科手术难以彻底切除,具有术后复发率高、治疗困难、生存时间短等特点[1-2]。人胶质瘤干细胞(Glioma stem cells,GSCs)具有自我更新、无限增殖、多向分化等生物学功能的肿瘤细胞,其可侵袭和播散至远处脑组织,是胶质瘤疾病复发及难以根治的重要原因[3-4]。因此有效抑制GSCs生物学行为是治疗胶质瘤的关键所在。miR-182是一种定位于7q32.2染色体的微小核糖核酸(MicroRNA,miRNA),其可通过靶向调控磷脂酰肌醇-3-激酶/蛋白激酶B(Phosphatidylinositol 3 kinase/protein kinas B,PI3K/AKT)信号通路促进肝癌细胞生长、增殖和抑制凋亡[5],且人类叉头框O蛋白3a(FOXO3a)是PI3K/AKT信号通路的下游细胞因子,主要受AKT调控[6]。目前miR-182对于GSCs增殖、凋亡、迁移、侵袭等生物学行为的影响研究较少,且缺乏相关的机制研究,因此本研究拟观察miR-182对GSCs生物学行为的影响,并探讨其靶向调控PI3K/AKT/FOXO3a信号通路的作用机制,从而为胶质瘤的临床治疗提供理论依据。
1 资料与方法
1.1 胶质瘤患者及组织标本来源
20例胶质瘤患者均为内蒙古自治区肿瘤医院神经外科2014年1月—2015年10月住院行外科手术切除治疗的患者,男15例,女5例,年龄47~68岁,平均年龄(56.7±8.2)岁,术后病理确诊为星形细胞瘤7例,混合胶质瘤5例,多形性胶质母细胞瘤4例,间变性室管膜瘤4例(其中1例经实验室分离,并最终成功培养出GSCs)。所有患者均知情本研究方案及研究目的,本研究方案已通过医院伦理委员会批准。
1.2 研究方法
1.2.1 GSCs分离、培养及分选 将采集到的新鲜胶质瘤组织均匀剪成约1 mm×1 mm×1 mm大小的组织块,然后消化处理制成含细胞上清液,置于DMEM/F12(1∶1)培养基中进行培养,同时加入培养细胞因子,培养2 d后收集悬浮细胞球,采用免疫磁珠技术细胞分选仪对CD133+GSCs进行分选。
1.2.2 CD133+GSCs球免疫组织化学检测 CD133+GSCs球贴壁玻片后采用PBS溶液洗涤,然后置于山羊血清溶液中在室温环境下孵育1 h,依次加入一抗(兔抗-CD133,浓度为1∶100)抗体及鼠抗-nestin(浓度为1∶100)抗体,最后孵育过夜,再次PBS溶液洗涤后与二抗(浓度为1∶100)一起在室温下孵育1 h,PBS洗涤后使用DAPI复染细胞核。磷酸缓冲盐溶液替代一抗作为阴性对照组,正常人胚胎神经干细胞作为阳性对照组,采用相关分析软件采集和分析免疫组织化学图像。
1.2.3 细胞分组及转染 将处于对数生长期内的CD133+GSCs接种至6孔板中,分为空白对照组(不做特殊处理)、miR-182 mimics组(采用Lipofectamine 2000将miR-182 mimic转染细胞)及阴性对照组(采用Lipofectamine 2000将无意义序列转染细胞),每组设3个重复。转染后在倒置荧光显微镜下计算转染效率。
1.2.4 miR-182 mRNA表达水平检测 采用RT-PCR法检测各组细胞miR-182 mRNA表达水平,首先提取细胞总RNA,合成cDNA,然后采用逆转录-聚合酶链反应(RT-PCR)检测miR-182 mRNA表达水平,miR-182:上游引物,5′-ACACTCCAGCTGGGTTTGGCAATGGTAGAACTCAC ACT-3′,下游引物,5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAG TTGAGAGTGTGAG-3′,电泳产物大小为435 bp。β-actin:上游引物,5′-TCACCAACTGG GACGACAT-3′,下游引物,5′-GCACAGCCTGGATAGCAAC-3′,电泳产物大小为173bp。PCR产物琼脂糖凝胶电泳,然后采用相应软件对目标条带予以分析和计算,miR-182/β-actin 作为miR-182 mRNA的相对定量表达水平。
1.2.5 GSCs增殖检测 采用CCK-8细胞活性检测试剂盒检测三组GSCs增殖情况。各组细胞完成转染12 h后,将细胞接种到96孔板中,接种密度为2×103个/100 μL,接种后12、36、60 h分别加入CCK-8溶液,37℃条件下培养4 h,在波长450 nm处进行吸光度测定,对各组细胞增殖率进行计算。
1.2.6 GSCs凋亡检测 将肿瘤坏死因子(TNF-α)分别加入到空白对照组、阴性对照组和miR-182 mimics实验组的培养基中,终浓度为100 ng/L,转染后24、48和72 h采用流式细胞仪检测各组GSCs凋亡情况(Annexin-V、PI染色阳性)。
1.2.7 GSCs迁移及侵袭能力检测 采用细胞划痕法检测各组细胞迁移能力。选取对数生长期细胞,在6孔板进行铺板,细胞数量为5×105个/孔,细胞转染24 h后,取各孔中央位置,用黄枪头枪尖划出一条划痕,且划痕贯穿培养整个孔,保持各孔细胞划痕的宽度一致,用吸管吸除细胞培养液,PBS漂洗(2~3次),将悬浮细胞和细胞碎片移除,最后对各孔拍照并将其作为0 h细胞迁移状况图予以保存。随后将完全培养基重新加入到每孔中,剂量为2.0 mL,放入培养箱中继续培养,培养时间为24~48 h,计算各组迁移率。采用Transwell小室检测各组细胞侵袭能力,选取对数生长期细胞,以DMEM/F12(1∶1)培养基调整细胞数为5×105个/mL,取100 μL 细胞接种在Transwell上室内,细胞转染24 h后,下室加入DMEM培养液500 μL,37℃、5%CO2培养24 h后,将滤膜上层的细胞用棉签抹去,滤膜以甲醇固定处理5 min,100倍光镜下选择5个不同视野的穿过膜的细胞数,求平均值。
1.2.8 PI3K/AKT/FOXO3a信号通路相关蛋白检测 采用蛋白质印迹法(Western blot)检测各组细胞PI3K(P110α)、p-AKT(Ser473)和FOXO3a蛋白表达水平,抗体工作浓度均为1∶100,同时选择GAPDH作为内参,采用相关软件分析和计算目的蛋白相对密度值。
1.3 统计学分析
运用SPSS 16.0统计软件分析数据资料,多组间比较采用单因素方差分析和重复测量设计方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 GSCs培养鉴定结果
GSCs经培养和连续传代5次后采用nestin及CD133染色处理后胶质瘤干细胞球呈阳性表达,且DAPI呈细胞核着染(图1)。

图1 GSCs培养染色鉴定图像Figure 1 GSCs were identified by staining with nestin and CD133Note:A.GSCs were stained with nestin,showing blue color;B.GSCs were stained with CD133,showing red color;C.GSCs were stained with nestin and CD133,showing merge fluorescence image.
2.2 各组细胞转染效率比较
miR-182 mimics内有绿色荧光基团(FITC),转染24 h后将空白对照组、阴性对照组及miR-182 mimics组在倒置荧光显微镜下观察转染效率,miR-182 mimics组转染效率为87.5%,而空白对照组、阴性对照组未见绿色荧光表达(图2)。
2.3 各组细胞miR-182 mRNA表达水平比较
miR-182 mimics组miR-182 mRNA表达水平(0.527±0.116)明显高于空白对照组(0.125±0.012)及阴性对照组(0.130±0.015)(P<0.01),空白对照组与阴性对照组比较无统计学差异(P>0.05)(图3,图4)。
2.4 各组细胞不同时间增殖率比较
miR-182 mimics组细胞转染后24、48及72 h时的细胞增殖率明显高于空白对照组、阴性对照组(P<0.01),而空白对照组与阴性对照组比较无统计学差异(P>0.05)(表1)。
2.5 各组细胞不同时间凋亡率比较
miR-182 mimics组细胞转染后24、48及72 h时的细胞凋亡率明显低于空白对照组、阴性对照组(P<0.05),而空白对照组与阴性对照组比较无统计学差异(P>0.05)(表2)。
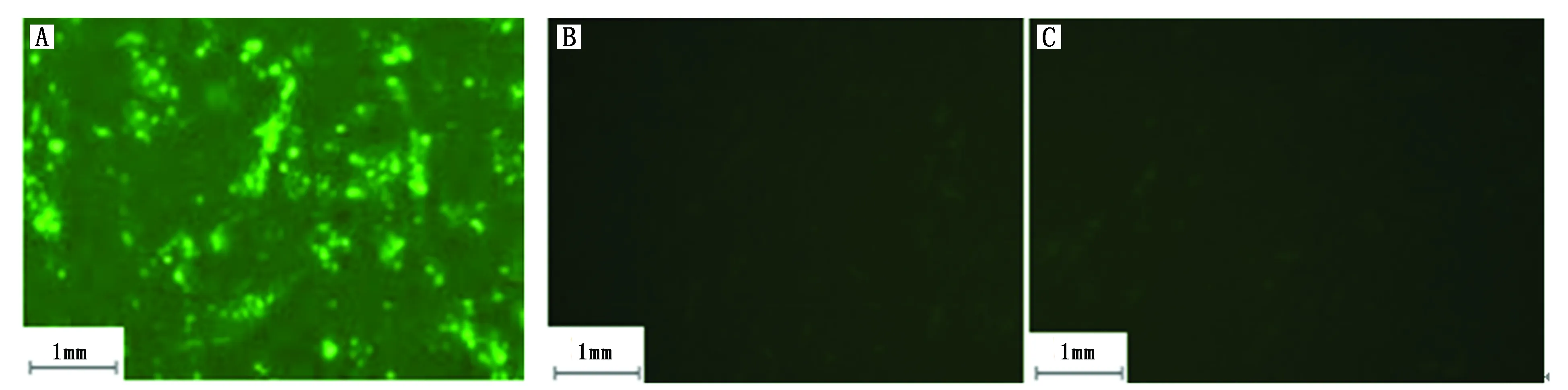
图2 各组细胞转染后荧光显微镜下图像Figure 2 GSC fluorescence microscope images in each group after transfectionNote:A.Fluorescence microscope image showed more cells with green fluorescence after transfection of miR-182 mimics in GSCs(the miR-182 mimics group);B.Fluorescence microscope image showed no cells with green fluorescence(the blank control group);C.Fluorescence microscope image showed no cells with green fluorescence(the negative control group).
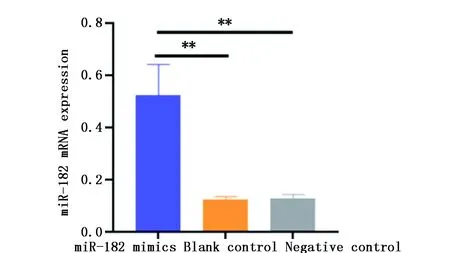
图3 各组细胞miR-182 mRNA表达水平比较Figure 3 The expression of miR-182 mRNA in each groupNote:**P<0.01,when compared with the miR-182 mimics group.
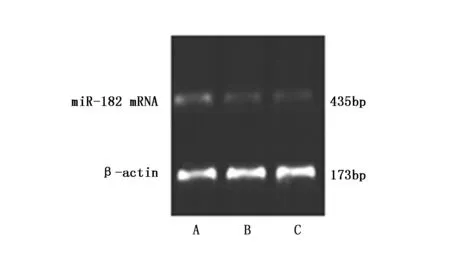
图4 各组细胞miR-182 mRNA电泳图Figure 4 The expression of miR-182 mRNA in each group by electrophoresisNote:A.RT-PCR products in the miR-182 mimics group;B.RT-PCR products in the blank control group;C.RT-PCR products in the negative control group.

表1 各组细胞不同时间增殖率比较(%)

表2 各组细胞不同时间凋亡率比较(%)
2.6 各组细胞迁移、侵袭能力比较
miR-182 mimics组细胞迁移率[(41.37±3.91)%]和侵袭能力(203±25个)均明显高于阴性对照组[(19.54±1.87)%,114±11个]及空白对照组[(19.17±1.92)%,118±12个](P<0.01),而空白对照组与阴性对照组比较无统计学差异(P>0.05)(图5,图6)。
2.7 各组细胞PI3K、p-AKT、FOXO3a蛋白表达水平比较
miR-182 mimics组胶质瘤干细胞转染后PI3K、p-AKT蛋白表达水平明显高于空白对照组、阴性对照组(P<0.01),FOXO3a蛋白表达水平明显低于空白对照组、阴性对照组(P<0.01),而空白对照组与阴性对照组PI3K、p-AKT、FOXO3a蛋白表达水平比较无统计学差异(P>0.05)(表3,图7)。
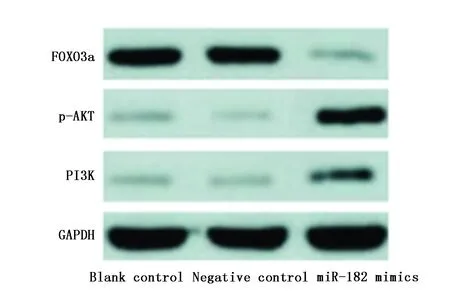
图7 各组细胞PI3K、p-AKT、FOXO3a蛋白表达水平比较Figure 7 The expression of PI3K,p-AKT and FOXO3a proteins in each group

图5 各组细胞迁移能力实验图(200×)Figure 5 The ability of cell migration in each group(200×)
图6 各组细胞侵袭能力实验图(200×)Figure 6 The ability of cell invasion in each group(200×)
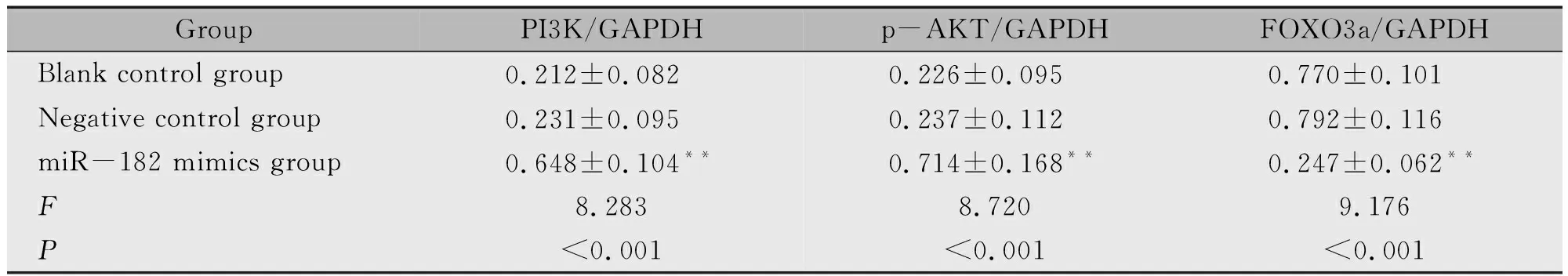
表3 各组细胞PI3K、p-AKT、FOXO3a蛋白表达水平比较
3 讨论
虽然近些年我国医疗诊治技术得到迅猛的发展,但胶质瘤患者5年生存率仍低于5%,其发病机制尚未研究清楚,临床上也缺乏治疗此疾病的靶向药物[7-8]。miRNAs作为一类新发现的癌基因或抑癌基因,其表达水平出现异常在各种恶性肿瘤疾病发生发展过程中起着重要作用,可通过影响肿瘤细胞的生物学行为对恶性肿瘤产生影响[9]。其中miR-182是一种具有癌基因作用的miRNAs,可明显增强多种恶性肿瘤细胞的增殖、侵袭等功能。国内外研究均发现[10-12],miR-182可通过调控多种基因或蛋白表达而影响胶质母细胞瘤、胶质瘤细胞的增殖和侵袭能力,但其对GSCs生物学行为的文献报道相对较少。
GSCs是类似于神经干细胞的细胞群,其可通过调控PI3K/AKT、成纤维细胞生长因子2、细胞外调节蛋白激酶1/2等信号通路促进肿瘤细胞的增殖、侵袭、免疫逃避,从而促进肿瘤组织内新生血管形成、术后疾病复发、异质性形成,同时还可提高细胞对放化疗的耐受性[13-14]。因此本研究从1例胶质瘤患者病灶组织中成功分离出GSCs,经实验室培养及连续传代5次后予以nestin、CD133染色鉴定验证。将miR-182 mimics转染至GSCs后倒置荧光显微镜下显示其转染效率符合随后的实验要求,采用RT-PCR法检测发现,miR-182 mimics组miR-182 mRNA表达水平明显高于空白对照组及阴性对照组,提示miR-182 mimics转染细胞后可明显提高miR-182 mRNA的表达水平。然后检测各组细胞转染后的各种生物学行为改变,结果显示miR-182 mimics组细胞的增殖、迁移、侵袭能力均强于空白对照组及阴性对照组,而凋亡率低于空白对照组及阴性对照组,提示miR-182高水平表达可增强GSCs增殖、迁移、侵袭能力和抑制细胞凋亡,对GSCs也具有明显的类癌基因作用。
研究进一步分析miR-182通过何种信号通路影响GSCs的生物学行为,PI3K/AKT信号通路是连接细胞内外信号传递的重要桥梁,AKT则是该信号通路的关键环节,其磷酸化后可使得PI3K/AKT信号通路活化,从而有效调控处于下游部位的相关信号分子,对细胞生物学行为产生重要的影响[15]。而FOXO3a正是PI3K/AKT信号通路下游部位的重要转录因子,其受到蛋白激酶B和核因子KB激酶B的抑制剂等修饰活化后,其生物学活性功能出现显著性改变,从而在肿瘤细胞增殖、侵袭等方面发挥重要作用[16]。国外较多研究均证实[17-18],PI3K/AKT/FOXO3a信号通路参与了细胞增殖、凋亡、氧化应激反应等过程。本研究也发现,miR-182 mimics组PI3K、p-AKT蛋白表达水平明显高于空白对照组和阴性对照组,而FOXO3a蛋白表达水平明显低于空白对照组和阴性对照组,提示miR-182高水平表达可激活活化GSCs的PI3K/AKT/FOXO3a信号通路。
综上所述,miR-182可能通过激活活化PI3K/AKT/FOXO3a信号通路而起到增强GSCs增殖、迁移及侵袭能力和抑制细胞凋亡的作用,有可能成为临床治疗胶质瘤的新靶点。本研究还需通过动物实验研究加以验证,此外miR-182是否还可通过其他信号通路影响GSCs的生物学行为仍需继续进一步探讨。

