放疗联合靶向治疗与同步放化疗治疗非小细胞肺癌脑转移疗效及安全性的meta分析
陈莉娜 迪娜·木拉提 黄鑫淼 加孜那·托哈依
1新疆医科大学第一附属医院创伤重症监护室,乌鲁木齐830011;2新疆自治区人民医院呼吸科,乌鲁木齐830011;3新疆维吾尔自治区卫生健康委员会,乌鲁木齐830011;4新疆医科大学第一附属医院呼吸与呼吸危重症中心,乌鲁木齐830011
脑转移瘤是中枢神经系统最常见的肿瘤,其发生率根据原发性肿瘤的起源而不同,约40%~50%脑转移瘤起源于肺部原发肿瘤,据估计非小细胞肺癌 (non-s mall cell l ung cancer,NSCLC)的患者中约有25%~40%会发生脑转移[1-2]。晚期NSCLC脑转移患者的预后极差,绝大多数患者因无法控制的全身性疾病而死亡。长期以来全脑放射疗法是具有多个脑转移病灶的NSCLC 的标准疗法,可减轻症状并延长生存期。此外对于单个脑转移病灶,立体定向放疗可通过有效的高剂量照射肿瘤靶区使肿瘤组织坏死,从而实现微创,成为一种主要的替代治疗方法。有研究显示铂类化疗药物具有良好的抗肿瘤活性及较高的脑脊液浓度,其联合全脑放射疗法治疗NSCLC脑转移可延长患者的生存期,且该方案完全能够被患者耐受[3-4]。近年来,以表皮生长因子受体酪氨酸激酶抑制剂(epider mal growth factor receptor tyrosine kinase inhibitor,EGFR-TKIs)为代表的靶向药物已被纳入晚期转移性NSCLC的一线治疗药物,与常规化疗相比,其具有更好的应答和生存率[5],特别是放射治疗和EGFR-TKIs可能具有协同的抗肿瘤作用,可产生持续的临床疗效和良好的安全性[6]。尽管治疗方案在不断优化和进步,但放疗联合EGFR-TKIs在NSCLC 脑转移患者中的作用仍存在争议。目前大部分关于治疗肺癌脑转移的研究均为回顾性病例研究,存在样本量较少、质量参差不齐等问题,需要更多相对大规模的临床试验来验证其疗效及安全性。本文重点探讨了放疗联合靶向治疗与放化疗在治疗NSCLC脑转移过程中的疗效及安全性,旨在通过meta分析将多个小样本数据资料合并,提高原结果的统计效能,解决各研究的结果不一致性,为NSCLC脑转移患者选择治疗方案提供指导意义。
1 材料与方法
1.1 纳入标准 (1)研究对象为病理组织学明确诊断的NSCLC,CT、MRI或PET-CT 影像学检查证实脑转移,且均未合并其他肿瘤。(2)研究对象KPS评分≥60分,体能状况评分≤3分。 (3)试验组及对照组均接受放疗,试验组在放疗同时接受靶向治疗,对照组接受化疗。(4)文章提供的结局指标。主要测量指标:疾病进展、疾病稳定、部分缓解、完全缓解、客观缓解率 (objective remission rate、ORR)、疾 病 控 制 率 (disease control rate、DCR)、1年生存率、无进展生存期、总生存期、中位生存期;次要测量指标:治疗过程中的不良反应,如3/4级血液毒性事件,恶心、呕吐等胃肠道反应,头痛,肝肾功能损害,皮疹。能够非常方便获取或计算出优势比及其95%CI。(5)语种为中文或英文。
1.2 排除标准 (1)排除个案报道、病例报道、文献综述、会议摘要、动物实验等。 (2)数据不足、无法获得全文的文献。(3)与所研究内容结论无关的文献。
1.3 检索策略 检索Web of Science、Embase、Pub Med、中国期刊全文数据库、万方、中国知网、维普中文科技期刊数据库等数据库2019年10月前所收录的中英文文章,使用主题词及自由词复合检索方式。
1.4 资料收集分析与文献质量评价 由2名研究者独立阅读文献,按照数据提取标准方式提取数据,当提取结果意见不一致时,增加1名研究人员协商讨论达成一致结果。参照纽卡斯尔-渥太华量表进行文献质量评价。主要内容包括:(1)研究对象的选择,病例确定是否恰当,对照的选择和确定; (2)设计和统计分析时是否考虑到组间可比性;(3)暴露因素的确定及无应答率。分数分布范围为0~9分,将得分>5分的研究作为较高质量的文献并纳入。
1.5 数据提取 2名研究者使用标准化的数据提取表独立地提取并总结了所有纳入研究的相关数据:发表日期、第一作者、研究对象国籍、病例数、性别、年龄、肺癌病理类型、治疗方案、有效率、不良反应等。
1.6 统计学分析
1.6.1 异质性检验 利用Endnote将文献归类后,在Excel中输入数据进一步分析,采用R 语言软件对各研究的试验组和对照组进行异质性检验,比值比(odds ratio,OR)用来量化ORR 和治疗中出现的不良反应发生率。利用I2检验或Q 统计量检验评价异质性检验,当I2≥0%且<25%时表示无异质性,≥25%且<50%提示轻度异质性,≥50%且<75%提示中度异质性,≥75%提示高度异质性。Cochrane手册中认为只要I2≥50%,则可认为异质性较大。假设齐性检验的α值=0.1,P>0.1,提示无异质性;P<0.1,提示有异质性。当I2<50%或P>0.1采用齐性检验的固定效应模型,反之则检查纳入研究的原始数据及提取数据的方法是否准确。若异质性可能来源于种族、性别、疗程、剂量等因素可使用亚组分析或meta回归,同时进行敏感性分析查找异质性的来源,如仍无法解释异质性原因,则采用非齐性检验的随机效应模型进行合并。
1.6.2 敏感性分析 在通过去除单项研究法将纳入研究逐一排除后,对剩余的研究进行meta 分析,评价汇总敏感度与特异度。若结果与未去除单项前结果相差不大,说明纳入研究文献稳定性好,反之则说明稳定性差。
2 结果
2.1 文献筛选 2名研究者严格按照检索关键词共检索出文献1 037篇,阅读题目和摘要后,通过Endnote软件及手动去除重复文献,严格筛选符合纳入标准及排除标准的文献,最终纳入10篇文献,其中2 篇英文,8 篇中文;共纳入839 例晚期NSCLC脑转移患者,所有患者均接受放疗,其中424例患者接受靶向药物治疗,415 例接受化疗。文献筛选流程及结果见图1。
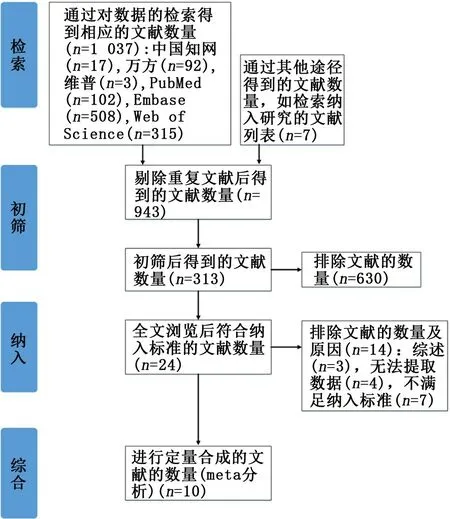
图1 文献筛选流程图
2.2 数据提取及治疗评价 纳入的10项研究其中9项研究对象国籍均为中国,1项为瑞士,纳入研究的基本特征见表1。
2.3 疗效分析
2.3.1 ORR 共有9 篇文献报道了ORR,异质性检验结果显示τ2=0.227 2,P=0.05,I2=48%。试验组的ORR 明显高于对照组,差异有统计 学 意 义 (65.69% 比35.48%,OR=4.19,95%CI:3.07~5.73,P<0.000 1),见图2。
2.3.2 疾病控制率 共有9篇文献报道了DCR,异质性检验结果显示τ2=0,P=0.97,I2=0%。试验组的DCR 明显高于对照组,差异有统计学意义 (85.29% 比69.89%,OR=3.42,95%CI:2.28~5.12,P<0.000 1),见图3。
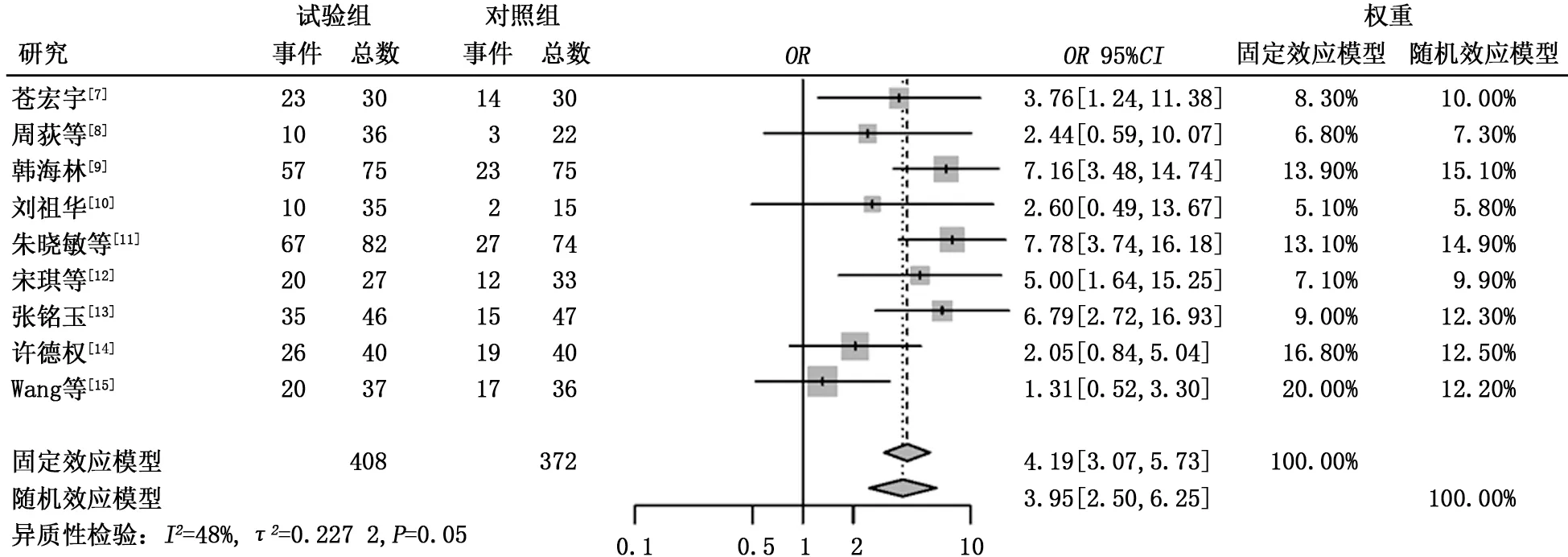
图2 试验组与对照组客观缓解率的比较
2.3.3 1年生存率 共有7篇文献报道了1年生存期,异质性检验结果显示τ2=0.039 5,P=0.33,I2=13%。试验组的1年生存率明显高于对照组,差异有统计学意义 (66.18%比53.87%,OR=1.52,95%CI:1.05~2.19,P=0.026),见图4。
2.3.4 不良反应 (1)骨髓抑制。共有4篇文献报道了治疗后出现了骨髓抑制,异质性检验结果显示τ2=0.423 4,P=0.15,I2=44%。试验组骨髓抑制发生率低于对照组,差异有统计学意义(6.52%比25.42%,OR=0.17,95%CI:0.09~0.35,P<0.000 1),见图5。 (2)消化系统不良反应。共有6篇文献报道了治疗后出现了消化系统的不良反应,包括恶心、呕吐、腹泻,异质性检验结果显示τ2=1.768 4,P<0.01,I2=68%,纳入研究存在中度异质性,故采用随机效应模型进行分析。试验组和对照组消化系统不良反应发生率比较差异无统计学意义(9.13%比17.2%,OR=0.36,95%CI:0.10~1.31,P=0.120 6),见图6。行敏感性分析后与上述结果差异不大,见图7。 (3)皮疹。共有4篇文献报道了患者在治疗后出现了皮疹,异质性检验结果显示τ2=1.308 5,P=0.02,I2=71%,纳入研究存在中度异质性,故采用随机效应模型进行分析。试验组皮疹发生率高于对照组,差异有统计学意义(20.50%比7.34%,OR=4.25,95%CI:1.10~16.49,P=0.036 2),见图8。行敏感性分析后与上述结果差异不大,见图9。(4)肝功能损害。共有4篇文献报道了治疗后出现肝功能损害,异质性检验结果显示τ2=0.250 2,P=0.24,I2=29%。试验组和对照组肝功能损害方面差异无统计学意义 (18.29%比16.57%,OR=0.98,95%CI:0.54~1.75,P=0.937),见图10。

图3 试验组与对照组疾病控制率的比较
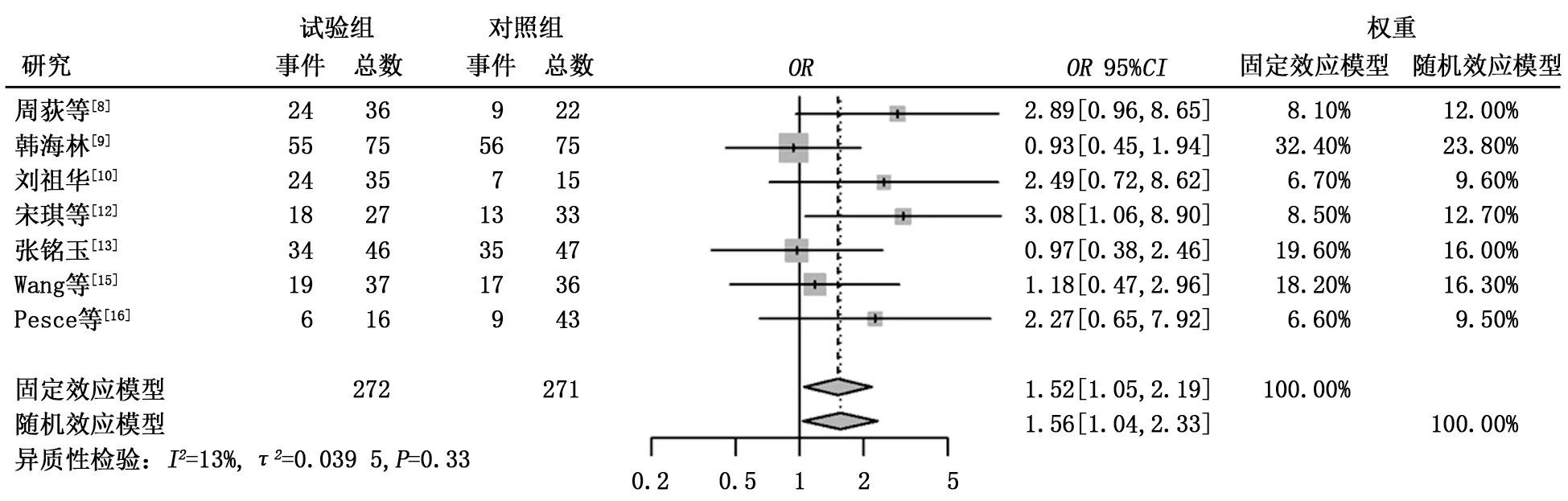
图4 试验组与对照组1年生存率的比较
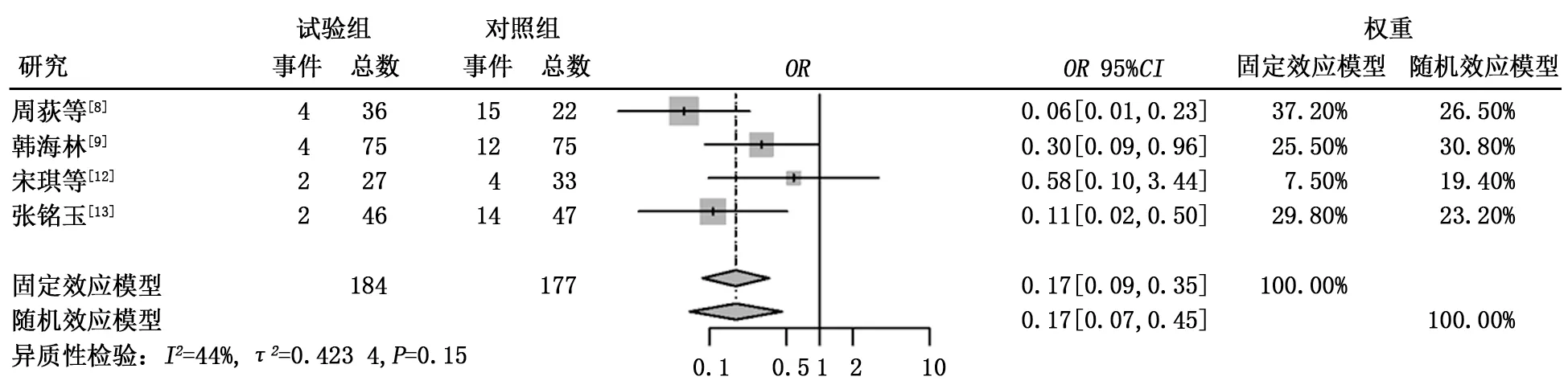
图5 试验组与对照组出现骨髓抑制不良反应的比较
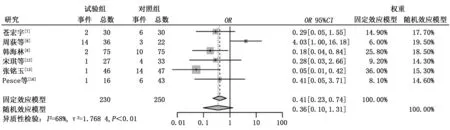
图6 试验组与对照组出现消化系统不良反应的比较
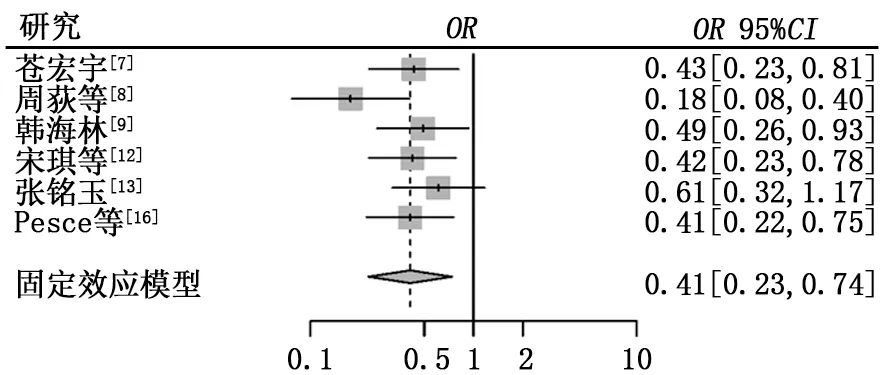
图7 消化系统不良反应敏感性分析
3 讨论
本研究显示纳入的9 项研究中经meta 分析后,试验组的DCR≥50%,平均DCR 为82.1%,对照组中67%患者DCR≥50%。除周荻等[8]、刘祖华[10]的回顾性研究外,其余的几项研究试验组ORR 均大于50%,平均ORR 为58%,对照组平均ORR 为30.8%。试验组1年生存率61.1%,对照组1年生存率45.7%。由此可以认为放疗联合靶向治疗或放疗联合化疗对NSCLC 脑转移患者均具有一定的生存获益及疗效,以上表明,放疗联合靶向治疗在针对NSCLC脑转移灶的治疗上,疗效更占优势。风险比 (hazar d ratio,HR)是meta分析中评价无进展生存期、中位生存期的一个重要指标,因纳入的文献没有明确提示可直接或间接计算HR 的相关数据,并且提供生存分析曲线 (Kaplan曲线)的研究较少,通过曲线图取点计算出的HR值特异性较大,其差异无统计学意义。
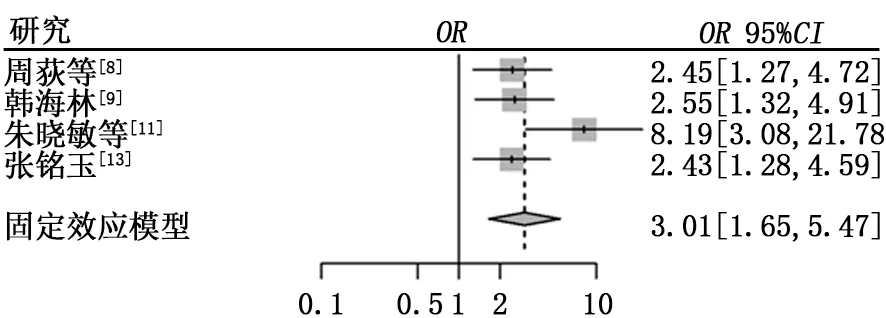
图9 皮疹不良反应敏感性分析
8篇文献中报道了治疗过程中不良反应的发生情况,其中较为常见的不良反应包括骨髓抑制(白细胞减低、血小板减低、血红蛋白减低),颅压升高,消化系统不适 (腹泻、恶心、呕吐),肝功能损害,肾功能损害,神经功能损害,头痛,乏力等。因报道例数较少,部分研究对不良反应描述分级不同,具体实际情况也不同,导致获取数据有限,无法进行其他相关不良反应发生率的meta分析或进一步做亚组分析。本研究在消化系统不良反应及皮疹的发生率上异质性较大,其原因可能是:第一,研究内的变异,不同研究的样本量不同,纳入研究的样本中内的观察单位有可能存在差异,导致可能会得到不同的结果,但实际效应相差可能不会太大,如果样本量较大时所获得抽样误差相比更小;第二,研究对象来自不同的总体,其偏倚的控制在各方面都存在差异,故其实际效应也存在差异。由于本研究纳入的文献较少(少于10篇),检验效能不足,故未绘制漏斗图进行偏倚评价。
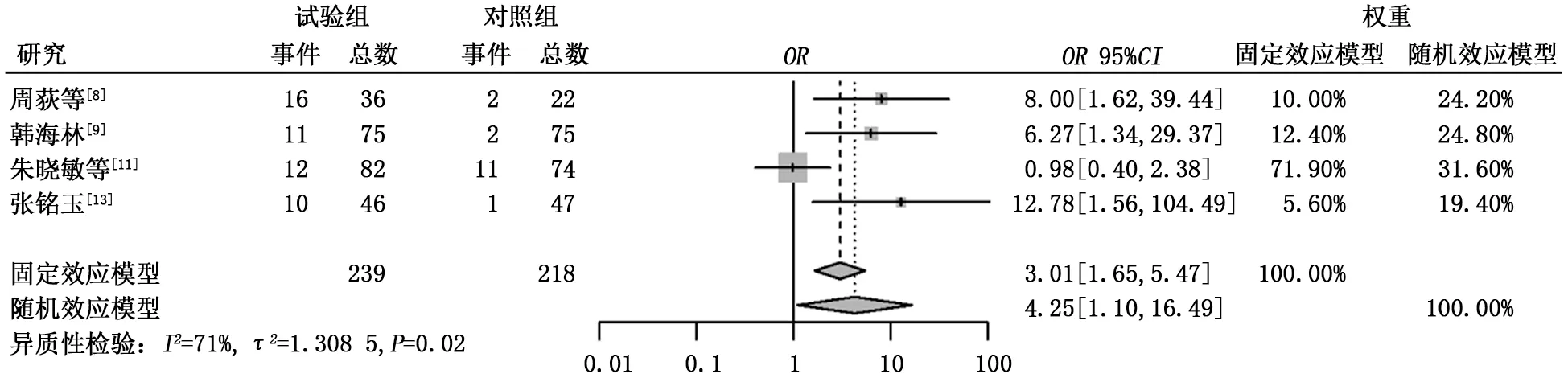
图8 试验组与对照组之间出现皮疹不良反应的比较
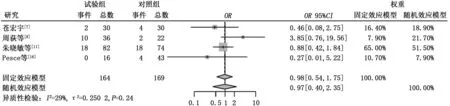
图10 试验组与对照组出现肝功能损害的比较
综上所述,放疗联合靶向治疗NSCLC 脑转移优于放疗联合化疗,能够延缓脑转移病灶的进展,可提高临床疗效、1年生存率,改善预后,并且减少不良反应的发生,对日后临床治疗具有一定指导作用。但研究中仍存在许多不足,由于纳入符合条件的文献较少,并且圴为非随机对照试验,同时患者基线特征和具体的治疗方案、剂量、观察时间可能存在差异,并且患者脑转移灶大小数量、局部病灶缓解还是全身缓解、患者的基因突变情况未明确提及说明,因此出现偏倚的可能性较大。
近年来,随着精准医疗的不断成熟,越来越多的研究表明TKIs 在肺癌脑转移中存在一定疗效[17-18]。需要开展更多的随机对照实验研究或者队列研究进一步证实靶向治疗联合放疗治疗NSCLC脑转移的疗效及安全性。对于NSCLC 脑转移患者究竟选择靶向治疗、全脑放射治疗或者化学治疗方案仍需进一步研究。
利益冲突 所有作者均声明不存在利益冲突

