新型冠状病毒肺炎患者肺泡内渗出液特性对气道开放压力影响的计算模拟
陈正龙 钟鸣 陶嘉乐 吕杰 胡兆燕 张春元 张伟国 陈翠翠 宋元林
1上海健康医学院医疗器械学院201318;2复旦大学附属中山医院重症医学科,上海200032;3复旦大学附属中山医院呼吸与危重症医学科,上海200032;4国家药品监督管理局呼吸麻醉设备重点实验室,上海201318
新型冠状病毒肺炎 (COVID-19)是一种由严重急性呼吸综合征冠状病毒2感染而引起的传染性疾病,目前已成为全球流行的重大公共卫生事件。据WHO 的报道,截至2020年12月15日,全球已有200多个国家和地区累计报告COVID-19确诊患者超过7 000万例,累计死亡超过160 万例[1]。COVID-19患者肺组织穿刺和尸体系统解剖结果表明COVID-19主要累及深部气道和肺泡损伤:肺内支气管黏膜部分上皮脱落,同时支气管腔内见胶冻状黏液附着,小气道内可见大量黏稠的黏液及黏液栓形成;肺泡内充满胶冻样的炎性渗出物,Ⅱ型肺上皮细胞显著增生,部分细胞脱落,少数肺泡过度充气,肺泡隔断裂或囊腔形成[2-4]。这些病理学的变化与COVID-19 患者临床双肺所见磨玻璃密度影、伴肺实变和空气支气管征以及“白肺”等主要的影像学特征相符[5-7]。
大量气道黏液和胶冻状肺泡渗出物的存在,使得气道堵塞和肺泡气体交换功能下降,因此如何清除气道肺泡内液,保持气道通畅,成为当下COVID-19临床机械通气治疗最为迫切的难题。对于COVID-19 患者,在保证气道平台压≤35 c m H2O (1 c m H2O=0.098 k Pa)的情况下[8],能否保证各级气道的开放? 患者气道肺泡内液能否用气管镜吸引出来? 多大的负压可以吸引出来? 这些都是临床医师最为关心的问题。由于现有医学成像设备时空分辨率的局限,我们尚不能原位观察某一吸气压力下小气道或者肺泡实时地开放的动力学,因此我们将借助于气道开放有关的流体力学模型,大致估算正常或者疾病状态下气道衬里液表面张力和粘稠度等流变学参数对气道开启压力的影响,期望为COVID-19 的临床治疗提供理论上的参考。
1 资料与方法
1.1 气道开放的理论模型 健康成人肺通气容积较小时可能出现远端气道的关闭,而气流阻塞性患者在较高的肺容积通气时可能出现气道的关闭。气道关闭两种可能的机制是:半月形气液界面形成和气道顺应性塌陷。一般认为,气道关闭出现在终末细支气管的水平,对正常的肺来说,文献测量表明关闭气道的直径小至0.25 mm,大至2~4 mm[9-11]。
在一系列气道开放有关的流体力学研究中,有学者提出的模型最能代表临床观察到的气道开放过程[12-13]。如图1所示,圆柱形气道一端闭合形成一带状区域,柔性气道壁之间的管腔内充满气道衬里液,充当黏性的胶合剂。管道开口部分的半径为R,关闭部分液体薄膜层的厚度为H。假定气道壁处于松弛的状态,直到气道完全充气后产生轴向张力T 改变气道壁的力学特性 (即横切面积与跨壁压关系)。气道内气体受到正压以后,半月形气液界面以速度U 沿气道前进并打开气道。
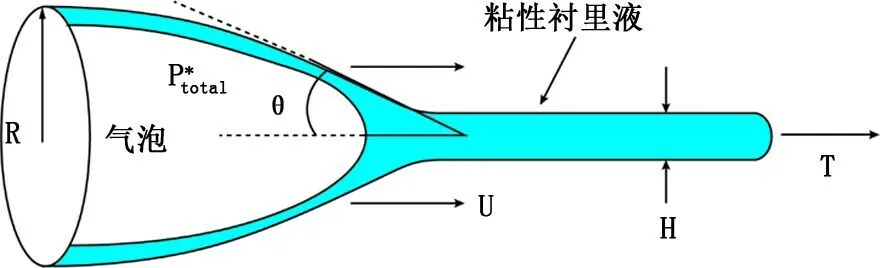
图1 气道开放模型

使用类似于图2所示的气道开放模型,有学者分别研究了牛顿流体衬里液的表面张力和粘度、非牛顿流体衬里液的粘弹性以及非牛顿流体衬里液的剪切稀化效应和屈服应力对气道开放的影响[12-18]。通过在不同的管道直径R 和衬里液膜厚度H 下重复多次气道开放实验,Low 等[17]得到了一组描述气道充气压力与气道开放速度关系的回归公式(表1)。本研究将直接使用表1中的有关公式估计健康或疾病状态下的气道开启压力。
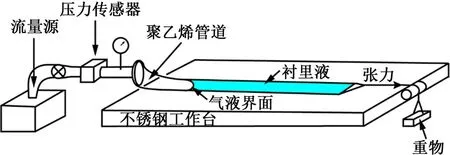
图2 气道开放实验装置示意图
1.2 模型参数 在使用表1中的经验公式大致估算气道开放压力之前,首先需要明确各级气道的几何结构,以及健康或者疾病状态下气道阻塞液的表面张力和流变学参数的大致范围。如1.1所述,实验观察关闭气道的直径约为0.25~4 mm,根据Weibel人肺形态学测量的结果,这一尺寸大约对应于第8 代气道向下直到肺泡的直径。大约从第15代气道开始,气道从单纯的传导功能过渡到具备气体交换功能,气道几何学也不再是严格的管状结构。考虑表1回归公式的适应性,本研究仅估计8~14代传导性气道开放所需要的压力。为了大致估计各级气道的开放速度,设定潮气量VT为400 ml,吸气时间Ti为1 s,当所有气道处于临界开放状态时,根据各级气道的总横截面积可求得各级气道的平均开放速度Un(n=8~14)。
Schürch等[19]用液滴法直接测得了肺泡表面张力值。正常情况下离体大鼠肺容积为总肺容积时,肺泡衬里液表面张力为29.7 dyn/c m;在肺容积为功能残气量时,肺泡衬里液表面张力为7 dyn/c m。由于呼吸窘迫综合征表面活性剂的分泌不足或者功能障碍,有可能导致肺泡衬里液表面张力升高到接近水的表面张力 (72.8 dyn/c m 温度20 ℃),Hsu等[16]测得狗鼻腔分泌物的表面张力约为50 dyn/c m。
本课题组前期研究中测得临床ARDS患者气道衬里液样本的表面张力为13~25.5 dyn/c m (尚未发表的结果)。本次计算取正常气道衬里液表面张力为γ=25 dyn/c m,疾病状态升高到γ=50 dyn/c m。
文献测得气道黏液在非常低的剪切速率下表观粘度为200~1 000 P (P:泊,动力粘度单位,1 P=0.1 Pa·s),而在高剪切速率下降至1~10 P;屈服应力约为550 dyn/c m2,表面张力为60~120 dyn/c m[20]。本课题组前期研究中测得临床ARDS 患者气道衬里液样本的粘度为0.01~780 P[21]。同时,由于COVID-19患者下气道黏液显著性增多的特点,计算假定气道内衬里液膜厚度H 为正常值的1~5倍,即H=10~50μm。
1.3 模拟气道阻塞液 基于1.2,假定模拟牛顿流体衬里液的粘度为:健康状态μ=0.01 P;疾病状态下粘度升高1~3 个数量级,即μ=0.1、1、10 P。同时考虑以下2 种模拟非牛顿流体衬里液[18]。第一,假塑性流体 (羧甲基纤维素钠和聚氧化乙烯)。这类流体最明显的特点是其表观粘度随剪切速率 (˙γ)或剪切应力 (τ)的增加而减小,称为剪切稀化现象。假塑性流体的本构方程通常用幂率模型表示:τ=m˙γn,m 为黏稠度指数,n(<1)为幂率指数。m 越大,流体黏性越高;n越小,剪切稀化效应越明显。第二,屈服假塑性流体 (酥油、润滑油、花生酱和蛋黄酱)。这类流体当外加的剪切应力小于某一定值(屈服应力)时,剪切速率为0;当剪切应力大于屈服应力时,流体从静止开始运动,并呈现与假塑性流体类似的性质。其本构方程常用Herschel-Buckley模型描述:τ-τy=m˙γn,这一流动方程除了包含屈服应力τy以外,在形式上与幂率方程非常相似。模拟气道衬里液特性如表2所示,其屈服应力τy为164~600 dyn/c m2,表面张 力 为25 ~70 dyn/c m, 粘 稠 度 为3.7 ~255 (dyn/c m2)·sn,与文献报道的正常或者疾病状态人类气道衬里液流变学参数范围具有很好的可比性[18-20]。

表1 不同气道衬里液时无量纲压力-速度关系[17]
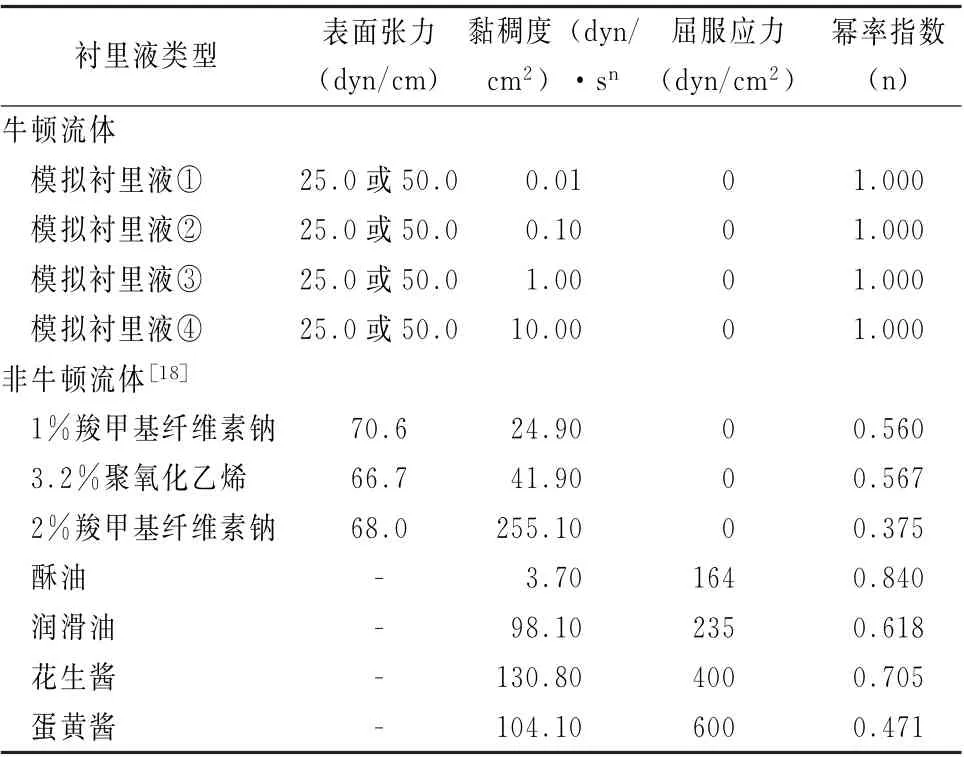
表2 模拟气道衬里液表面张力和流变学参数a
2 结果
2.1 牛顿流体型气道衬里液 图3和图4表示气道衬里液为牛顿流体时,粘度和表面张力的变化对气道开放压力的影响。由图3可以看出,当气道衬里液表面张力和粘度取正常值时 (γ=25 dyn/c m,μ=0.01 P),对应8~14级气道的临界开启压力为2.1~3.8 c m H2O,小于ARDSnet小潮气量通气协议推荐的最小呼气末正压值5 c mH2O[22]。其次,随着表面张力或者粘度的升高,各级气道开启压力也逐渐升高,特别地,倘若疾病状态下气道衬里液表面张力保持不变,粘度升高到10 P 时 (类似于药用甘油25℃时的粘度),对应8级气道的开启压力将升高到36 c m H2O,如果表面张力也同时增加到50 dyn/c m,则对应8~14级气道的开启压力均超过35 c m H2O,最高开启压力可达41.8 c mH2O (第8级气道)。
2.2 假塑性非牛顿流体气道衬里液 图5和图6表示假塑性非牛顿流体气道衬里液表面张力和流变学特性对气道开启压力的影响。注意到3种衬里液的表面张力相当(约60~70 dyn/c m),尽管2%羧甲基纤维素钠的黏稠度 (255.1 dyn/c m2·sn)数值上约为3.2%聚氧化乙烯 (41.9 dyn/c m2·sn)的6倍、1%羧甲基纤维素钠 (24.9 dyn/c m2·sn)的10倍,但由于强烈的剪切稀化效应 (幂率指数n=0.375),使得其对应的各级气道开启压力并没有明显地高于其他两种衬里液填充下的气道开启压力。其次,仔细比较模拟衬里液④ (图4)与2%羧甲基纤维素钠 (图5),发现尽管后者表面张力和黏稠度均大于前者 (表面张力50 dyn/c m比68 dyn/c m; 黏 稠 度 10 dyn/c m2·sn比255.1 dyn/c m2·sn),但后者对应的各级气道开启压力 (均不超过10 c m H2O)却明显地低于前者(均大于35 c m H2O),进一步证明了假塑性非牛顿流体存在的剪切稀化效应使得气道开启压力减小。最后,比较图5与图6可知,气道开启压力随假塑性非牛顿流体衬里液膜厚度H 的增加而升高。
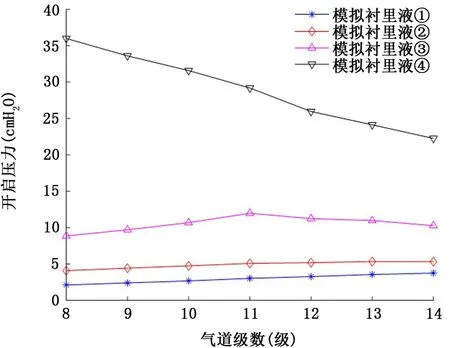
图3 健康状态牛顿流体衬里液表面张力和不同粘度对8~14级气道开启压力的影响
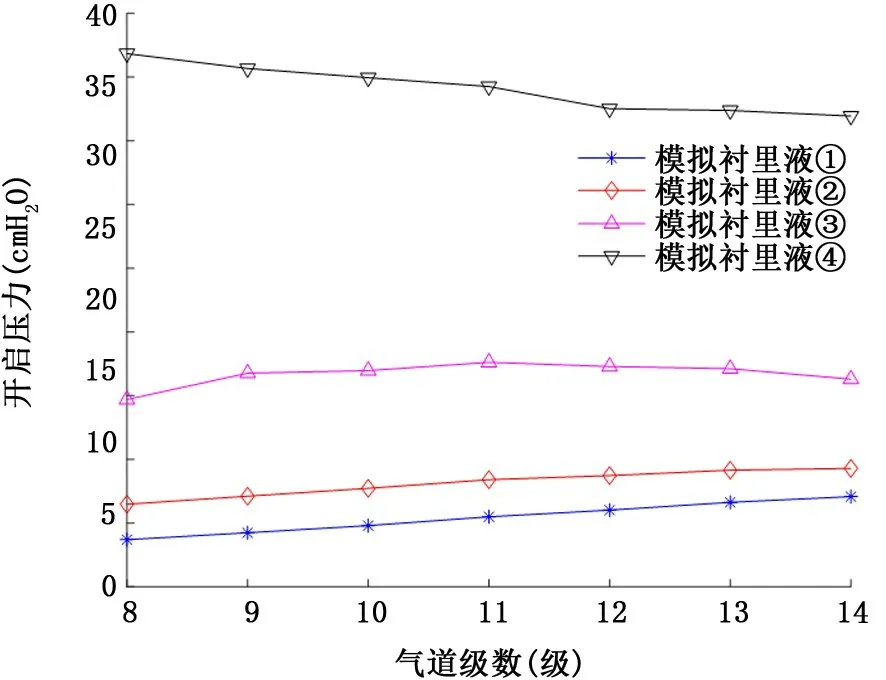
图4 疾病状态牛顿流体衬里液表面张力和不同粘度对8~14级气道开启压力的影响
2.3 屈服假塑性非牛顿流体气道衬里液 具有屈服应力的假塑性非牛顿流体衬里液流变学特性对气道开启压力的影响如图7和图8所示。首先类似假塑性流体,气道开启压力随着屈服假塑性流体衬里液膜厚度的增加而增加。其次当气道为相对低黏稠度的衬里液酥油 (n=3.7 dyn/c m2·sn)或者剪切稀化效应强烈的蛋黄酱 (幂率指数n=0.471)所填充时,对应各级气道的开启压力相对较低:衬里液膜厚度H=10μm 时,开启压力均不超过5 c m H2O (图7);即使衬里液膜厚度增加到H=50μm,各级开启压力也不超过6.5 c m H2O (图8)。但是当流变学特性类似花生酱 (黏稠度n=130.8 dyn/c m2·sn,屈服应力τy=400 dyn/c m2,幂率指数n=0.705)的衬里液填充气道时,气道开启压力依衬里液膜厚度的不同,开启压力可高达30.1 c m H2O (图7)甚至48.9 c m H2O (图8)。
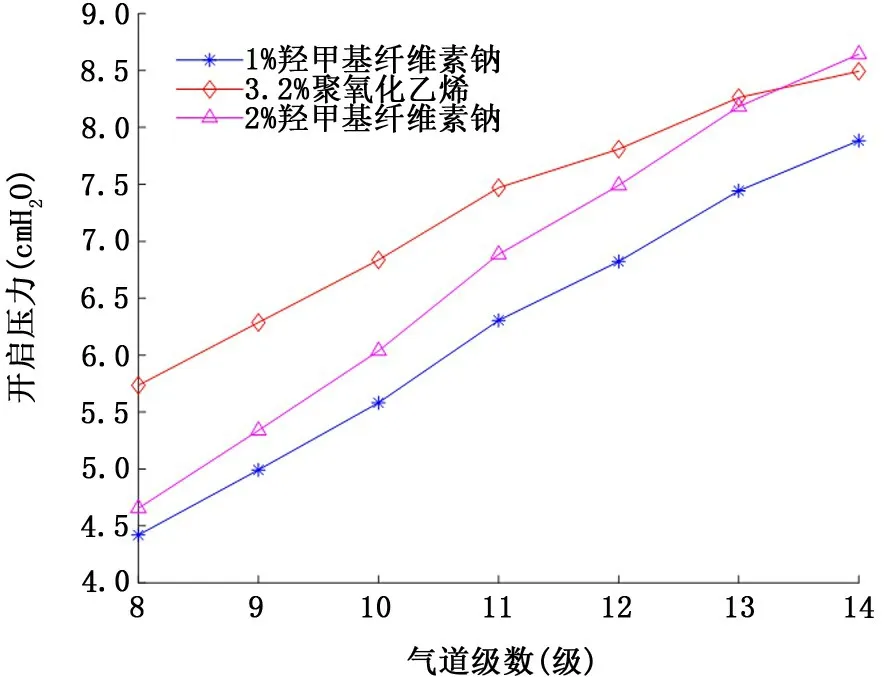
图5 假塑性非牛顿流体衬里液表面张力和流变学特性对8~14级气道开启压力的影响 (衬里液膜厚度H=10μm)
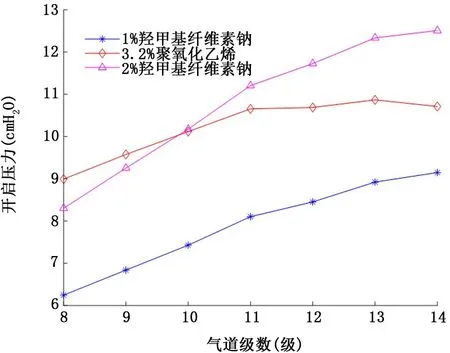
图6 假塑性非牛顿流体衬里液表面张力和流变学特性对8~14级气道开启压力的影响 (衬里液膜厚度H=50μm)
3 讨论
基于人类肺结构的Weibel模型和气道开放的流体动力学研究,本文从理论上估算了不同气道阻塞液表面张力和流变学参数下,打开8~14级气道大致所需要的压力幅值。结果表明气道的临界开放压力与气道内衬里液的表面张力、粘稠度、屈服应力、衬里液膜厚度以及气道半径和气道开启速度有关。在健康状态,衬里液表面张力为肺表面活性物质平衡表面张力值约25 dyn/c m,粘度为0.01 P,对应8~14 级气道的开启压力大约在2.1~3.8 c mH2O;但是,当疾病状态下衬里液粘度升高3个数量级到10 P左右,类似于医用甘油的粘度时,预测的气道开启压力可高达35 ~42 c m H2O,如果气道被流变学特性类似花生酱样的屈服性非牛顿流体所填充,则气道开启压力可高达30~49 c m H2O。因此,对于一部分COVID-19重症患者,肺保护性机械通气下的低气道平台压力(≤35 c m H2O)可能不足以保证气道的完全开放,低血氧症得不到改善,机械通气失去其应有的作用。3.1 计算模型的有效性 首先是模拟气道阻塞液表面张力和流变学参数的生理相关性。计算使用模拟气道衬里液参数基于文献对慢性支气管炎、支气管扩张、肺炎、囊性纤维化以及ARDS 患者气道衬里液粘度和表面张力的测量结果,尽管目前尚无COVID-19患者肺泡内渗出液或者气道衬里液黏稠度和表面张力的直接测量,但是考虑到COVID-19重症患者可能发展为ARDS[23-24],同时COVID-19本质上是病毒感染引起肺部炎症,因此这些疾病在气道黏液或者肺泡渗出液的组成上应该具有很大程度上的类似性,主要包括黏液素、血浆蛋白、炎症细胞、DNA、细菌和病毒等[25],故推测COVID-19患者肺内液粘度和表面张力值应该落在本文所讨论的范围之内。
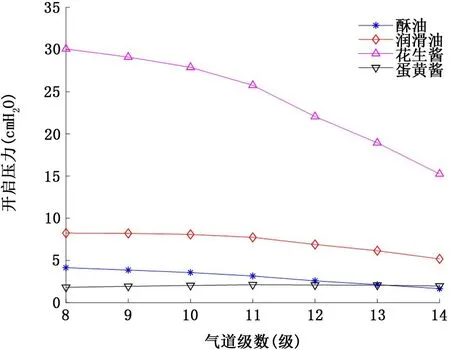
图7 屈服假塑性非牛顿流体衬里液流变学特性对8~14级气道开启压力的影响 (衬里液膜厚度H=10μm)
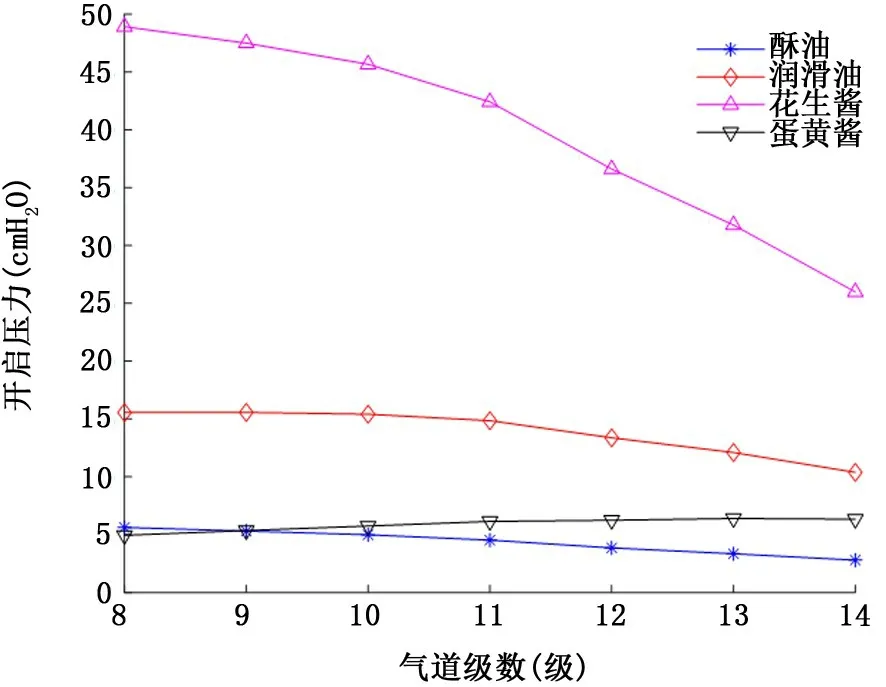
图8 屈服假塑性非牛顿流体衬里液流变学特性对8~14级气道开启压力的影响 (衬里液膜厚度H=50μm)
Mackle m 等[18]研究发现,当气道内衬有表面活性物质时,直径0.5 mm 气道的开启压力为5~9 c m H2O,如果假定平衡表面张力为γ=25 dyn/c m,那么这一压力对应为5~9γ/R,与表1中公式 (2a)毛细压力P*cap≈4.39γ/R 基本一致,利用公式 (2a),计算得到直径0.5 mm 的气道对应的开启压力约为5.6 c m H2O。Cr otti等[26]研究了5例临床急性肺损伤或ARDS患者的开肺压力,发现在3例患者当中,出现频率最高的临界开肺压力在20 c m H2O附近;在另外2例患者中,出现频率最高的临界开肺压力为30~35 c m H2O。我们在COVID-19患者的临床诊疗中也发现,尽管使用30 c m H2O的平台压,许多重症患者的血氧饱和度依然没有改善。这些研究数据与临床发现证明了当前计算模型的合理性。
3.2 吸痰压力的估算 目前常用的支气管纤维镜尖端部直径一般为3.5~5 mm,工作长度为550~600 mm,最多可嵌入4~5级节段性支气管。行支气管纤维镜吸痰操作时,单次吸痰的时间不超过15 s,吸引负压一般为7~10 k Pa,最高不超过13 k Pa[27]。为了简单起见,本研究仅估算支气管纤维镜吸痰时的沿程压力损失。假定支气管纤维镜的工作长度为600 mm,为了保证痰液在15 s以内吸出,痰液运动速度(U)至少大于4 c m/s。对于直径为5 mm的支气管纤维镜,钳孔直径 (d)为2 mm,对应0.2 ml痰液柱的长度 (L)为6.4 c m,那么吸痰负压的沿程损失ΔP 可由下式计算ΔP=32μLU/d2(5)。示中μ表示痰液的粘度。代入相关的数值,可得不同痰液粘度对应的沿程压力损失(表3)。可以看出,当痰液的粘度较低 (类似纯水20.2 ℃的粘度值<0.01 P)时,压力损失也较小(ΔP=0.02 k Pa);当抽吸类似高脂肪含量的奶油样痰液时,压力损失已经不能忽略 (ΔP=2.04 k Pa);当抽吸类似药用甘油样 (25 ℃时粘度<10 P)的痰液时,压力损失ΔP=20.37 k Pa,高于临床常规吸痰操作允许的最高压力13 k Pa。这表明当痰液粘度升高到类似药用甘油的表观粘度值时,常规的支气管纤维镜不仅很难将患者气道内的痰液吸出,而且高吸痰负压可能进一步引起远端气道的塌陷。
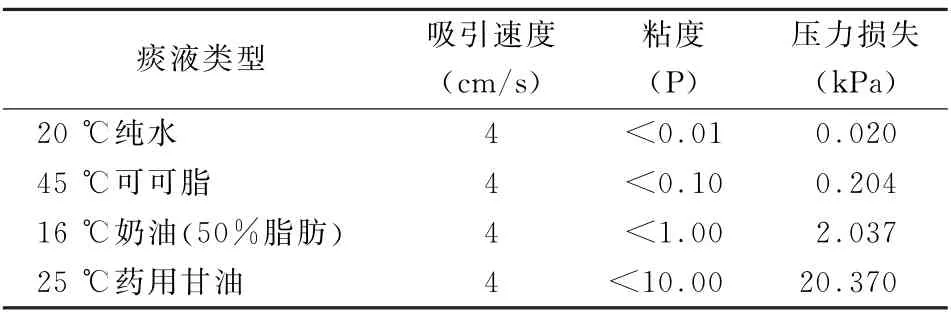
表3 支气管纤维镜吸引不同类型痰液的沿程压力损失
3.3 局限性 当前的研究存在以下几方面的局限性。第一,剪切应变率的估计可能和真实的气道开放有所出入,进一步影响到公式2~4 中 (表1)气道开放速度的准确性。体外模型实验表明这一剪切应变率与衬里液流体类型、流体厚度和气道半径有关。第二,由于实验仪器的限制,现阶段我们无法对COVID-19 患者肺泡渗出液和气道黏液的表面张力和粘度进行在体的测量。同时由于样本难以获得,甚至连体外测量的数据都未见报道。第三,在估计各级气道的临界开放速度时,考虑肺各向同性,所有的气道处于临界开放的状态,COVID-9患者肺应该是高度异质性的,因此各级气道开启的时间和速度必定存在差异,但这并不影响我们对最高气道开启压力的估计。因为在各向异质性的情况下,各级气道的开启速度更高,所以当前的气道开启压力估计值是比较保守的。最后,在吸痰负压的估计中,我们仅考虑非常少量的痰液(0.2 ml)在支气管纤维镜内的压力损失,实际上从最终末的气道(肺泡)到第5级气道的压力损失更大,一方面这些气道的直径相对更小,另一方面肺泡到第5级气道的长度可达到5.5 c m 左右。综合考虑,我们实际上极大地低估了吸痰沿程的压力损失。另外,值得注意的是,吸痰的气道几何学与气液界面驱动气道开放的几何学存在根本的不同,因此公式2~4不能用于估计吸痰所需克服的毛细压力和黏性压力。
鉴于COVID-19 晚期下气道黏稠分泌物增多这一病理特点,当前COVID-19 患者,尤其是重症患者的机械通气治疗面临两个迫切需要回答的问题,第一是肺保护性通气策略规定的最高不超过35 c m H2O的吸气平台压能否有效地开肺[8,22]。当前的理论计算表明,当痰液具有类似药用甘油的粘度时,8~14级传导性小气道的开肺压力可升高至40 c m H2O 以上;当痰液为类似花生酱样的非牛顿流体时,开肺压力可进一步升高至48 c m H2O 以上。因此至少在相当一部分COVID-19 患者中,35 c m H2O 的吸气平台压不能有效和充分地开启各级气道,机械通气失去应用的作用。这些理论计算进一步解释了我们在COVID-19 的临床治疗中观察到的现象,COVID-19患者偶尔进食、排便或者屏气等日常动作后突然的窒息死亡:患者胸腔内压的升高使跨肺压力减小,而正常人自主呼吸时所能达到的最大胸腔内负压值约为20 c m H2O,高粘度的气道肺泡黏液使得患者无法自主开肺,最终像溺水一样窒息死亡。但是正如最新版诊疗方案中COVID-19的病理学描述[8],过高的吸气压力将造成肺泡上皮细胞的脱落甚至肺泡隔的拉断,因此临床需要回答的第二个问题是:是否有可能把远端气道的黏液抽吸出来? 如果可以的话,需要多大的负压? 当前的研究数据肯定地表明:如果肺泡气道内充满的黏液粘度升高到10 P左右的数量级,具有类似于药用甘油常温下的粘度时,使用支气管纤维镜在常规的吸痰负压7~13 k Pa下,根本无法把深部气道的黏液吸引出来。提示COVID-19 吸痰操作前,可以考虑先用生理盐水对痰液进行稀释,或者使用有效的化痰药物溶栓,降低黏液的粘度。在之后的机械通气治疗当中,可根据吸出痰液的表观粘度,来设定个性化的吸气平台压或者呼吸末正压。对于黏液表观粘度过高的患者,因地制宜地考虑肺复张或者体外膜肺氧合等治疗手段。
利益冲突 所有作者均声明不存在利益冲突

