慢加急性肝衰竭小鼠肝组织组蛋白去乙酰化酶mRNA水平变化*
林列坤,卢春生,周应生,郑 义,杨菊红,邹继彬,张仁超,梁旭竞
组蛋白去乙酰化酶(histone deacetylase,HDAC)是机体组蛋白乙酰化调节的重要组成部分,乙酰化修饰是目前抗炎治疗研究的新方向[1-3]。HDAC抑制剂被广泛应用于抗炎治疗[4-7]。本文采用D-氨基半乳糖(D-Gal)和脂多糖(LPS)联合诱导建立小鼠慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)模型[8],观察了HDAC抑制剂干预对小鼠肝组织HDAC mRNA水平的影响,以探讨HDAC在ACLF发病过程中的作用,现报道如下。
1 材料与方法
1.1 动物、试剂、仪器与引物 4周龄SPF级雄性BALB/c小鼠28只,由武汉云克隆动物有限公司提供【动物生产许可证:SCXK(鄂)2015-0091,动物质量合格证编号:42816300001640】,适应性饲养1 w。遵循3R原则使用动物,并经过动物伦理委员会(IACUC)审核批准(编号为:IACU18-0077); 检测血生化试剂由南京建成生物公司提供;美国Thermo提供RevertAid First Strand cDNA Synthesis Kit为#K1622(第一链cDNA合成试剂),Roche提供FastStart Universal SYBR Green Master为04913914001(qPCR 染料)及其他一些提取RNA和RNA转录试剂;美国Omni 牌Bead Ruptor 12多样品研磨珠均质仪;北京DragonLab D3024R台式高速冷冻微量离心机;美国ABI 7300荧光定量PCR仪。病理学检测仪器由浙江省金华市科迪仪器设备有限公司提供;qPCR各种引物名称及其序列见表1。
1.2 动物模型的建立 随机将动物分为7组,每组4只。A组:对照组;B组:模型组;C组:曲古抑菌素 A(trichostatin A,TSA)处理组(0.5 mg.kg-1);D组:大剂量正丁酸钠处理组(2000 mg.kg-1);E组:小剂量正丁酸钠处理组(500 mg.kg-1);F组:大剂量NF-κB抑制剂吡咯烷二硫代氨基甲酸(pyrrolidine dithiocarbarmate, PDTC)处理组(200 mg.kg-1);G组:小剂量PDTC处理组(50 mg.kg-1)。除A组外,给予其他组小鼠20%CCL4油溶液5 ml.kg-1腹腔注射,2次/w,连续注射12 w,构建慢性肝功能受损小鼠模型。在12 w末,给予不同药物处理组小鼠药物经尾静脉注射,给予A组和B组注射等体积的生理盐水。在药物干预3 d后,给予D-Gal 1 g.kg-1和LPS 10 μg.kg-1腹腔注射,诱发急性肝衰竭,完成构建ACLF小鼠模型。给予各组模型小鼠戊巴比妥注射麻醉,无菌取血和肝脏。取肝组织,经固定、脱水、包埋后,制作石蜡切片,HE染色,显微镜下观察。
1.3 肝组织HDAC mRNA水平检测 采用荧光定量PCR法,取肝组织100 mg,在匀浆器中研磨,得到RNA,加入无RNA酶水15μl溶解RNA,使其终浓度为200 ng/μl。加入RNA溶液2 μg,反转录,获取cDNA。取0.2 ml PCR管,配制如下反应体系,每个反转录产物配制3管: 2× qPCR Mix 12.5μl,7.5μM基因引物2.0μl,反转录产物2.5μl, ddH2O 8.0μl。95℃,10 min;95℃,15 s,60℃,60 s,循环40次;再75℃~95℃,每20 s升温1℃。以ΔΔCT法:A=CT(目的基因,待测样本)- CT(内标基因,待测样本),B=CT(目的基因,对照样本)- CT(内标基因,对照样本), K=A-B ,表达倍数=2-K。

表1 qPCR各种引物名称及其序列
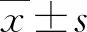
2 结果
2.1 各组小鼠血清AST、ALT和TBIL水平比较 B组血清AST、ALT和TBIL水平显著高于A组(P<0.05),不同HDAC抑制剂干预组血清AST、ALT和TBIL水平显著低于B组(P<0.05,表2)。
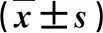
表2 各组小鼠血生化比较
2.2 各组小鼠肝组织病理学表现 A组肝小叶结构清晰,肝细胞呈条索状排列,细胞无肿胀,汇管区无炎细胞浸润;B组表现为肝细胞体积增大,呈弥漫性浊肿,汇管区见融合性坏死,小叶周边充血和炎细胞浸润;C组/D组/E组/F组/G组:肝细胞体积稍增大,轻度浊肿,汇管区见片状或碎片状坏死,少量炎细胞浸润(图1)。
2.3 各组小鼠肝组织Ⅰ类HDAC mRNA水平变化 四种HDAC水平一致,B组较A组显著上升,而C、D、E、F和G组较B组显著下降,差异具有统计学意义(P<0.05,表3)。
2.4 各组小鼠肝脏组织Ⅱ类HDAC mRNA扩增倍数 除DHAC4和DHAC10外,其他四种HDAC表现一致,B组较A组显著上升, C、D、E、F、G组比B组明显下降,差异具有统计学意义(P<0.05,表4)。

图1 各组小鼠肝组织病理学表现(HE,200×)
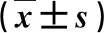
表3 各组小鼠肝组织Ⅰ类HDAC mRNA水平比较
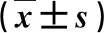
表4 各组小鼠肝组织Ⅱ类HDAC mRNA水平比较
3 讨论
HDAC是机体组蛋白乙酰化水平调节的两大组成之一,它与组蛋白乙酰化酶(histone acetyltransferase,HAT)蛋白结构和酶活性保持高度的平衡[9-11], 称为“乙酰化动态平衡”,对于维持细胞内稳态和平衡有重要的作用[12-15]。文献报道,在疾病发生时,组蛋白乙酰化平衡被打破,HDAC活性或含量升高[16]。本课题按实验设计建立小鼠慢性肝损伤模型,然后给予不同剂量的HDAC抑制剂作为乙酰化调控药物干预模型小鼠,再建立小鼠ACLF模型[8]。检测小鼠肝脏组织Ⅰ类和Ⅱ类HDAC mRNA水平,从而明确HDAC在肝衰竭乙酰化调控过程中的作用。HDACs共有18个成员,包括两大家族,可分为四类[17]。本课题以常见的Ⅰ类和Ⅱ类HDAC为研究内容。
本研究证明HDAC抑制剂的应用保护了肝衰竭动物,改善了肝组织学损伤[18],再次印证了乙酰化调控能有效保护肝衰竭。急性肝衰竭动物肝组织HDAC mRNA水平显著上升,在乙酰化干预后,各干预组肝组织HDAC mRNA水平显著性下降,与相关研究结论一致。
HDAC代表机体去乙酰化作用。肝衰竭时肝组织HDAC表达上升,机体去乙酰化作用增强。如果乙酰化调控平衡被破坏,使用HDAC抑制剂干预后,肝组织HDAC表达大幅度下降,机体去乙酰化作用减弱,乙酰化作用增强,被破坏失衡的乙酰化动态平衡被调控,再次趋向平衡,这个过程能有效保护肝衰竭动物。由此可见,HDACs对ACLF有促进作用,而HDAC抑制剂对ACLF则具有保护作用。HDAC mRNA是应用乙酰化调节治疗肝衰竭时HDAC转化表达的重要指标,代表肝脏的去乙酰化作用,HDAC mRNA水平越低,表示HDAC表达越低,提示乙酰化调节干预肝衰竭越有效。
从实验结果可见,虽然肝衰竭动物肝组织Ⅰ类和Ⅱ类HDAC mRNA变化明显,但也不是所有的HDAC mRNA均参与了肝脏的乙酰化调控。在Ⅱ类HDAC中,HDAC4和HDAC10 mRNA水平在干预前后改变不明显,可能意味着其在肝脏乙酰化调控中作用不大。所以,我们可以发现,不是所有的Ⅰ类和Ⅱ类HDAC都参与了肝脏的乙酰化调控,各种HDAC的具体功能还有待进一步细化。在本实验D组较E组或F组较G组均使用种类相同而大剂量的HDAC抑制剂,但HDAC mRNA水平未见明显变化。我们认为肝脏启动乙酰化调控是一种特殊的模式,与外加干预的抑制剂种类有关,而与抑制剂的浓度关系不大。
在真核细胞中,乙酰化修饰是最常见的共价修饰,其作用谱广泛,在细胞内发挥重要的修饰作用,目前应用最广泛的为抗炎治疗的应用。本研究应用乙酰化调控干预肝衰竭动物,就是其抗炎功效发挥了作用。HDAC mRNA是乙酰化修饰的负相关指标,在肝衰竭干预治疗过程需要增强机体的乙酰化作用,减弱去乙酰化作用,从而促进肝衰竭病情的缓解[6]。乙酰化调控在肝脏衰竭干预过程中的作用日渐明显,首先通过乙酰化调控降低HDAC mRNA在靶向器官中的表达。在干预肝组织炎症,促进肝脏功能恢复和诱导肝衰竭病情好转方面发挥作用。本研究进一步佐证了控制肝脏的炎症反应能阻断肝衰竭进展。定量检测受损器官HDAC mRNA扩增水平是监测机体乙酰化程度重要的组分。

