禽腺病毒4型ZZ株的致病性研究
金前跃,王寅彪,柴永笑,卢清侠,郭振华,罗俊,邢广旭,邓瑞广,张改平,6
(1. 河南省农业科学院/动物免疫学重点实验室,河南 郑州 450002;2. 河南省农业科学院/中英禽病国际研究中心,河南 郑州 450002;3. 江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009;4. 新乡医学院公共卫生学院,河南 新乡 453003;5. 西北农林科技大学动物医学院,陕西 杨凌 712100;6. 河南农业大学牧医工程学院,河南 郑州 450002)
禽腺病毒(fowl adenovirus,FAdV)属于腺病毒科(Adenoviridae)禽腺病毒属(Aviadenovirus),是感染家禽和野禽的常见病原,一般仅造成轻微症状,致病性较强的FAdVs可引起鸡包涵体肝炎(inclusion body hepatitis,IBH)、肌胃糜烂(gizzard erosions,GE)和心包积液综合征(hydropericardium syndrome,HPS)等[1-2]。FAdV病毒粒子呈球形,直径70~90 nm,是一种无囊膜双股线性DNA病毒,基因组全长在40~46 kb,基于全基因组的限制性片段长度多态性分析及交叉中和试验分别可将FAdVs分为A、B、C、D、E 5个种,12个血清型(1~8a,8b~11)[1]。其中,A种包括FAdV-1型,B种包括FAdV-5型,C种包括FAdV-4型和FAdV-10型,D种包括FAdV-2、FAdV-3、FAdV-9、FAdV-11型,E种包括FAdV-6、FAdV-7、FAdV-8a、FAdV-8b型。FAdV编码的主要结构蛋白包括六邻体蛋白(hexon)、五邻体蛋白(penton)以及纤维蛋白(fiber)。Hexon蛋白是病毒表面含量最高的蛋白,能够诱导中和抗体产生[3-4]。基于hexon基因序列的系统进化分析常被用于FAdVs的血清型分型,这是因为要获得所有血清型FAdV病毒的阳性血清比较困难,交叉中和试验不能被广泛应用[5]。Penton蛋白在病毒入侵细胞过程中发挥重要作用,也能诱导中和抗体产生[6-7]。Fiber蛋白与penton蛋白非共价相连,是介导病毒与宿主细胞表面受体结合的蛋白,能够诱导保护性免疫应答产生,并与病毒的组织嗜性和毒力密切相关[8]。FAdV的血清A型和C型可编码2个fiber蛋白,而血清B型、D型和E型仅编码1个fiber蛋白[9]。
2014年以来,FAdV感染引起的IBH和HPS病例在国内鸡群中不断出现且呈逐渐增加的趋势,对养禽业造成了巨大影响[10-11]。流行病学调查发现,国内目前存在着FAdV-C、FAdV-D、FAdV-E感染,分布在肉鸡、蛋鸡、鸭、鹅、鸵鸟等禽类群体中[5, 12]。河南的HPS病例于2015年出现在豫东地区的肉鸡群中,目前全省大多数地区均有发生,死亡率达30%~80%[13-14]。在FAdVs的12个血清型中,FAdV-4型是引起HPS的主要病原体[15]。本实验室在2016年从新郑某鸡场采集的HPS病鸡样品中分离获得了1株禽腺病毒血清4型病毒株,命名为FAdV-4 ZZ株。与无毒力的FAdV-4 ON1和FAdV-4 KR5株相比,FAdV-4 ZZ株存在ORF19、ORF27和ORF30基因缺失。与国内最早分离的FAdV-4 JSJ13株相比,FAdV-4 ZZ的ORF29序列存在33 nt核苷酸缺失[11]。FAdV-4 ZZ株的hexon基因与ON1和KR5的hexon基因核苷酸序列相似性分别为98.69%和98.90%;penton基因与ON1和KR5的penton基因核苷酸序列相似性分别为98.99%和98.86%;fiber1基因与ON1和KR5的fiber1基因核苷酸序列相似性分别为95.93%和96.86%;fiber2基因与ON1和KR5的fiber2基因核苷酸序列相似性分别为95.85%和95.90%。这些变异可能说明病毒在进一步适应宿主,但尚不清楚它们对FAdV-4病毒复制、毒力及细胞嗜性的影响。
本研究利用FAdV-4 ZZ病毒株感染SPF鸡,对感染后鸡的临床症状、存活率、组织病理学变化、病毒的组织分布情况进行了分析,确定了该毒株的致病性,为探索其致病机制并有效防控HPS病例的发生奠定基础。
1 材料与方法
1.1 主要材料
18日龄的无特定病原体(SPF)鸡购自北京梅里亚维通实验动物中心,鸡肝癌细胞系(LMH)、标准质粒(pEASY-Blunt-Hexon)由本实验室保存。FAdV-4 ZZ株分离于河南郑州(新郑)某鸡场,利用LMH细胞稳定传代后保存于实验室。
1.2 主要试剂
FastStart Universal SYBR Green Master(ROX)购自Roche公司;病毒基因组提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、PremixExTaqDNA聚合酶、DL2000 DNA Marker购自TaKaRa公司;DME/F12培养基购自HyClone公司;组织细胞固定液、青链霉素混合液和胰蛋白酶购自Solarbio公司;胎牛血清购自Gibco公司;0.22 μm滤器购自Merck Millipore公司;QIAamp 96 DNA QIAcube HT Kit购自德国QIAGEN公司。
1.3 病毒的增殖培养
待细胞瓶中的LMH细胞生长至约80%时,弃去培养基并用无菌磷酸盐缓冲液(PBS)清洗3次,之后接种FAdV-4 ZZ株病毒,在37 ℃、5% CO2的培养箱中培养1.5 h。然后弃去病毒液,加入含2%胎牛血清的DME/F12培养基继续培养72 h。-80 ℃与室温间反复冻融后,2 000 r/min离心15 min,收集病毒液。过滤后,再次接种于LMH细胞进行传代,以扩增病毒。
1.4 病毒的半数感染剂量测定
待96孔细胞培养板中的LMH细胞生长至约80%时,弃去培养基,PBS洗涤3次,向各列细胞孔中加入100 μL按10-1~10-10连续10倍倍比稀释的病毒液,孵育1.5 h后弃去病毒液,加入含2%胎牛血清的DME/F12培养基,最后2列细胞孔留作阴性对照,于含5% CO2的37 ℃培养箱中培养96 h,记录各稀释度细胞病变孔数,使用Reed-Muench法计算FAdV-4病毒的半数感染剂量(TCID50)。
1.5 病毒致病性试验
将SPF鸡只随机分为病毒感染组和PBS对照组,每组各10只。通过肌肉注射给感染组SPF鸡注射100 μL的FAdV-4 ZZ株病毒(105.0TCID50/0.1 mL),PBS对照组以相同方式每只接种100 μL无菌PBS。每日观察鸡的临床症状,剖检死亡鸡,记录病理变化并采集内脏器官。从组织样品中提取病毒DNA进行荧光定量PCR检测以确定感染后病毒的组织分布情况;同时采集感染组病死鸡和对照组鸡的心、肝、脾、肺、肾、腺胃、十二指肠、法氏囊等组织制作病理切片,进行苏木精-伊红染色(HE染色),显微镜下观察各组织的病理学变化。
1.6 SYBR Green I荧光定量PCR
根据GenBank中FAdV ZZ株(MN337322.1)的序列,设计特异扩增hexon基因的SYBR Green I荧光定量PCR引物,上游引物:CGAGGACTACGACGATTA,下游引物:CGTGATACAGCAGGTTAATG,引物由上海生工生物工程公司合成。实时荧光PCR的反应程序为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,循环40次。溶解曲线分析设置为:95 ℃ 15 s,65 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s,结束。
将标准质粒按10倍梯度稀释,得到109~102拷贝/μL系列标准模板,采用上述反应程序进行荧光定量PCR反应,并绘制标准曲线,样品病毒拷贝数根据标准曲线计算获得。
2 结果与分析
2.1 病毒滴度
将收获的病毒液做10倍倍比稀释,感染生长于96孔板中的LMH细胞,96 h读数按照Reed-Muench法得到病毒液的TCID50为107.8TCID50/0.1 mL。
2.2 临床症状
感染后0~24 h,所有SPF鸡呈正常状态。到48 h 时,FAdV-4 ZZ株感染组有一半的鸡开始出现精神抑郁、嗜睡、食欲不振等症状;严重者出现头首啄地、闭眼不睁、流涎、肛门处羽毛与粪便粘连、绿便等症状;随后48 h内,其余鸡陆续出现上述严重症状,直至死亡。整个试验周期内,PBS对照组SPF鸡未出现任何异常症状。
2.3 攻毒后的存活率
FAdV-4 ZZ株感染组在攻毒后48~60 h间,鸡开始死亡,死亡数占50%;之后,每隔12 h,都有鸡死亡,到96 h时,所有感染鸡全部死亡;PBS对照组在整个试验过程中没有鸡死亡(图1)。

图1 攻毒后的鸡只存活曲线
2.4 剖检变化
将PBS对照组正常鸡和FAdV-4 ZZ株感染组死亡鸡全部进行解剖观察,结果发现FAdV-4 ZZ株感染组病死鸡全部可见心包积液(图2A)和肝脏变黄肿大(图2B)等典型的病理变化;而对照组鸡正常,未出现任何病变特征(图2C)。
2.5 攻毒后的组织病变
经HE染色后,与对照组鸡相比,感染组病死鸡除十二指肠外,各组织均呈现出一定的组织病理学变化(图3)。心肌细胞有坏死现象,肌纤维间出现淋巴细胞浸润(图3A);肝组织出现弥漫性的灶性坏死,肝细胞内存在包涵体,并且肝细胞核碎裂、溶解,并伴有散在的炎性细胞浸润(图3B);脾脏实质细胞呈现点状凋亡或坏死,出现细胞核固缩、碎裂,但整体结构改变不明显(图3C);肺组织血管内可见炎性细胞增多,肺间质出现水肿和少量的炎性细胞浸润(图3D);肾脏可见广泛弥漫性的肾小管上皮细胞水肿,胞质疏松(图3I);腺胃可见排列规则整齐的复合管状腺,复合管腺腔内可见少量的滴状物,腺管上皮细胞出现点状坏死(图3J);十二指肠肠黏膜层绒毛排列整齐规则,肠腺丰富,排列规则,肠各层结构清晰紧密,未见明显异常(图3K);法氏囊胸腺小叶结构尚在,小叶中皮髓质分界不清楚,皮髓质中淋巴细胞大量坏死减少,排列稀疏紊乱,并伴有中性粒细胞以及巨噬细胞等炎性细胞浸润(图3L)。

图2 FAdV-4 ZZ株感染鸡的病理变化

图3 FAdV-4 ZZ株感染鸡不同组织的组织学变化(HE染色,20×)
2.6 病毒的组织分布情况
荧光定量PCR检测各组织的病毒载量后发现,感染组病死鸡的心、肝、脾、肺、肾、十二指肠、腺胃和心包积液中,都存在不同程度的病毒感染,肝组织中病毒载量最高,其次为肺,表明FAdV-4 ZZ株病毒具有广泛的组织嗜性(图4)。
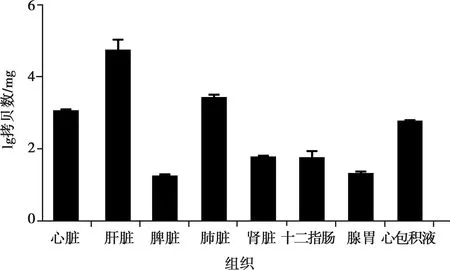
图4 FAdV-4 ZZ株感染后不同组织中的病毒载量
3 讨论
2014年以来,国内鸡群陆续出现了IBH和HPS病例,多发于5~11周龄,蛋鸡、肉种鸡和三黄鸡都有发病[13,16]。发病鸡剖检后心包腔内有淡黄色积液,同时出现肺水肿、肝脏肿胀变色等病变。流行病学调查发现引起国内IBH病例的禽腺病毒为FAdV-8a/b型,引起HPS病例的禽腺病毒为FAdV-4型[16]。FAdV既可经鸡胚垂直传播,也可经粪口途径水平传播,从而对养禽业造成巨大影响[17]。刘亮亮等[18]研究发现国内商品化的新城疫弱毒苗中污染了FAdV-4型病毒,可能造成鸡群大面积感染。Pan等[19]研究发现感染FAdV-4的鸭群可以不表现临床症状,但能持续排毒,形成潜在的传染源,病毒从鸭群向鸡群传播加大了HPS发生的风险和防控难度。
本实验室2016年从患有HPS的病鸡样品中分离了1株FAdV-4病毒株(FAdV-4 ZZ株),利用LMH细胞对病毒进行了培养,并获得了病毒的全基因组序列(GenBank登录号:MN337322.1),研究发现FAdV-4 ZZ株能够影响鸡胚发育,造成内脏器官产生病变并使鸡胚死亡。在此基础上,本研究以FAdV-4 ZZ株感染SPF鸡只,从存活率、剖检结果、组织病理学变化、病毒的组织分布情况等方面对病毒的致病力进行了评价。
FAdV-4 ZZ株感染SPF鸡96 h后,所有感染鸡全部死亡。这说明FAdV-4 ZZ株对SPF鸡有高致病性,与国内其他FAdV-4分离株的致死性结果相近[20]。剖检发现感染组病死鸡全部出现心包积液和肝脏变黄肿大等典型的病理变化,组织病理学也出现了HPS的典型变化。荧光定量PCR检测显示肝脏病毒载量最高,其他组织也检测到不同程度的病毒存在,表明FAdV-4 ZZ株病毒具有广泛的组织嗜性。与国内其他FAdV-4分离株感染SPF鸡后的组织病毒载量结果相似[19-20]。
FAdV感染一般仅造成亚临床症状,本研究致病性试验获得的临床症状、存活率、剖检结果、病理学变化、病毒组织分布情况等结果表明FAdV-4 ZZ株对鸡群具有高毒力,这与国内其他FAdV-4分离株也具有高致病性的结论一致[11,21-22]。与无毒力的FAdV-4 ON1和FAdV-4 KR5株相比,FAdV-4 ZZ株存在ORF19、ORF27和ORF30基因缺失。与国内最早分离的FAdV-4 JSJ13株相比,FAdV-4 ZZ的ORF29序列存在33 nt核苷酸缺失[11]。深入研究这些基因变异对FAdV-4毒力增强产生的影响,是研发FAdV疫苗的关键。当前,加强养禽场生物安全、防止病毒在禽类群体中因交叉感染而持续存在,同时保障禽类疫苗中不污染FAdV,尤其是FAdV-4,是防控FAdV感染和HPS病例发生的重要措施。

