法氏囊活性肽BP7和BP9调节T细胞的功能研究
张则,郑阳,郝珊珊,蔡佳希,冯秀丽
(南京农业大学动物医学院/农业农村部动物细菌学重点实验室/教育部“动物健康与食品安全”国际合作联合实验室,江苏 南京 210095)
法氏囊(bursa of fabricius,BF)是禽类特有的体液免疫中枢器官,是B细胞发育成熟和抗体产生的组织器官,在免疫调节中发挥重要作用。T淋巴细胞起源于骨髓中的造血干细胞,随后T细胞转移到胸腺中成熟,既参与细胞免疫又参与体液免疫,在产生抗体过程中发挥调节作用,是免疫系统中不可缺少的重要组成部分[1]。目前法氏囊对T细胞的作用机制仍需进一步研究。
有研究发现,法氏囊组织灭活疫苗在体内保护效果优于胚苗和细胞苗[2],暗示着其存在某种活性成分可以促进免疫反应。据Murthy等[3]报道,大剂量的法氏囊组织提取物在体外可以促进植物血凝素(PHA)诱导的淋巴细胞的转化,说明其能够不依赖于机体在体外也能发挥良好的免疫功能。Audhya等[4]在1986年首次从鸡法氏囊组织中分离出一种名为囊素三肽的生物肽,到现在为止,已经从法氏囊中发现多种活性肽,如BP5[5]、BSP-Ⅱ[6]和 BPP-Ⅱ[7],并证实其能够参与调节B细胞发育、调节免疫反应、抗氧化、抗肿瘤等多种生物学过程[7-9]。探究法氏囊活性肽的免疫学功能和作用机理,为开发其临床应用潜力提供新的思路。
法氏囊活性肽BP7和BP9是本实验室近期研究的2种生物活性分子,已在小鼠免疫试验中证实其能够增强禽流感病毒(AIV)灭活疫苗的免疫效果[10-11]。然而,对法氏囊活性肽BP7和BP9如何调节T细胞的作用机制报道甚少。基于此,本研究以AIV灭活疫苗免疫小鼠为模型,开展了多肽调节T淋巴细胞作用的试验,为探究法氏囊活性肽调节免疫系统的分子机制提供理论基础。
1 材料与方法
1.1 主要试验材料
法氏囊活性肽BP7(氨基酸序列为GGCDGAA)和BP9(氨基酸序列为LMTFRNEGT)均由南京金斯瑞生物科技有限公司合成,纯度在98%以上;禽流感病毒株A/chicken/Shandong/LY1/2017 (H9N2) 为本实验室保存。
HRP标记山羊抗鼠IgG二抗购自联科生物公司;单组分TMB显色液、ELISA终止液均购自善清博生物公司;牛血清蛋白(BSA)、噻唑兰、DMSO均购自于上海生物生工公司;CD3+T细胞阴选磁珠购自优宁维生物公司;CD3-FITC、CD8-PE、CD4-Alex Fluro流式抗体和FITC/PI 凋亡检测试剂盒均购自美国BD公司;白细胞介素-4(IL-4)、干扰素-γ(IFN-γ)ELISA试剂盒购自武汉基因美生物公司。
1.2 H9N2抗原疫苗的制备
选取纯化后病毒H9N2作为疫苗抗原,根据《兽用生物制品质量标准》制备H9N2亚型禽流感灭活疫苗,油包水剂型,稳定无析出,黏度合格,无菌。
1.3 小鼠免疫和H9N2病毒抗体检测
6周龄SPF级ICR小鼠(购自扬州大学实验动物中心)随机分为PBS组和疫苗组,每组10只。疫苗腹腔注射小鼠,100 μg/只,于一免后14 d二免,7 d后三免, 1周后采集小鼠血清,以2 μg/mL的纯化AIV灭活抗原包被酶标板,建立间接ELISA方法[10],检测其H9N2亚型禽流感病毒的特异性抗体效价。
1.4 脾脏淋巴细胞悬液的制备
将小鼠断颈处死,75%酒精浸泡5 min,无菌摘取脾脏,用注射器活塞在200目尼龙布研磨过滤,加入适量的PBS稀释,沿着管壁缓慢滴加在等体积的淋巴细胞分离液上,500g离心20 min,小心吸取淋巴细胞层,加入过量的无菌PBS清洗2次,调整细胞悬液浓度至1×107个/mL,静置备用。
1.5 磁珠筛选T细胞及纯度检测
将上述制备好的细胞悬液,加入适量的磁珠抗体,冰上孵育15 min,用5 mL buffer洗涤细胞,300g离心7 min,弃去上清。之后加入适量的磁珠,充分混匀,4 ℃孵育30 min。然后加入1 mL buffer并转移至流式管中,放置在磁力架上6~8 min,重复分选2次,吸取上清,离心,加入含有10%胎牛血清的RPMI-1640完全培养基重悬细胞。取少量的细胞悬液计数,加入5 μL的CD3-FITC标记抗体,避光孵育30 min,500 μL PBS重悬,流式细胞仪鉴定细胞纯度。
1.6 T细胞增殖检测
取一部分分选后的细胞悬液,加入到96孔细胞板中(105细胞/孔)。将剂量为10 ng/mL刀豆素ConA分别与BSA、BP7和BP9混匀,刺激T细胞。细胞分组为:Con组为空白对照组,ConA组为刀豆素ConA+BSA刺激组(剂量为1 ng/mL),ConA+BP7组为刀豆素ConA+多肽BP7(剂量为1 ng/mL)刺激组,ConA+BP9组为刀豆素ConA+多肽BP9(剂量为1 ng/mL)刺激组,并在作用48 h后,按照标准的MTT方法检测2种法氏囊活性肽对T细胞活力的影响[12]。
1.7 T细胞亚型分化鉴定
取分选后的T细胞悬液,加入到六孔板中,设立与上述相同的分组,用含有10%胎牛血清的PRMI-1640完全培养基培养24 h和48 h后,离心收集细胞,加入CD3-FITC、CD8-PE、CD4-Alex Fluro流式抗体,充分混匀,常温避光孵育30 min,PBS清洗2次,500 μL PBS重悬,流式细胞仪上机鉴定。
1.8 T细胞早期凋亡分析
取分选后的T细胞悬液,加入到六孔板中,设立上述相同的分组,用含有10%胎牛血清的RPMI-1640完全培养基分别培养12、24和48 h后,离心收样,加入Annexin V-FITC 和 PI 染液,室温避光标记15 min,在1 h内通过流式细胞分析仪,上机分析。
1.9 细胞因子检测
收集培养48 h后96孔板中的细胞上清,-20 ℃分装保存。按说明书操作,应用商品化的ELISA试剂盒检测IL-4和IFN-γ细胞因子含量变化情况。
1.10 数据统计与分析
所有数据均由Excel进行统计后,Graphpad软件进行数据分析,试验数据用“平均值±标准误”表示,采用t检验进行显著性分析。
2 结果
2.1 免疫小鼠的抗体水平
分别于一免和三免后2周采集免疫小鼠血清,利用间接ELISA方法检测小鼠特异性抗体水平的变化。如图1所示,免疫小鼠在三免后AIV的特异性抗体水平较对照组明显升高,其OD值达到了0.607,且远高于一免后AIV的抗体水平。该结果说明免疫小鼠已产生良好的特异性免疫应答反应。
2.2 BP7和BP9对CD3+T细胞增殖的促进作用
为了检测法氏囊活性肽对T细胞增殖的影响,首先采用磁珠阴选T细胞,流式分析发现,磁珠筛选的免疫小鼠脾脏T细胞效果较好(图2A),CD3+阳性T细胞占筛选T细胞的比例高达95.6%(图2B)。如图2C所示,与ConA组相比,ConA+BP7组和ConA+BP9组的T细胞的OD值明显升高,其中ConA+BP7组T细胞的OD值最高(P<0.01)。该结果说明,法氏囊活性肽BP7和BP9均促进CD3+T细胞增殖,且BP7促进T细胞活性的能力高于BP9。
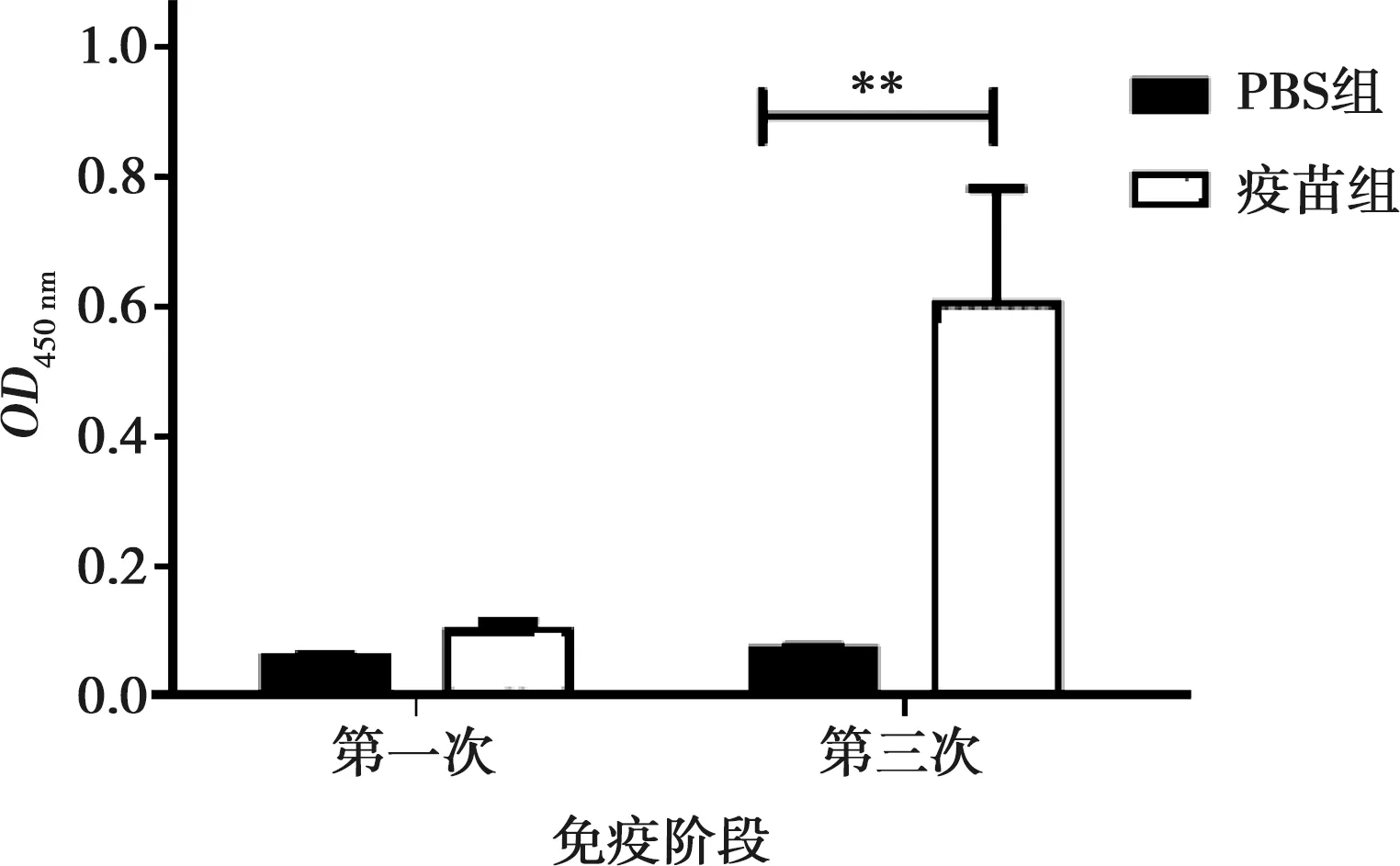
注:**表示差异极显著(P<0.01)

A.淋巴细胞;B.T细胞比例;C.CD3+T细胞增殖,其中:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
2.3 BP7和BP9对T细胞亚型分化的调节作用
2.3.1 BP7和BP9对CD3+CD4+T细胞分化的影响
法氏囊多肽BP7和BP9刺激磁珠筛选的免疫小鼠T细胞,然后流式细胞术进行检测CD3+CD4+T细胞比例。结果如图3A所示,在24 h和48 h时,与ConA组相比,ConA+BP7刺激组的CD3+CD4+T细胞比例均明显升高(P<0.05),不过ConA+BP9刺激组的CD3+CD4+T细胞比例与ConA组差异不明显(P>0.05),说明试验剂量的BP7促进了T细胞向CD3+CD4+T细胞分化,而BP9不能活化T细胞增殖分化成CD3+CD4+T细胞,其功能机制还有待于进一步探索。
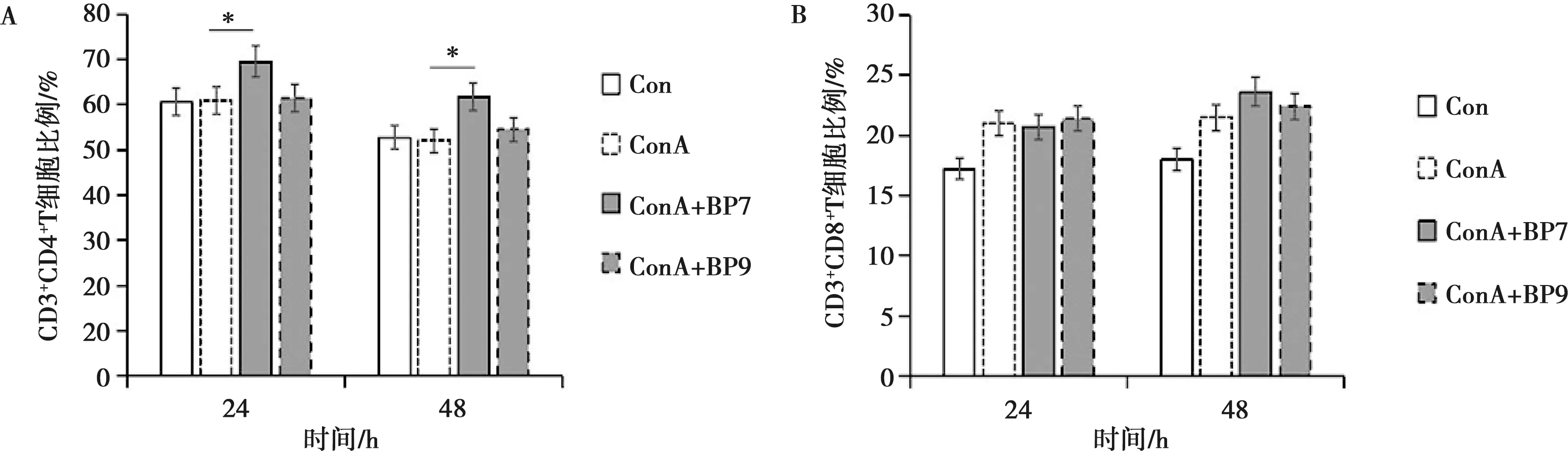
A.CD3+CD4+T细胞;B.CD3+CD8+T细胞
2.3.2 BP7和BP9对CD3+CD8+T细胞分化的影响
法氏囊多肽BP7和BP9刺激经磁珠筛选的免疫小鼠T细胞,然后流式细胞术检测CD3+CD8+T细胞比例。结果如图3B所示,在48 h时,与ConA组相比,ConA+BP7组的CD3+CD8+T细胞比例升高,且ConA+BP9组的CD3+CD8+T细胞比例也升高,不过没有达到显著差异水平(P>0.05)。而在24 h时,ConA+BP7和ConA+BP9组与ConA组相比,CD3+CD8+T细胞比例变化不大,说明多肽BP7的刺激能够促进活化T细胞增殖分化成CD3+CD8+T细胞,多肽BP9的刺激能一定程度上活化T细胞增殖分化成CD3+CD8+T细胞。
2.4 BP7和BP9抑制T细胞的早期凋亡
法氏囊多肽BP7和BP9刺激经磁珠筛选的免疫小鼠T细胞,分别在12、24和48 h采用流式细胞术检测T细胞凋亡情况,分析结果如图4所示,ConA+BP7组在12、24和48 h里的早凋细胞比例分别为9.86%、7.60%和15.50%,比同一时间的空白对照组Con、ConA组的早凋细胞比例减少,差异较为明显;ConA+BP9组在12、24和48 h里的早凋细胞比例分别为9.76%、13.25%和17.85%,也比同一时间的空白对照组Con、ConA组的早凋细胞比例少,差异也较为明显。以上结果表明多肽BP7、BP9能在48 h内一定程度上抑制T淋巴细胞的凋亡。
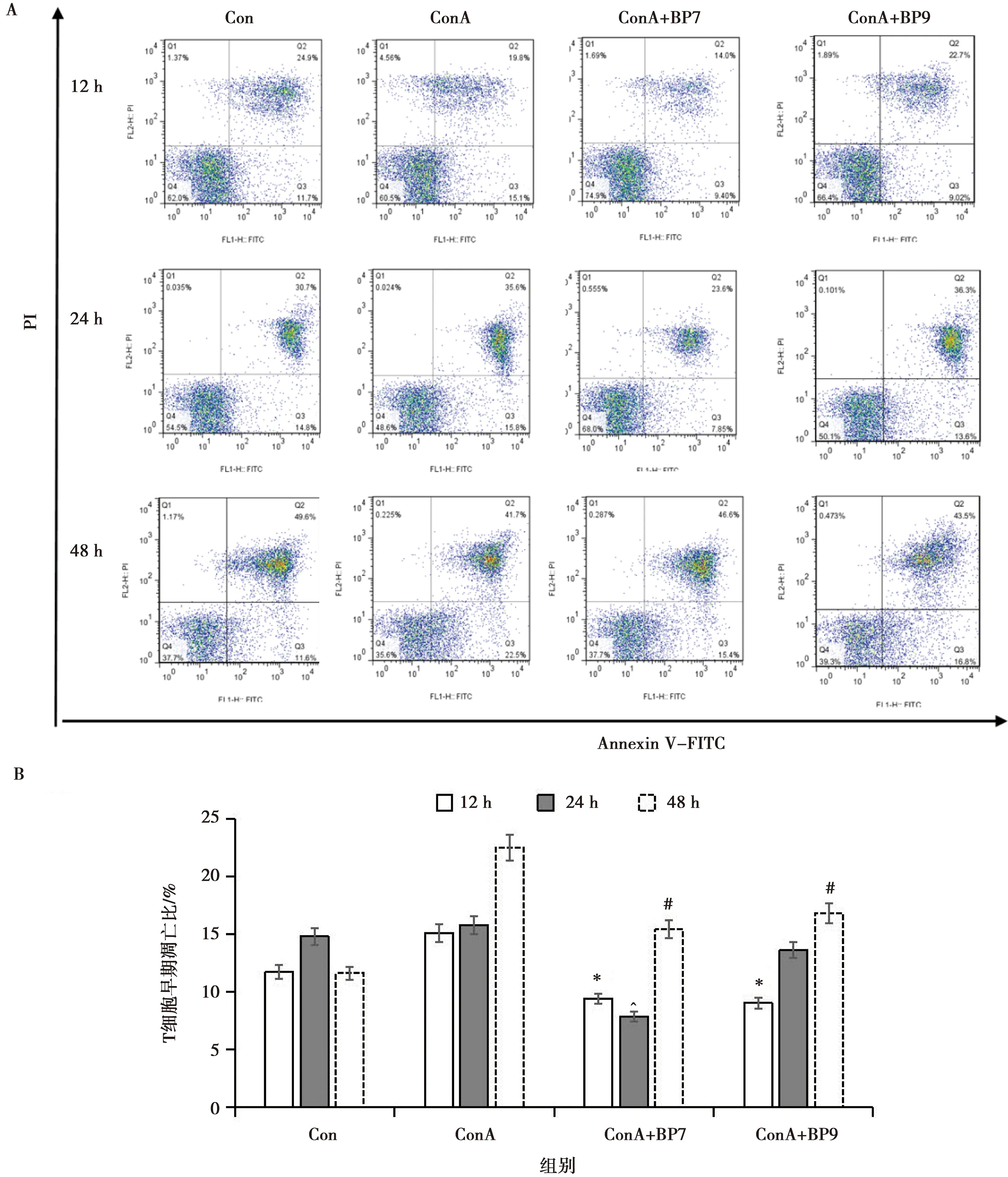
A.T细胞早期凋亡的流式细胞术结果;B. T细胞早期凋亡情况,其中:*、 ^、#分别表示在12、24和48 h时,ConA+BP7组、ConA+BP9组与ConA组相比差异显著(P<0.05)
2.5 BP7和BP9对脾脏T淋巴细胞中细胞因子IL-4和IFN-γ表达水平的影响
通过ELISA试剂盒检测细胞上清中的IFN-γ、IL-4的表达水平,如图5所示,与Con和ConA组相比,ConA+BP7组能显著提高Th1型细胞因子IFN-γ(80.796 ng/mL)和Th2型细胞因子IL-4(159.205 ng/mL)水平,差异极显著(P<0.01);而ConA+BP9组Th1型细胞因子IFN-γ(33.175 ng/mL)和Th2型细胞因子IL-4的含量(42.675 ng/mL)与Con和ConA组相比差异均不显著。说明BP7能够上调Th1型细胞因子IFN-γ和Th2型细胞因子IL-4的分泌水平,有明显的活化作用。
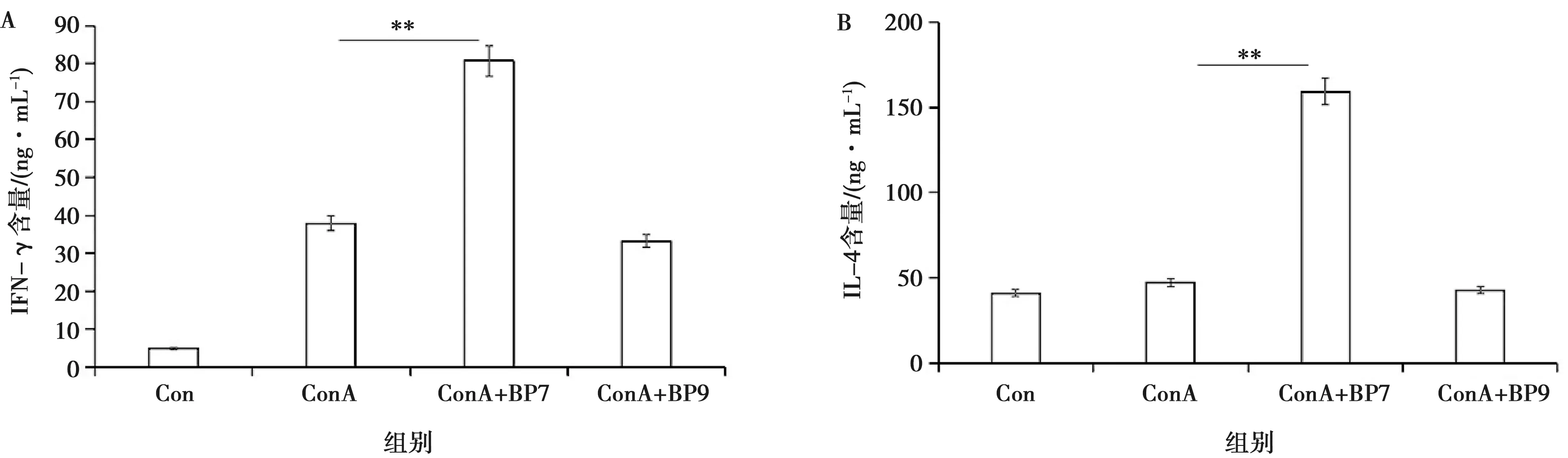
图5 CD3+T淋巴细胞上清IFN-γ和IL-4表达水平
3 讨论
法氏囊是禽类唯一的体液中枢免疫器官,在免疫系统中占有重要地位,不仅参与体液免疫的调节,还参与调节细胞免疫[13]。以往的研究主要集中法氏囊活性肽对B细胞功能研究,对活性肽调节T细胞的报道很少,法氏囊活性肽调节T细胞的作用机制还尚不清楚。
本研究对BP7和BP9对T细胞的免疫调节活性进行验证。选择了1 ng/mL的BP7和BP9分别混合刀豆素Con A刺激磁珠分选小鼠T淋巴细胞,以检测法氏囊活性肽对T细胞功能影响。研究结果表明,BP7和BP9均能增强T细胞增殖活性。淋巴细胞亚群中CD3+、CD3+CD4+、CD3+CD8+T细胞是衡量机体细胞和体液免疫功能的金标准,了解体内免疫功能的主要途径是通过淋巴细胞亚群的检测[14]。本文以CD3+、CD3+CD4+、CD3+CD8+T细胞为机体细胞和体液免疫功能的观察指标,动态观察多肽对T细胞功能影响。结果显示, BP7和BP9对 CD3+CD4+、CD3+CD8+T细胞亚型免疫调节活性略有差异。BP7和BP9能够同时促进 CD3+CD4+T分化,BP7在48 h能够促进CD3+CD8+T细胞的分化,而BP9对CD3+CD8+T细胞无显著影响,说明法氏囊活性肽BP7和BP9可能以不同的作用机制通过影响T细胞分化来调节细胞免疫反应。
细胞凋亡是一种由基因控制的细胞自主性死亡方式, 它涉及一系列基因的激活、表达以及调控等的作用,对维持个体正常生理过程和功能表达具有重大的生物学意义[15]。为此,本研究使用Annexin V-FITC/PI法检测T细胞凋亡情况。结果显示,加入BP7和BP9刺激,T细胞的早期凋亡率明显下降,由此得知,BP7和BP9与细胞的凋亡相关,随着时间增加,T细胞的早期凋亡率有所上升,表明法氏囊活性肽BP7和BP9可能通过调节基因的表达来调控T淋巴细胞的分化成熟。Th1 细胞产生IFN-γ,而 Th2 细胞分泌IL-4。Th1、Th2 细胞分泌的细胞因子可共同调控细胞的分化与成熟。IL-4和IFN-γ是由激活的 T 细胞产生,具有重要的免疫调节作用[16-17]。法氏囊活性肽BP7能够上调IL-4和IFN-γ的细胞因子反应,而BP9对细胞因子反应无显著影响,说明BP7和BP9对T细胞的作用机制不同,但其差异仍需进一步研究。
综上所述,法氏囊活性肽BP7和BP9能够通过不同作用方式促进T细胞的增殖分化,并可能通过调控基因表达来影响T细胞生物学功能活性,为深入挖掘法氏囊活性肽在免疫系统中的作用机制提供了参考。

