1株H9N2亚型禽流感变异株HA基因遗传演化分析及反向遗传操作系统的建立
范梦璐,田苗,赵永振,平继辉
(南京农业大学动物医学院,江苏 南京 210095)
H9N2亚型禽流感病毒(H9N2 subtype AIV)自1966年从北美的火鸡体内首次被分离以来,已在全世界范围内广泛传播。1994年,在我国广东省分离到第1株H9N2亚型AIV[1-2]。随着该亚型病毒的不断传播和进化,H9N2 AIV已在我国家禽中成为流行最为广泛的流感病毒亚型。虽然H9N2亚型AIV感染家禽后仅表现出较低的致病性,但与其他病原体混合感染时会导致严重发病,给家禽业造成重大的经济损失[3]。疫苗接种是我国防控H9N2 AIV采取的最普遍的手段,研究表明,AIV在疫苗选择压力下正在不断发生重组和变异[4-5]。HA和NA是流感病毒表面的2种糖蛋白,是决定病毒抗原性的重要基因,HA基因上某些氨基酸位点的改变与流感病毒变异和致病性密切相关[6-7]。
病毒的反向遗传技术,又被称为病毒拯救,是通过构建RNA病毒的感染性分子克隆,在DNA分子水平上对其进行体外操作并拯救出具有活性的病毒粒子,从而研究病毒基因结构与功能的方法[8]。Neumann等[9]在1999年建立了流感病毒的12质粒反向遗传系统,将病毒8种vRNA片段的cDNA克隆到人RNA聚合酶Ⅰ启动子和鼠RNA聚合酶终止子之间,在转染8个vRNA片段的质粒DNA同时,共转染聚合酶(PB2,PB1和PA)以及核蛋白NP的蛋白表达质粒,在4个蛋白表达质粒所形成的聚合酶驱动下,转录出8个病毒RNA片段,进而形成病毒的最小复制单位核糖核蛋白复合体(vRNPs),随后包装出病毒粒子,因此流感病毒的“12质粒系统”具有很高的病毒拯救效率。
本研究从江苏省某养鸡场发病鸡体内分离到1株H9N2亚型AIV,命名为A/chicken/Jiangsu/76/2018 (H9N2, JS/76),该鸡场具有比较完善的禽流感疫苗免疫程序,定期进行疫苗接种,提示该分离株可能为变异毒株。针对该病毒HA基因进行序列测定和遗传演化分析发现,JS/76仍属于A/duck/Hong Kong/Y280/97分支。本研究成功建立了低致病性H9N2亚型AIV的反向遗传系统,通过测定病毒TCID50、EID50、生长曲线和受体亲和性证明拯救病毒的生物学特性与野生毒株完全一致,为进一步研究JS/76 AIV的生物学特性以及致病机制提供了依据。
1 材料与方法
1.1 载体、细胞和病毒
流感病毒RNA转录载体pHH21及大肠杆菌DH5α感受态细胞由本实验室保存; MDCK和293T细胞由本实验室保存;9~11日龄SPF鸡胚购自天邦生物技术股份有限公司。
本研究使用AIV毒株A/chicken/Jiangsu/76/2018从江苏省某养殖场发病鸡体内分离,经SPF鸡胚连续3次有限稀释进行纯化,并在SPF鸡胚上增殖一代,保存于-80 ℃冰箱备用。对照毒株A/California/04/2009 (H1N1, Cal/04) 和A/chicken/Shandong/6/1996 (H9N2, SD/6/96) 由本实验室保存。
1.2 主要试剂
Phonta Max Super-Fidelity DNA酶、T4 DNA 连接酶、ClonExpress II One Step Cloning Kit和RNA isolater Total RNA Extraction Reagent等试剂(盒)购自南京诺唯赞公司;质粒DNA中提试剂盒购自天根生化科技(北京)有限公司;胶回收试剂盒以及DNA清洁回收试剂盒购自AxyPrep公司;限制性内切酶购自NEB公司;DNA Marker DL2000和DNA Marker DL5000均购自TaKaRa;胎牛血清、Opti-MEM减血清培养基、LipofectamineTM2000和DMEM培养液购自Invitrogen公司;TPCK胰酶以及FITC链霉亲和素均购自Sigma-Aldrich;Alexa Fluor®647 标记山羊抗小鼠IgG (H+L) 购自福麦斯生物;M2 E10单克隆抗体、6’SLN和6’sDi-LN2种唾液酸糖链由内蒙古大学王国俊教授惠赠。
1.3 HA基因的关键性位点分析和进化树绘制
用Lasergene 9.0中的MegAlign软件对H9N2分离株的HA基因序列与流感病毒数据库中的H9N2禽流感参考毒株的HA基因序列进行比较和分析。参考毒株HA基因登录号分别为:A/chicken/Anhui/LH66/2017 (H9N2):MH489443; A/chicken/Guangxi/55/2005 (H9N2):EU086245; A/chicken/Shanghai/F/1998 (H9N2):AY743216; A/chicken/Hong Kong/G9/1997 (H9N2):KF188366; A/duck/Hong Kong/Y280/1997 (H9N2):AF56376; A/chicken/Shandong/6/1996 (H9N2):DQ064376; A/chicken/Beijing/1/1994 (H9N2):AF156380。使用Mega 7.0.26软件绘制病毒HA基因的进化树,根据文献[10]分析分离株的关键性氨基酸位点。
1.4 引物设计与合成
利用Oligo7.0软件设计扩增流感病毒PB2、PB1、PA、HA、NP、NA、M和NS基因全长的特异性引物及流感病毒反转录通用引物PolI-U12:CACACACGTCTCCGGGAGCAAAAGCAGG,引物由通用生物系统(安徽)公司合成,引物序列信息见表1。

表1 H9N2亚型AIV 8个基因片段的感染性克隆构建引物
1.5 病毒RNA的提取、反转录以及目的片段扩增
参照RNA isolater Total RNA Extraction Reagent 试剂使用说明书进行病毒RNA抽提,采用ClonExpress Ⅱ One Step Cloning Kit试剂盒通过流感病毒反转录通用引物PolI-U12进行cDNA的反转录。利用基因特异性引物以cDNA为模板对JS/76的8个片段进行PCR扩增,PCR产物经电泳后使用琼脂糖凝胶回收试剂盒进行回收。
1.6 感染性克隆质粒的构建
使用限制性内切酶BsmBⅠ对pHH21载体质粒进行酶切处理,同时利用BsmBⅠ或BsaⅠ限制性内切酶对8个基因片段进行酶切处理后,利用T4 DNA 连接酶将线性化的pHH21载体和目的基因片段进行连接,连接产物转化DH5α感受态细胞,并筛选阳性克隆送至南京擎科生物科技有限公司测序。使用不含内毒素的质粒DNA提取试剂盒提取JS/76的8个基因片段的阳性克隆质粒,8个转录质粒分别命名为pHH21-JS/76-PB2、pHH21-JS/76-PB1、pHH21-JS/76-PA、pHH21-JS/76-HA、pHH21-JS/76-NP、pHH21-JS/76-NA、pHH21-JS/76-M以及pHH21-JS/76-NS。
1.7 293T细胞转染与病毒的拯救
使用LipofectamineTM2000 转染试剂介导外源质粒进入细胞内,利用“12质粒系统”进行病毒拯救。12个质粒分别为:上述8个病毒RNA转录质粒以及4个蛋白表达质粒pCAGGS-WSN-PB2、pCAGGS-WSN-PB1、pCAGGS-WSN-PA和pCAGGS-WSN-NP。
病毒拯救的具体步骤如下:将8个转录质粒(200 ng/质粒)和4个蛋白质表达质粒(1 000 ng/质粒)混匀后,与12 μL LipofectamineTM2000 转染试剂混合,在室温孵育30 min后,加入到密度为70%的单层293T细胞中,放入37 ℃、5% CO2培养箱中培养;转染6 h后弃去转染上清,并加入2 mL新鲜的Opti-MEM(含有1 μg/mL的TPCK-Trypsin),37 ℃ 继续培养。48 h后将转染上清接种至9~11日龄SPF鸡胚的尿囊腔,0.2 mL/胚,置于37 ℃ 增殖48 h,收集尿囊液,用1%的鸡红细胞测定病毒的血凝价,将有血凝活性的尿囊液收集并分装,-80 ℃保存备用。
1.8 获救病毒的鉴定
对获救病毒RNA进行提取、片段扩增以及测序,测序结果使用Lasergene 9.0软件套装中的SeqMan软件进行序列拼接并通过与亲本病毒基因组的比较来判定拯救的病毒的正确性。
1.9 EID50和TCID50滴度的测定
按照Reed-Muench 方法,测定拯救毒株与亲本毒株的鸡胚半数感染量(EID50)和半数组织培养感染剂量(TCID50)。数据使用GraphPad Prism 8.0.1.2软件进行处理并用“平均数±标准差”表示,利用t检验方法进行差异显著性分析。
1.10 病毒在SPF鸡胚和MDCK细胞上的复制
拯救病毒和野生型病毒分别以2×103EID50的感染量接种18枚9日龄SPF鸡胚,在接种后12 、24、36、48、60和72 h分别取3枚鸡胚,测定其HA滴度并取平均值代表病毒在该时间点的复制情况,利用GraphPad Prism 8.0.1.2软件处理数据并绘制复制曲线。
拯救病毒和野生病毒分别以MOI=0.01的病毒量感染培养于6孔板中的密度为95%的MDCK细胞,每个病毒3个重复,分别在12、24、36、48、60和72 h收取细胞上清液存于-80 ℃冰箱,待所有样品收集完毕后测定其HA滴度,利用GraphPad Prism 8.0.1.2软件处理数据并绘制病毒的生长曲线。
1.11 受体结合试验
使用Cal/04病毒作为人流感病毒受体结合特征的对照,SD/6/96作为禽流感病毒受体结合特征的对照。未感染病毒的细胞为MOCK组空白对照。将对照组病毒、拯救病毒和野生病毒分别以MOI=1的剂量感染6孔板中95%密度的单层MDCK细胞,感染24 h后,胰酶消化感染细胞(包括MOCK组和感染组的细胞),用冷PBS洗涤细胞3次后,重悬于500 μL的PBS中,之后将细胞加入96孔V型板中,每孔100 μL。分别加入2种α-2,6唾液酸糖链(6’SLN和6’sDi-LN)以及M2 E10抗体,4 ℃孵育2 h,用PBS洗涤2次后,每孔中分别加入FITC链霉亲和素和Alexa Fluor®647 标记山羊抗小鼠IgG (H+L) 抗体,4 ℃孵育2 h,PBS洗2遍后,1 mL PBS重悬,流式细胞仪进行测定,FlowJo软件进行结果分析。
2 结果
2.1 HA基因遗传演化及关键氨基酸位点分析
JS/76分离株在SPF鸡胚上进行3次有限稀释纯化后,提取病毒的RNA,RT-PCR扩增其HA基因之后进行序列测定,与美国国家生物技术信息中心(NCBI)数据库所获得的参考毒株核苷酸序列进行对比,绘制病毒HA基因的进化树。结果如图1所示,JS/76分离株位于Y280分支,与湖南、山东、江苏、江西等地的H9N2分离株相距较近,其变异程度主要与时间相关,与宿主和地理位置关系较小。对JS/76的HA氨基酸序列的关键性位点进行分析(表2),JS/76毒株在315~323位的裂解位点为PSRSSR↓GLF,无多个连续碱性氨基酸,表明其具有LPAIV的分子特征。对其受体结合位点分析发现,JS/76的受体结合位点发生了E180T和Q216L的突变,表明可能已具备人源病毒的受体结合特征。在91、143、145、173、184和185位氨基酸与参考毒株一致,分别为Y、W、T、N、L和Y。潜在糖基化位点分析显示,JS/76毒株在11、123、127、280、287、295、474和533位有8个潜在糖基化位点,其中127位氨基酸与参考毒株相比多了一个潜在糖基化位点NGT,在200位少了一个潜在糖基化位点NRT。
2.2 感染性克隆质粒的构建
提取病毒的RNA,进行反转录,用带有酶切位点的引物进行PCR扩增,酶切后克隆到pHH21载体,挑选单菌落37℃摇床培养后提取质粒,结果如图2A所示,8个基因片段的感染性克隆的大小均符合预期,进行PCR鉴定发现,8个质粒均能扩增出位置正确、条带单一的条带(如图2B所示)。经测序分析发现,所构建的重组质粒所携带的目的基因序列与JS/76基因序列完全一致,表明成功获得了JS/76病毒8个基因的感染性克隆。
2.3 病毒的拯救与鉴定
利用流感病毒的“12质粒系统”进行JS/76的拯救,将LipofectamineTM2000转染试剂与构建好的重组质粒转入已准备好的生长密度为70%~80%的单层293T细胞中。转染48 h后收集细胞上清接种9~11日龄SPF鸡胚,48 h后收获尿囊液,测定血凝活性为阳性,拯救的病毒命名为r-JS/76。提取病毒RNA、反转录、PCR扩增8个基因片段并进行序列测定,与JS/76基因组序列比对发现,r-JS/76基因序列与野生病毒JS/76序列完全一致,证明病毒拯救成功。

表2 JS/76 毒株HA序列关键性氨基酸位点分析

注:以A/turkey/Wisconsin/1966 (H9N2) 为进化树的树根。●表示本研究中分离株JS/76,■表示经典代表毒株,▲表示疫苗毒株
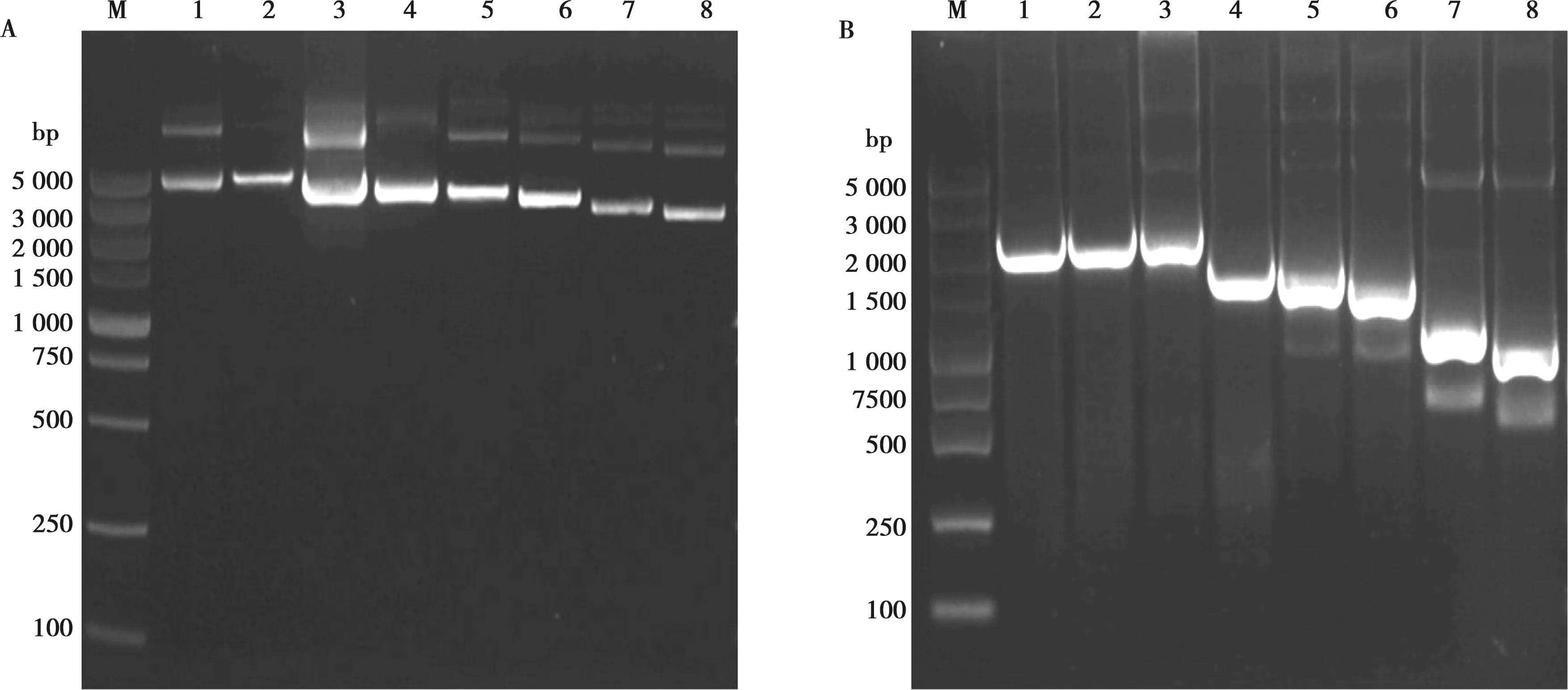
M. DL5000 DNA Marker; 1~8.依次为PB2、PB1、PA、HA、NP、NA、M、NS基因的阳性质粒和PCR扩增产物
2.4 拯救病毒r-JS/76和野生病毒JS/76的病毒滴度测定
分别测定r-JS/76和JS/76的病毒滴度,将r-JS/76病毒接种MDCK细胞,测得其滴度为(7.34±0.10)lgTCID50/mL,亲本病毒JS/76的滴度为(7.12±0.23)lgTCID50/mL。将r-JS/76和JS/76分别接种9日龄SPF鸡胚,测定其在鸡胚上的滴度分别为(9.56±0.11)lgEID50/mL和(9.31±0.15)lgEID50/mL,结果统计分析无显著性差异,表明拯救病毒的增殖特性未发生改变。
2.5 r-JS/76和JS/76病毒在鸡胚和细胞上复制特性分析
将拯救病毒r-JS/76和亲本病毒JS/76分别以2×103EID50的感染量接种SPF鸡胚,然后在不同的时间点收获尿囊液,测定病毒血凝价,比较2个病毒在鸡胚中的复制能力。统计分析结果显示,野生型毒株JS/76与其拯救株r-JS/76在各个时间点的复制滴度基本一致,r-JS/76病毒复制滴度略高于亲本毒株,但无显著性差异(图3A)。
JS/76和r-JS/76以MOI=0.01的剂量感染MDCK细胞,不同的时间点收获细胞上清测定其血凝价,比较2个病毒在MDCK细胞中的复制能力。通过差异显著性分析,拯救株r-JS/76比野生型毒株JS/76在细胞上的复制水平略高,但无显著性差异(图3B)。因此,拯救病毒r-JS/76在SPF鸡胚和MDCK细胞上保留了与JS/76相似的复制特性。
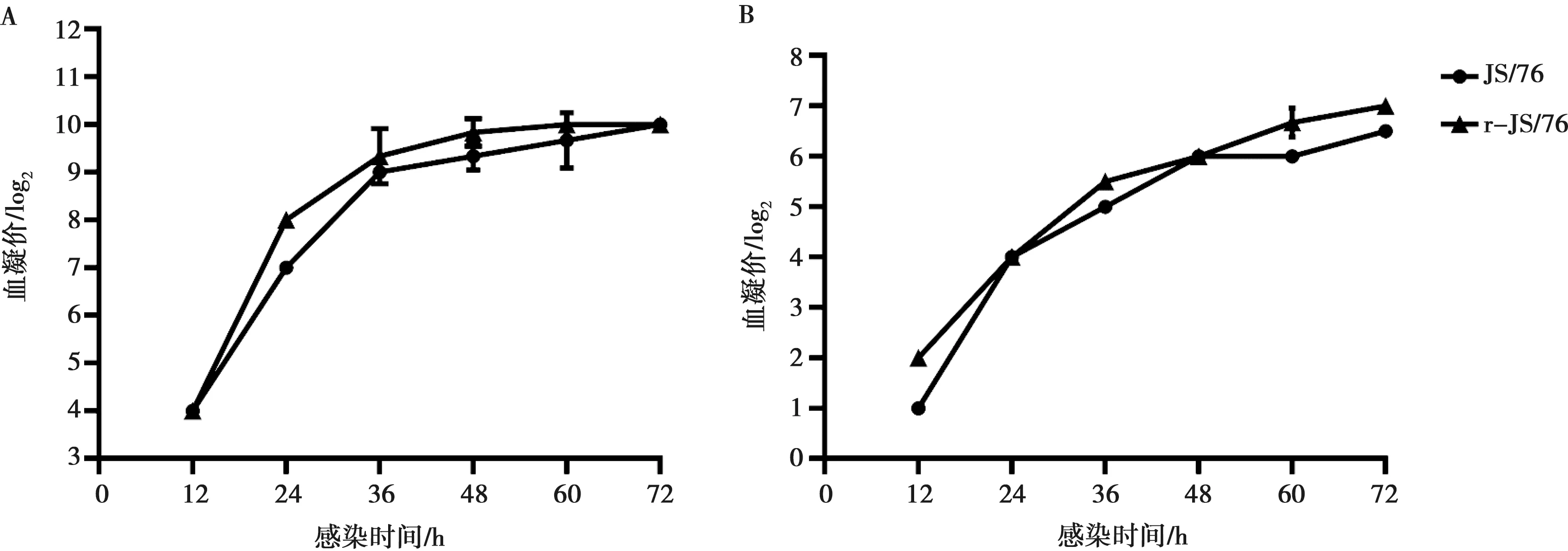
图3 拯救毒株r-JS/76和亲本毒株JS/76在SPF鸡胚(A)和MDCK细胞(B)的复制动力学分析
2.6 r-JS/76和JS/76病毒的受体结合特性分析
JS/76和r-JS/76以MOI=1的剂量感染MDCK细胞,在24 h后收集感染细胞,利用相应糖链和抗体处理后,流式技术检测细胞的阳性率,结果如图4 A所示,与MOCK组相比,对照组的2个病毒Cal/04和SD/6/96能够检测到的细胞阳性率分别为72.2%和85.7%,试验组r-JS/76和JS/76检测到的细胞阳性率分别为89.6%和90.1%,说明MDCK已经被病毒有效感染并能够通过相应抗体检测到。通过检测与2种α-2,6唾液酸糖链的结合效率发现(图4 B),Cal/04具有α-2,6唾液酸受体亲和性,而SD/6/96无α-2,6唾液酸受体亲和性,与这2株病毒本身分别具备人源受体结合特性及禽源受体结合特性完全一致。与对照组相比,r-JS/76和JS/76两个病毒也能够检测与6’sDi-LN糖链结合,说明这2株病毒已经获得人源受体亲和特征。

图4 拯救毒株r-JS/76和亲本毒株JS/76流式细胞阳性结果(A)及人源受体亲和性分析(B)
3 讨论
近年来发现,H9N2亚型AIV能够为多种新型流感病毒提供内部基因或与高致病性流感病毒重组,从而增强流感病毒的毒力和感染范围[11-12]。文献报道,近期分离到2株厦门分离株的内部基因与H10及H7亚型亲缘关系最近,分离株为四重重组体,进化程度与时间相关性较大,进化方向已突破地域和宿主的特点[13],因此H9N2亚型AIV已经成为公共安全的潜在威胁。H9N2亚型AIV能够逃避宿主机体的免疫能力,对宿主构成持续的威胁,主要原因就是病毒的表面蛋白血凝素HA和神经氨酸酶NA在不断发生变异,使病毒容易发生抗原漂移和抗原转变[10, 14-15]。表面蛋白HA是宿主免疫系统识别的主要靶蛋白之一,能够诱导机体产生免疫反应,产生中和抗体。HA的特异性抗体主要针对头部球状结构域。抗原表位、受体结合区以及其他头部氨基酸替换都会对流感病毒的抗原性、受体亲和性以及病毒毒力产生影响[16-17]。本研究通过对JS/76分离株的HA基因进行遗传演化分析以及关键氨基酸位点分析,发现JS/76毒株属于Y280-like分支。研究发现同一时期不同区域H9N2毒株之间进化距离相近,HA基因的变异情况和地域无相关性,可能与时间推移具有相关性[18]。另外,从进化树中可以看出,JS/76 AIV HA基因序列与参考毒株和常用疫苗株的距离较远,可能是在疫苗免疫压力和自然选择下,加速了H9N2亚型AIV的变异速度。
HA蛋白受体结合区氨基酸的改变,会影响流感病毒与禽源/人源宿主细胞受体的结合能力。在先前的报道中,Q216L位点氨基酸发生变异,是H9N2亚型AIV由禽源受体亲和性向人源受体亲和性改变的一个先决条件[19-20]。本研究中,JS/76毒株的HA基因216位氨基酸为亮氨酸,与参考毒株相比,已经具备了与人源α-2,6唾液酸受体结合的特征。病毒表面蛋白HA糖基化缺失或增加会影响流感病毒的毒力或者抗原性。Gao等[21]和Herfst等[22]研究发现H5N1 AIV HA蛋白158N糖基化位点的缺失有助于病毒在雪貂上呼吸道的复制,促进H5N1病毒在豚鼠中的直接接触传播以及在雪貂中的水平传播。有研究表明国内多数H9N2亚型 AIV HA蛋白有7个毒力相关的糖基化位点(含N-X-S/T,X为除P以外的氨基酸)[2]。本研究中JS/76毒株HA基因的127~129位氨基酸获得一个额外的潜在糖基化位点,该突变是否形成糖基化以及对病毒的生物学特性影响还有待进一步研究。
目前,反向遗传技术已经非常成熟,该技术已应用于多种负链RNA病毒的研究,在病毒基因组的表达调控机制、分子致病机理研究以及新型疫苗研制上发挥着重要作用[23-24]。本研究利用流感病毒反向遗传的“12质粒系统”,将野生毒株的8个基因片段分别克隆到流感病毒vRNA表达载体pHH21上,与4个蛋白表达质粒共转染293T细胞,组装出具有感染性的病毒粒子,然后在鸡胚中大量增殖,从而成功拯救r-JS/76病毒。通过基因测序、病毒滴度测定以及病毒在SPF鸡胚和MDCK细胞上的复制等方面的比较,拯救病毒r-JS/76与野生病毒JS/76具有相同的生物学特性;通过受体结合试验证明,拯救病毒和亲本病毒受体特性保持一致,2个病毒都已具有人源受体亲和特征。本研究中r-JS/76病毒反向遗传系统的建立,为后续在分子基础上进行基因替换或基因定点突变、深入研究JS/76 AIV 的变异机制以及对跨宿主感染能力搭建了平台,同时也为JS/76 AIV 的宿主适应性和新型疫苗研发奠定了基础。

