银杏内酯K调节缺氧诱导因子-1α通路抑制氧糖剥离再灌注诱导的神经血管单元损伤
周静怡,刘 秋,杨 昊,曹泽彧,周 军,许治良,曹 亮,王振中,肖 伟1,
(1.南京中医药大学,江苏 南京 210000;2.中药制药过程新技术国家重点实验室,3.现代中药创新集群与数字制药技术平台,4.江苏康缘药业股份有限公司,江苏 连云港 222001)
卒中是60岁以上老年人永久致残的第一大病因,可导致对侧偏瘫、感觉减退等不可逆性的神经功能障碍,由卒中继发的血管性痴呆也是老年人第二常见高发的痴呆症[1]。脑血管栓塞或血栓形成(以大脑中动脉高发)引起的缺血性脑卒中约占卒中的80%。目前,静脉溶栓和血管内血栓切除术以恢复血流供应是治疗缺血性脑卒中最有效的方法,但因治疗时间窗窄和禁忌症等问题临床受众范围小(约10%)[2]。近几十年来,许多研究致力于证明神经保护和神经恢复疗法可通过促进结构和功能恢复来抑制缺血性卒中损伤。然而,大多数药物针对的是缺血级联中的单个事件和单个神经元件,其局限性在一定程度上解释了临床应用转化失败的原因。因此,美国国家神经疾病和中风学会提出神经血管单元(neurovascular unit,NVU)的概念[3],除神经元损伤外,胶质类细胞特别是小胶质细胞介导的炎症反应和脑部血管内皮细胞损伤导致的血脑屏障破坏是卒中神经血管单元损伤重要方面,因此,多靶点多效应减少神经血管损伤是缺血性脑卒中神经保护及新药开发的方向之一。
目前,多项临床研究证实,急性缺血性脑卒中患者外周血中HIF-1α水平与患者脑梗死体积和神经损伤程度呈正相关,且可较好的预测卒中患者预后情况,HIF-1α血清水平具有作为分子标志物评价缺血性脑卒中患者神经功能损伤严重程度及预后的潜在可能性[4-5]。在缺氧条件下,HIF-1α降解受到抑制,并被转运到细胞核,与HIF-1β形成二聚体后与特定DNA结合区即缺氧反应元件(HREs)结合,调控下游相关基因转录。脑微血管内皮细胞是最早对缺血缺氧损伤做出反应的神经血管单位,其代偿反应与HIF-1α密切相关,研究表明,HIF-1α通路激活诱导其靶基因血管内皮生长因子(VEGF)、血红加氧素(HO)等蛋白表达,可促进血管新生并调节血管紧张度,以建立脑部侧支循环,对血脑屏障起到了保护作用[6]。与此同时,HIF-1α的靶基因还包括肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)等,在多种炎症相关疾病的发病机制中发挥重要作用,被认为是负责控制炎症相关信号事件的关键调节因子[7]。因此,HIF-1α具有缺血性脑损伤保护和促进损伤的双重“身份”,可能在不同细胞及不同病理阶段中可能扮演不同“角色”。
银杏叶提取物和银杏二萜内酯有效部位制剂已长期用于脑血管系统相关疾病的临床治疗,相关药物可通过拮抗PAF受体抑制血小板聚集预防二次血栓,同时可通过抑制兴奋性神经毒性、炎症反应、氧化损伤、代谢紊乱、细胞凋亡等多途径抗缺血性脑卒中损伤[8],具有抗血栓和神经保护的双重功能。其中,GK作为最强的PAF受体拮抗剂[8],其调节HIF-1α通路对小胶质细胞炎症反应及内皮细胞的作用,目前尚未见报道。本研究通过培养小鼠小胶质细胞系BV-2细胞和人脐静脉细胞融合细胞EA.hy926进行OGD/R造模模拟缺血性脑卒中损伤,确定GK抑制神经血管单元损伤药效及调节HIF-1α通路机制。
1 材料与方法
1.1 材料与仪器小鼠小胶质细胞BV-2细胞购自中国科学院昆明植物研究所;人脐静脉细胞融合细胞EA.hy926购自于上海中科院细胞库;DMEM(含HEPES)培养基、无糖DMEM培养基、FBS由美国Gibco公司提供;Mouse TNF-α Valukine ELISA Kit、Mouse IL-1β Valukine ELISA Kit、Mouse IL-6 Valukine ELISA Kit由美国R&D公司提供;CCK-8试剂盒由南京建成公司提供;LY294002由美国Sigma-aldrich公司提供;LDH试剂盒、磷酸化酶抑制剂由瑞士Roche公司提供;HIF-1α (D2U3T) Rabbit mAb (14179S)、Phospho-p44/42 MAPK (Erk1/2) (Thr202/Tyr204) (D13.14.4E) XP®Rabbit mAb (4370T)、p44/42 MAPK (Erk1/2) (137F5) Rabbit mAb (4695T)、Phospho-Akt (Thr308) (D25E6) XP®Rabbit mAb (13038T)、Akt (pan) (C67E7) Rabbit mAb (4691T)、HO-1 (E3F4S) Rabbit mAb (43966S)、Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb (9664T)、Cleaved Caspase-9 (Asp315) (D8I9E) Rabbit mAb (20750S)、Anti-rabbit IgG,HRP-linked Antibody (7074S)由美国CST公司提供;Anti-VEGFA antibody (ab1316)由英国abcam公司提供;三气培养箱由德国Binder公司提供;多模式微孔检测系统Flex Station 3由美国MD公司提供;GK(HPLC纯度≥99%)由江苏康缘药业中药制药过程新技术国家重点实验室制备。
1.2 方法
1.2.1细胞培养,OGD/R模型制备和给药 BV-2和EA.hy926细胞均培养于DMEM培养基(含体积分数为10% FBS)中,置于37 ℃,含5% CO2的细胞培养箱中培养,选取对数生长期细胞进行实验。
OGD/R模型制备及给药:将细胞传代种植于96孔培养板或细胞皿中,在细胞培养箱培养约24 h后进行造模。吸弃细胞上清,加入无FBS无糖DMEM培养基洗涤细胞,去除残留含糖培养基,然后加入适量无FBS无糖DMEM培养基后将细胞置于无氧(O2≤0.2%)三气培养箱中培养4 h进行缺糖缺氧造模。同时,正常组细胞吸弃培养基,加入无FBS含糖DMEM培养基洗涤细胞去除残留培养基,然后加入适量无FBS含糖DMEM培养基后将细胞置于正常培养箱中培养作为对照。4 h后,取出造模细胞给予无FBS含糖DMEM培养基和不同剂量的GK干预后将细胞置于正常培养箱中进行复糖复氧1、6或24 h。
1.2.2应用炎症因子试剂盒检测OGD/R损伤BV-2细胞上清中炎症因子分泌 将BV-2细胞用胰酶消化后按照2×104个/孔的密度种植于96孔培养板中,在细胞培养箱培养约24 h进行造模。细胞OGD损伤4 h后,加入0.18-25.00 μmol ·L-1GK并复糖复氧再灌注干预24 h。将细胞板1 000 r·min-1离心5 min后,收集细胞上清按照试剂盒说明检测上清中炎症因子分泌水平。
1.2.3应用CCK-8试剂盒检测OGD/R损伤EA.hy926细胞活力 将EA.hy926细胞用胰酶消化后按照1×105个/孔的密度种植于96孔培养板中,在细胞培养箱培养约24 h进行造模。细胞OGD损伤4 h后,加入6.25-25.00 μmol ·L-1GK并复糖复氧再灌注干预24 h。按照试剂盒说明,加入CCK-8试剂10 μL/孔,置于正常培养箱孵育培养1 h。用微孔板检测系统Flex Station 3读取各组细胞于450 nm处的吸光度值OD450 nm,然后计算细胞相对活力(The relative cell viability)/%=(各组OD450 nm值-背景OD450 nm值)/(正常组OD450 nm值-背景OD450 nm值)。
1.2.4应用LDH试剂盒检测OGD/R损伤EA.hy926细胞上清中LDH分泌 将EA.hy926细胞用胰酶消化后按照1×105个/孔的密度种植于96培养板中,在细胞培养箱培养约24 h进行造模。细胞OGD损伤4 h后,加入6.25-25.00 μmol ·L-1GK并复糖复氧再灌注干预24 h。按LDH试剂盒说明书操作,于492 nm处测定各组吸光度值,然后计算相对LDH释放量(The relative of LDH release)/%=(各组OD492 nm值-low control组OD492 nm值)/(正常组OD492 nm值-low control组OD492 nm值)。
1.2.5提取全蛋白进行Western blot检测GK给药后相关蛋白的变化 将细胞用胰酶消化后按照BV-2细胞1×106个/皿、EA.hy926细胞5×106个/皿的密度种植于细胞培养皿(直径为10 cm)中,在细胞培养箱培养约24 h进行造模。细胞OGD损伤4 h后,加入6.25-25.00 μmol ·L-1GK并复糖复氧再灌注干预1 h和6 h。BV-2细胞再灌注1 h提取蛋白进行Western blot检测通路上游Akt及Erk蛋白磷酸化水平和总蛋白含量,6 h时提取蛋白检测通路下游HIF-1α蛋白水平。EA.hy926细胞再灌注1 h提取蛋白检测通路上游Akt蛋白磷酸化水平和总蛋白含量,再灌注6 h提取蛋白检测通路下游HIF-1α、HO-1、VEGF、cleaved caspase-3及cleaved caspase-9蛋白水平。
应用PI3K抑制剂LY294002验证通路时,再灌注时加入12.50 μmol ·L-1GK和5-10 μmol ·L-1LY294002共同干预BV-2细胞1 h和6 h,然后提取蛋白进行Western blot 检测相应通路蛋白的变化。
Western blot具体方法为:收集各组细胞,加入蛋白裂解液提取总蛋白,应用BCA法测定样品蛋白浓度。经SDS-PAGE电泳后,电转蛋白至PVDF膜,TBS洗涤膜后,5% 脱脂奶粉室温封闭1-2 h,TBST洗涤膜,然后加入5% BSA抗体稀释液1 ∶1 000稀释的一抗,4 ℃孵育过夜,TBST洗涤膜3次,加入HRP标记的羊抗兔二抗(1 ∶3 000)溶液室温孵育2 h后洗涤膜,ECL法显影,应用Chemi Doc XRS系统拍照,采用Image Lab图像分析软件进行显影条带灰度值分析。

2 结果
2.1 GK抑制OGD/R损伤后BV-2细胞炎症因子的分泌GK给药氧糖剥离再灌注损伤的BV-2细胞24 h后应用试剂盒检测细胞上清炎症因子水平结果(Fig 1)显示,BV-2细胞OGD/R损伤后分泌至细胞上清中的IL-6和IL-1β炎症因子水平高于正常对照组,GK可减少IL-6和IL-1β炎症因子的分泌。同时,0.18-25.00 μmol ·L-1浓度梯度的GK可剂量依赖性抑制BV-2细胞TNF-α炎症因子的分泌,其IC50值为4.41 μmol ·L-1。
2.2 GK调节Akt/Erk/HIF-1α通路抑制BV-2细胞炎症损伤GK给药氧糖剥离再灌注损伤的BV-2细胞1 h和6 h后Western blot检测通路蛋白水平结果(Fig 2)显示,GK可剂量依赖性上调通路上游Akt蛋白磷酸化水平,增加Akt活性,6.25和12.50 μmol ·L-1浓度GK下调Erk蛋白磷酸化水平,同时12.50和25.00 μmol ·L-1浓度GK下调通路下游HIF-1α蛋白量。
2.3 LY294002干预后GK对Akt/Erk/HIF-1α通路蛋白调节作用下降LY294002和GK共同干预氧糖剥离再灌注损伤的BV-2细胞1 h和6 h后Western blot检测通路蛋白水平结果(Fig 3)显示,5-10 μmol ·L-1浓度梯度的LY294002干预后GK对p-Akt/Akt、p-Erk、Erk和下游HIF-1α蛋白调节作用下降,因此,GK可能通过作用于Akt下调Erk和HIF-1α活性抑制炎症因子分泌发挥抗炎作用。
2.4 GK提高OGD/R损伤后EA.hy926细胞活力和抑制LDH释放GK给药氧糖剥离再灌注损伤的EA.hy926细胞24 h后应用试剂盒检测细胞活力和上清LDH水平结果(Fig 4)显示,EA.hy926细胞OGD/R损伤后细胞活力下降,25.00 μmol ·L-1浓度的GK提高细胞活力;同时,GK抑制OGD/R损伤后细胞上清中LDH释放量,且呈剂量依赖性。

Fig 1 GK inhibited release of cytokines in BV-2 cells induced by OGD/R n=4)A:GK dose-dependently inhibited the release of TNF-α in BV-2 cells induced by OGD/R injury;B-C:GK inhibited the release of IL-6 and IL-1β in BV-2 cells induced by OGD/R injury.##P<0.01 vs Control group;*P<0.05,**P<0.01 vs OGD/R group

Fig 2 GK regulated activities of Akt/Erk and protein expression of HIF-1α##P<0.01 vs Control group;*P<0.05,**P<0.01 vs OGD/R group

Fig 3 LY294002 inhibited regulation of GK on Akt/Erk/HIF-1α activity#P<0.05 vs Control group;*P<0.05,**P<0.01 vs OGD/R group;△P<0.05,△△P<0.01 vs GK group
2.5 GK明显抑制OGD/R诱导的EA.hy926细胞凋亡GK给药氧糖剥离再灌注损伤的EA.hy926细胞6 h后Western blot检测cleaved caspase-3及cleaved caspase-9蛋白水平结果(Fig 5)显示,12.50和25.00 μmol ·L-1GK抑制其表达,即抑制OGD/R诱导的EA.hy926细胞凋亡。
2.6 GK调节Akt/HIF-1α/HO-1/VEGF通路抑制EA.hy926细胞损伤GK给药氧糖剥离再灌注损伤的EA.hy926细胞1 h和6 h后Western blot检测通路蛋白水平结果(Fig 6)显示,GK可剂量依赖性上调通路上游Akt激酶磷酸化,HIF-1α蛋白及下游HO-1及VEGF蛋白表达。因此,GK可能通过作用于Akt/HIF-1α/HO-1通路抑制EA.hy926细胞凋亡和Akt/HIF-1α/VEGF通路促进细胞生长发挥保护作用。
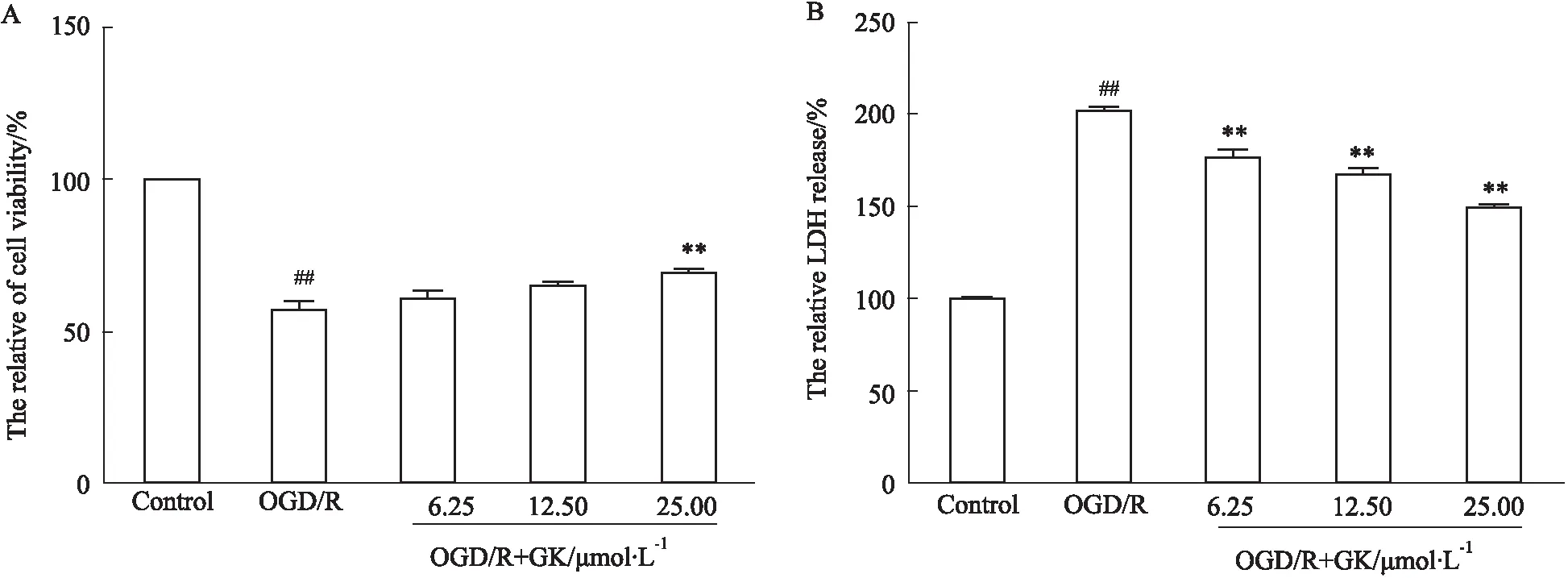
Fig 4 GK improved viability and inhibited release of LDH in EA.hy926 cell induced by OGD/R n=3)##P<0.01 vs Control group;**P<0.01 vs OGD/R group

Fig 5 GK inhibited activities of cleaved caspase-3/9 induced by OGD/R injury##P<0.01 vs Control group;**P<0.01 vs OGD/R group

Fig 6 GK regulated activities of Akt and protein expression of HIF-1α/HO-1/VEGF##P<0.01 vs Control group;*P<0.05,**P<0.01 vs OGD/R group
3 讨论
小胶质细胞是中枢神经系统常驻实质性巨噬细胞,发挥免疫监视作用。在缺血性脑卒中病理过程中,持续的血流减少诱导小胶质细胞极化为M1样表型(促炎型),释放TNF-α、IL-1β、IL-6等炎症因子,诱导炎症级联反应,导致血脑屏障及神经细胞损伤[9]。本研究表明,BV-2细胞OGD/R损伤后分泌至细胞上清中的TNF-α、IL-1β、IL-6等炎症因子水平显著升高,而GK干预可显著减少其分泌,抑制小胶质细胞介导的炎症反应。除诱导炎症反应外,小胶质细胞还与构成血脑屏障的微血管内皮细胞保持着持续的“双向通讯”,使其能够检测血脑屏障相关活动[10]。缺血性脑卒中脑微血管内皮细胞损伤引起血脑屏障通透性增加,导致白细胞外渗,并通过“双向通讯”进一步吸引并激活小胶质细胞,放大炎症过程[10]。本研究表明,GK提高内皮细胞活力,并抑制OGD/R损伤后细胞上清中LDH释放量,同时,cleaved caspase-3及cleaved caspase-9促凋亡蛋白表达被抑制,表明GK可能通过保护微血管内皮细胞,抑制血脑屏障损伤。
VEGF被认为是最有效的血管生成因子之一,缺氧情况下,HIF-1α与HIF-1β结合形成异二聚体并与VEGF的5′-末端增强子区域中的缺氧反应元件结合后,激活VEGF转录并使其表达增加[11],从而促进血管生成,增加血液及氧气的输送。HO-1代谢产物一氧化碳和胆红素是有效的抗凋亡剂和抗氧化剂,两者均显示出血管单元保护作用[12]。相关研究表明,HIF-1α对HO-1的上调可促进细胞存活和血管生成[13]。PI3K/Akt通路是调节体内蛋白质合成的主要信号传导途径,在葡萄糖代谢,细胞凋亡,细胞增殖,转录和细胞迁移、炎症等过程中起关键作用。活化的PI3K诱导Akt磷酸化,然后p-Akt进一步磷酸化酪氨酸和色氨酸的下游残基,从而激活了目标基因HIF-1α的转录[14]。本研究表明,GK可剂量依赖性上调Akt激酶磷酸化水平,激活HIF-1α基因转录,进而上调下游HO-1及VEGF蛋白表达。因此,GK可能通过作用于Akt/HIF-1α/VEGF通路促进细胞生长和Akt/HIF-1α/HO-1通路抑制细胞凋亡,保护微血管内皮细胞,抑制血脑屏障损伤。
不同类型细胞中的HIF-1α可与上下游多种蛋白组成不同的信号通路,调控细胞产生一系列对缺糖缺氧的代偿反应。除了保护血脑屏障,HIF-1α也是神经炎症的主要参与者,通过PKM2的核易位介导炎症相关的基因的表达[15]。HIF-1α除受Akt通路调控,Erk通路也可诱导的HIF-1α磷酸化,通过阻止其CRM1依赖性核输出,促进了核积累和转录活性[16]。抑制Erk通路下调HIF-1α表达,进而抑制M1小胶质细胞极化,发挥抗炎的神经保护作用[17]。因此,Akt及Erk通路均可影响HIF-1α表达,且两者并不独立,Akt可以直接抑制Erk通路。活化的Raf使MEK磷酸化,进而使Erk活化,而Raf的活性受到保守区2调节域上的磷酸化的负调控,Akt可以使保守区2域中Raf-1上Ser364或B-Raf上的Ser259和Ser428磷酸化,从而抑制Raf活性[18]。本研究表明,GK可增加Akt活性,并下调Erk蛋白磷酸化水平,从而下调HIF-1α蛋白表达,LY294002干预后GK相关调节作用减少,提示GK在小胶质细胞内可激活Akt下调Erk和HIF-1α活性抑制炎症因子分泌发挥抗炎作用。
综上所述,GK可通过调控神经血管单元中小胶质细胞内Akt/Erk/HIF-1α通路及血管内皮细胞内Akt/HIF-1α/HO-1/VEGF通路,实现对HIF-1α表达的不同调控趋势抑制脑缺血诱导的损伤。

