自噬与宫内发育迟缓
张顶梅,路小倩,黄鹤归,李 景,汪 晖
(1.武汉大学基础医学院药理学系,2.发育源性疾病湖北省重点实验室,湖北 武汉 430071;3.武汉市第一医院药学部,湖北 武汉 430022;4.武汉大学人民医院药学部,湖北 武汉 430060)
自噬(autophagy)是指真核细胞内特定物质成分被溶酶体降解的过程。作为真核生物中一种应对环境应激的高保守分解代谢途径,自噬可以驱动生物体发育所必需的细胞快速反应。生理条件下,生物体可通过基础自噬来维持蛋白质和细胞器的更新,以保证生命活动的正常供能及代谢。宫内发育迟缓(intrauterine growth restriction,IUGR)主要指发育时期胎儿生长受限。在胚胎发育过程中,多种因素可致IUGR发生,并使子代围产期发病率、死亡率以及成年后多种疾病易感性增加。自噬在胎儿发育中发挥着关键作用,自噬缺陷个体往往表现出发育迟缓。本文综述了自噬的分类及调节过程,并阐明自噬在IUGR发生中的作用及可能发生机制,为探寻IUGR胎源性疾病的早期防治策略提供理论依据。
1 自噬概述
自噬普遍存在于生物体的发育和老化过程中,多表现为真核细胞清除自身多余或受损的细胞器。生理状态下,细胞可通过自噬实现物质重新利用和自身不断更新,保证新陈代谢等基本生命活动的正常进行,此时自噬处于一个基础或低水平状态。应激状态下,如细胞缺少营养成分、缺血缺氧和生长因子浓度降低时,自噬通过降解细胞自身物质为细胞提供能量以保证其存活,此时被激活的自噬处于高水平状态。
1.1 自噬的分类自噬的发生可分为起始、囊泡核化、囊泡延伸、溶酶体融合和降解阶段。根据底物在细胞内被运送到溶酶体的方式不同,可将自噬分为分子伴侣介导的自噬、小自噬和大自噬。
分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)是指分子伴侣热休克同源蛋白(heat shock cognate protein 70,Hsc70)识别特定的KFERQ序列后,与底物蛋白结合形成分子伴侣-底物复合物从而使得底物蛋白降解。CMA只能降解结合到热休克蛋白上且含有KFERQ序列的底物蛋白,不能降解细胞器,且KFERQ这个五肽序列突变时会阻止其他大分子物质(如脂质和核酸)降解。
小自噬(microautophagy)是指液泡或溶酶体通过膜内陷直接摄取细胞质底物并使其降解,以供细胞再利用,其特点是膜直接变形包裹底物[1]。Dubouloz 等[2]发现,雷帕霉素靶蛋白(target of rapamycin,TOR)和EGO信号通路通过调节液泡膜的吸收与降解参与小自噬发生,从而补偿了雷帕霉素诱导的大自噬所引起的大量膜流入。这表明小自噬可部分减少大自噬的不利影响,对于保持细胞器的大小和膜组成至关重要。
大自噬(macroautophagy)即人们常说的自噬(在该文中的自噬均是指大自噬),其基本过程包括诱导、隔离膜生成与延伸、自噬体形成与成熟、与溶酶体融合、自噬溶酶体降解及小分子循环再利用等。
1.2 自噬的调控自噬的整个发生过程需要多个自噬相关蛋白参与调节(Fig 1)。自噬的起始步骤受unc-51样自噬激活激酶1(unc-51 like autophagy activating kinase 1,ULK1)-自噬相关基因13(autophagy related 13,Atg13)-RB1可诱导螺旋结构(RB1 inducible coiled-coil 1,FIP200)复合体调控。哺乳动物Atg6的同源物Beclin1从与凋亡调节蛋白Bcl-2的结合中解离,继而与空泡蛋白分类34(vacuolar protein sorting 34,vps34)、Atg14/Barkor和vps15/p150一起形成Ⅲ型磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)复合体;随后,受mTOR和腺苷酸活化蛋白激酶(5-AMP activated protein kinase,AMPK)调控活化的ULK复合体从胞质转移到内质网或其他位置,通过对Beclin1的Ser14位点进行磷酸化增加PI3K活性,从而诱导自噬发生。激活的PI3K促进隔离膜的核化并募集另外的Atg蛋白到自噬泡上,从而促进自噬体膜形成。
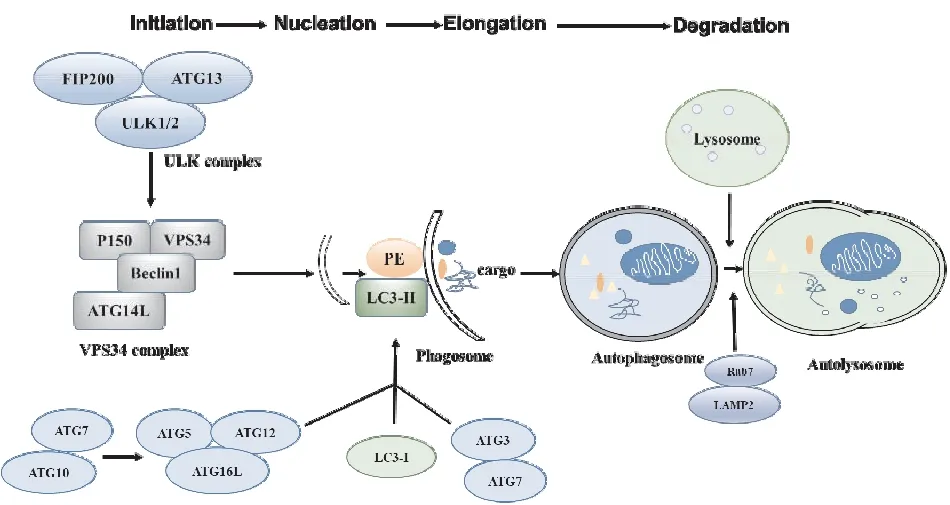
Fig 1 Process of autophagy and molecular regulatory mechanism
自噬体的延伸闭合需要Atg12-Atg5泛素化系统和LC3/Atg8-PE结合系统参与。在Atg12-Atg5泛素化系统中,Atg12被Atg7激活,进而转运到Atg10上,最终与Atg5结合形成Atg12-Atg5复合物;该复合物在Atg16L的寡聚化作用下形成Atg12-Atg5-Atg16复合体,构成自噬囊泡的双层膜骨架结构,促进微管相关蛋白3(microtubule associated protein 1 light chain 3,LC3)与磷脂酰乙醇胺(phosphoethanolamine,PE)结合。在LC3/Atg8-PE结合系统中,Atg4剪切LC3/Atg8,可溶性LC3-Ⅰ在Atg7和Atg3作用下结合到PE,形成脂溶性LC3(即LC3-Ⅱ蛋白),使自噬体闭合。所以,LC3-Ⅱ可以看作是自噬标志物,附着有LC3-Ⅱ的自噬体能通过LC3与p62的相互作用识别并捕获底物。
自噬的最后阶段是溶酶体与包含有需降解物质的自噬体融合形成自噬溶酶体,溶酶体中的水解酶完成对自噬底物的降解。很多蛋白参与调控自噬体-溶酶体融合、溶酶体生成、激活、更新与转运,如N-乙酰马来酰亚胺敏感因子附着蛋白(soluble N-ethylmaleimide-sensitive fusion protein attachment protein receptor,SNARE)、细胞骨架蛋白和小的GTP酶等。在自噬体-溶酶体融合过程中,自噬体和溶酶体的膜脂组分可影响其融合能力。
2 自噬与胚胎发育
在哺乳动物中,自噬贯穿了胚胎发育整个阶段,是胚胎发育的重要调节者。自噬相关基因缺失可致小鼠在胚胎早期或围产期代谢异常甚至死亡[3]。如在自噬基因Atg5敲除的小鼠中,其氨基酸代谢异常,主要表现为血浆和组织的氨基酸含量显著降低[4];小鼠卵细胞Atg5敲除后可致胚胎死亡;Beclin1敲除小鼠在胚胎6.5 d时出现发育延迟,未形成羊膜褶,在胚胎7.5 d时晶胚出现大量的细胞死亡且前羊膜管未闭合;Ambra1敲除小鼠在胚胎期d 10-14时死亡;Fip200缺失小鼠在胚胎期13.5-16.5 d由于心脏和肝脏发育异常而出现胚胎死亡;敲除Atg3、Atg5、Atg7、Atg9、Atg16L的小鼠虽不存在胚胎致死性,但在出生后1 d内均会死亡。以上研究表明,自噬在胚胎发育中发挥着至关重要的作用。
3 自噬与IUGR
IUGR是指胎儿体重低于同孕龄胎儿平均体质量的10%或低于同孕龄平均体质量的2个标准差。IUGR 胎儿为了维持其生存和发育,会改变自身的新陈代谢过程,将有限的能量进行重新分配,限制次要器官(如骨、肾、性腺)的能量消耗,以确保重要器官(如脑和肝)的发育,即胎儿变得“节俭”,这种改变会持续很长时间,甚至是永久性的。生物体的发育是一个受到精准调节的生物学过程,在此过程中,自噬可以通过降解折叠错误或多余的蛋白质和破损的细胞器来维持细胞的生存,通过降解部分蛋白质和细胞器,为细胞重建提供原料和能量,也可通过特异性降解某些蛋白质或细胞因子来改变细胞的组成,决定细胞分化、发育的方向等。如小鼠Atg9a 和Beclin1缺失均会导致胎鼠生长迟缓,说明胎儿自噬功能紊乱与IUGR密切相关。Tab 1列出了近年来自噬在IUGR发生中的相关研究。因此,自噬可能是IUGR胎儿为维持自身重要器官发育而限制次要器官发育的一个重要机制,以代偿IUGR胎儿生长。
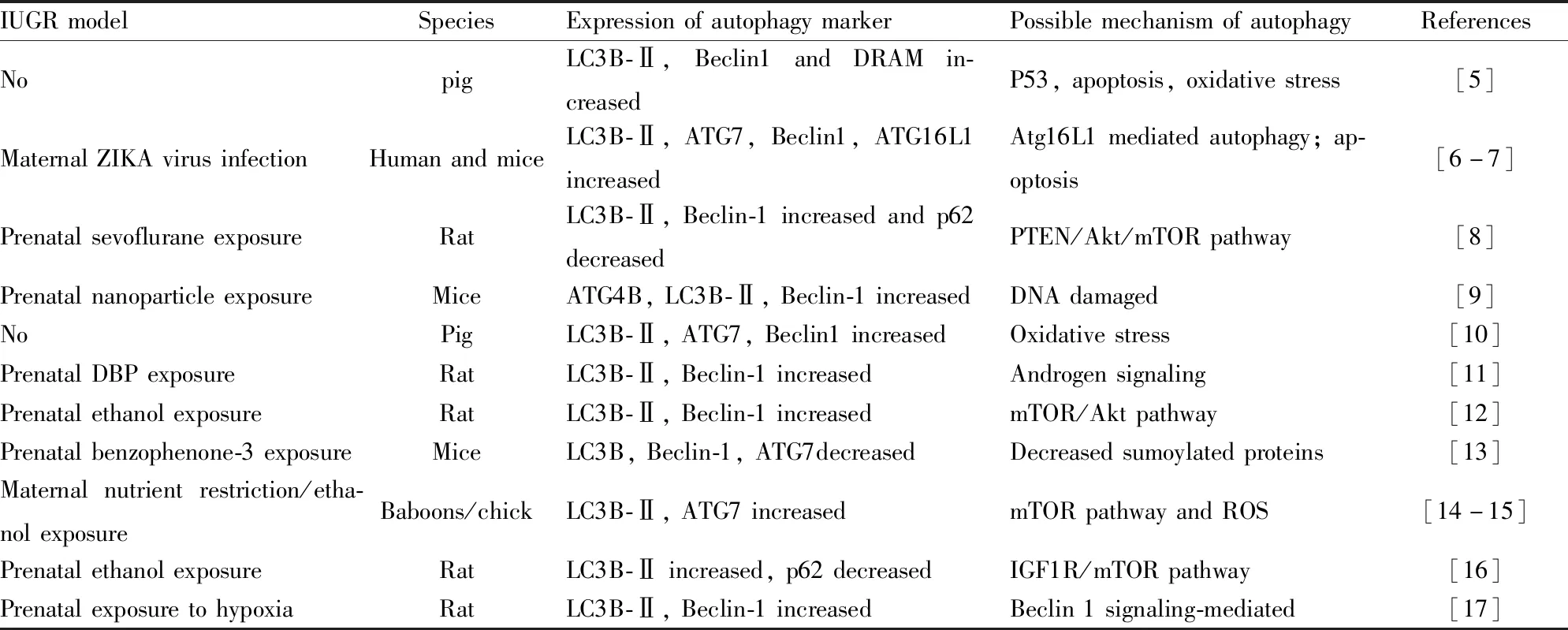
Tab 1 Studies on autophagy and intrauterine growth retardation fetus

Tab 2 Studies on autophagy and intrauterine growth retardation organ development
3.1 自噬与IUGR的胎盘发育胎盘作为妊娠期连接母体和胎儿的临时器官,可维持胎儿的正常发育。胎盘结构与功能异常是IUGR常见的诱因之一。自噬是胎盘维持正常生理功能的重要过程。1970年,Jones 和 Fox发现滋养层细胞中存在自噬,之后有研究表明妊娠晚期绒毛滋养细胞中也有自噬存在。自噬是胎盘屏障中对抗病原体的关键机制。近期研究表明,IUGR的胎盘中自噬水平比正常胎盘中的高,且IUGR胎盘中同时存在自噬与凋亡,提示自噬异常与胎盘发育迟缓密切相关[6]。在孕妇感染兹卡病毒(ZIKV)所致的IUGR胎盘中,自噬活性升高[18]。但敲除自噬关键基因Atg16L的小鼠胎盘中ZIKA病毒滴度明显降低,胎盘的损伤程度也低于野生型小鼠胎盘,提示自噬可能是病毒感染所致IUGR胎盘发育受损的一个治疗靶点[18]。p53信号通路作为上游调控因子可负向调节自噬,在胎盘滋养层细胞分化过程中,p53基因和蛋白水平下降,自噬通量增加[19]。此外,IUGR胎盘中自噬相关基因出现甲基化改变,且升高的自噬水平与凋亡存在相互作用[6]。在羊IUGR胎盘中,mTOR信号参与了内质网应激和自噬激活[20]。以上研究表明,自噬可在多个信号分子的调控下参与IUGR胎盘的发育。
3.2 自噬与IUGR的多器官发育自噬参与多器官的早期发育,与多器官疾病的发生发展密切相关。如自噬异常可致IUGR仔猪的肝脏功能改变[10]、IUGR大鼠肾上腺发育不良及脑发育异常等[16]。Tab 2总结了自噬在IUGR个体多器官发育中的具体作用及其可能发生机制,这些研究表明了自噬在IUGR子代多脏器发育中发挥着重要作用。
3.3 自噬与细胞增殖与分化自噬参与多种干细胞的自我更新、定向分化和凋亡衰老。近期研究发现,肌肉特异性敲除自噬基因Atg7导致新生小鼠体型小、肌肉质量降低、肌肉中卫星细胞的增殖和分化受损,从而导致新生小鼠肌生成障碍,表明自噬对肌肉细胞的分化至关重要[22]。海胆的发育过程中自噬水平增加,而抑制自噬则导致卵子发生过程中细胞凋亡增加,影响海胆的发育[23]。此外,在Ambra1缺失小鼠神经系统发育早期,自噬缺失导致细胞过度增殖,并且神经细胞凋亡增加。在ZIKV感染的胎儿神经细胞中,AKT-mTOR信号抑制可使自噬上调,同时使神经细胞增殖与分化受损[24]。自噬也可以减少骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)分化过程中ROS的产生并促进BMSC向成骨细胞分化[25]。这提示自噬与IUGR胎儿神经细胞的增殖和分化存在关联,但具体作用机制需进一步探索。
4 研究展望
综上,自噬基因表达异常和自噬功能改变可通过调控细胞增殖和分化,影响胎盘及其他脏器发育,从而导致子代IUGR的发生。但在IUGR相关胎源性疾病中,自噬的具体生理过程及病理发生机制仍未明确。虽大量研究发现自噬与IUGR关系密切,但在孕期不良环境暴露(如尼古丁、地塞米松和咖啡因[26])所致的IUGR模型下,自噬在IUGR各脏器发育异常中的作用、是否存在宫内编程机制以及是否介导子代成年后的疾病易感等问题有待进一步探究。本综述可为探寻IUGR相关胎源性疾病的防治靶点提供新理论和新思路。

