橙皮苷对高脂高糖诱导胰岛 β 细胞损伤的保护作用
张芸绮,蔺晓菁,王妙然,李 月,樊 雷,侯 毅,肖晓秋
(重庆医科大学 1.附属第一医院重大代谢性疾病转化医学重点实验室、2.药学院、3.实验教学管理中心中医药实验室,重庆 400016)
糖尿病是由遗传与环境因素引起的代谢紊乱,主要体现为胰岛素不敏感、缺乏以及相关功能受损。由于这种疾病的高流行率以及相关的残疾和死亡率,它已成为全世界严重的健康问题之一[1]。流行病学结果调查显示,中国成年人中糖尿病的患病率从2007年的9.7%增长至2017年的11.2%,患者总数估计为1.298亿人[2],无疑给社会和经济发展带来了沉重负担。病因上,世卫组织将糖尿病归类为1型糖尿病(type 1 diabetes mellitus,T1DM)、2型糖尿病(type 2 diabetes mellitus,T2DM)、妊娠期糖尿病和其他特定类型的糖尿病[3]。T1DM是一种自身免疫系统疾病[4],特征为淋巴细胞介导破坏胰岛β细胞,导致胰岛素绝对分泌不足[5]。T2DM是一种受年龄、怀孕和肥胖等生活方式因素影响的最常见的糖尿病,越来越多的证据表明,T2DM的胰岛素释放同样受损[6]。胰岛的大小、数目和功能是胰岛β细胞分泌胰岛素的关键,胰岛β细胞受损或凋亡会显著降低胰岛素分泌水平,导致糖尿病的发生发展[7]。由此可知,保护胰岛β细胞功能,减少其凋亡是防治糖尿病的有效手段。
橙皮苷(hesperidin,HSD)最初由法国化学家Lebreton从柑橘皮中分离出来[8],是一种黄酮类化合物。黄酮类化合物在植物体内有着广泛的分布,主要以游离状态或糖苷的形式存在,具有一定的抗氧化、抗癌以及抗炎等作用[9]。研究表明HSD除通过抗氧化、抗炎等作用间接改善糖尿病外,还可能具有保护大鼠胰岛β细胞和改善其功能的潜力[10]。但目前尚无相关文献明确HSD对胰岛β细胞的体外保护作用及其机制,因此本研究将进一步采用体外培养探讨HSD对胰岛β细胞活性及胰岛素分泌功能的影响,为HSD的进一步开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验试剂 橙皮苷(纯度≥98%)由重庆医科大学侯毅老师惠赠。RPMI 1640 培养基(货号:C11875500BT)、胎牛血清(货号:10099141)购自美国Gibco公司,Hoechst 33258 溶液(货号:C0003)、BCA 蛋白浓度测定试剂盒(货号:P0009)购自碧云天公司;棕榈酸(palmitic acid,PA)购自美国Sigma公司(货号:P0500);CCK-8试剂盒(货号:CK04)购自日本同仁化学研究所,逆转录试剂盒(货号:RR047A)、SYBR-Green荧光定量PCR试剂(货号:RR820A)购自TaKaRa公司;小鼠胰岛素ELISA试剂盒(货号:CSB-E05071m)购自武汉华美公司;ECL发光液(货号:k12045-D10)购自美国advansta公司。
1.1.2实验仪器 细胞培养箱、酶标仪购自美国Thermo公司;正置荧光显微镜购自德国Leica公司;定量PCR仪、电泳仪购自美国Bio-Rad公司;凝胶/发光图像分析系统购自法国Vilber Lourmat公司。
1.2 方法
1.2.1细胞培养 小鼠胰岛β细胞株MIN6细胞由本实验室保存。MIN6细胞在RPMI 1640完全培养基(含10%胎牛血清与1%青霉素-链霉素),5% CO2、37 ℃条件下培养,细胞贴壁达80%-90%后传代。
1.2.2原代胰岛的分离与提取 使用颈椎脱臼法处死小鼠,用体积分数为75的酒精浸泡消毒后迅速打开腹腔找到胆总管,用止血钳夹闭胆总管汇入十二指肠的入口处,分离胆总管,经胆总管近端缓慢注入0.65 g·L-1胶原酶P ( Krebs缓冲液溶解,无菌过滤) 溶液2 mL,胰腺充分膨胀后,剪下胰腺,放入含Krebs胶原酶的离心管中,37 ℃水浴消化15 min,充分振摇,添加Krebs缓冲液终止消化,50目滤网过滤处理后,按照1.4×103r·min-1转速离心15 s,弃上清,使用Krebs缓冲液重悬,重复3次,在显微镜下手工挑取胰岛,置于RPIM 1640完全培养基中。挑取后的胰岛放入细胞培养箱中进行培养。
1.2.3CCK-8法检测细胞活性 将MIN6细胞以 6×103/孔接种于96孔细胞培养板中,37 ℃、5% CO2条件下培养24 h贴壁,分别用含0、10、20、40、80、160 μmol·L-1浓度HSD的无血清培养基预孵育4 h后,换用含33.3 mmol·L-1葡萄糖和0.25 mmol·L-1PA的高糖高脂培养基培养24 h,并设无细胞空白组以及5.5 mmol·L-1正常糖组。每孔加入新鲜无血清培养基90 μL及10 μL CCK-8试剂,培养箱培养2 h,用酶标仪检测各孔450 nm波长处的吸光度(A)值,实验重复3次。细胞存活率/%=(A实验组 - A空白组)/(A对照组 - A空白组)×100%。
1.2.4细胞分组及处理 将MIN6细胞以2×105/孔接种于12孔细胞培养板。贴壁后处理细胞,分为4组:① 5.5 mmol·L-1正常糖对照组(Control组);②高脂高糖(33.3 mmol·L-1葡萄糖+0.25 mmol·L-1PA)实验组(HFHG组);③ 20 μmol·L-1HSD预处理4 h+HFHG处理24 h组;④ 40 μmol·L-1HSD预处理4 h+HFHG处理24 h组。
1.2.5Hoechst 33258检测细胞凋亡 细胞2×105/孔接种于放有细胞爬片的12孔板中,贴壁后对细胞分组进行处理,到时间后,将培养基去除,使用PBS清洗3次,每次3 min。在孔中添加0.5 mL 4%多聚甲醛溶液,固定时间为10 min,PBS洗涤。每孔加0.5 mL Hoechst 33258染色液,避光染色15 min,PBS洗涤,加入抗荧光淬灭封片液封片,正置荧光显微镜检测各组细胞核内染色质固缩情况。
1.2.6Western blot 提取各组细胞总蛋白,BCA法测定浓度。依照20 μg上样量,明确上样体积,使用SDS-PAGE凝胶电泳方法,湿法转入PVDF膜,封闭2 h,TBST洗膜3次,每次10 min。4 ℃孵育一抗,低速摇床上过夜。次日TBST洗膜,加HRP标记的山羊抗鼠或山羊抗兔二抗,室温孵育1 h,TBST洗膜3次,ECL化学发光法曝光。使用Fusion FX Spectra system自带图像分析软件分析图像。
1.2.7实时荧光定量PCR TRIzol法提取各组细胞总RNA,Nanodrop 2000检测浓度,逆转录试剂盒将RNA逆转录成cDNA后进行RT-PCR。反应条件:95 ℃预变性10 min,95 ℃变性4 s,58 ℃退火10 s,65 ℃延伸5 s,共40个循环。PCR 扩增目的基因上、下游引物序列见 Tab 1。计算2-△△Ct值,以GAPDH为内参,分析目的RNA表达水平。
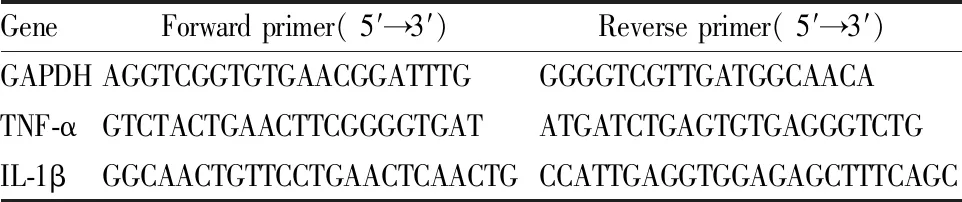
Tab 1 Primer sequence for real-time PCR
1.2.8葡萄糖刺激的胰岛素分泌 挑选大小相近的胰岛各20个置于12孔板内,各组胰岛处理同MIN6细胞,分组处理后,在含有2.8 mmol·L-1葡萄糖的Krebs-Ringer碳酸氢盐缓冲液(KRB)中洗涤并预孵育30 min;再孵育2 h,将上清液收集,-20 ℃环境下保存;之后在16.7 mmol·L-1葡萄糖的KRB中再孵育2 h,收集上清,-20 ℃保存。最后将各组胰岛总蛋白提取出来,测定浓度;ELISA检测上清液中胰岛素含量。

2 结果
2.1 HSD减少HFHG对MIN6细胞诱导的凋亡HSD处理24 h对MIN6细胞活力影响的结果表明,0-160 μmol·L-1浓度的HSD均不会损害细胞活性( Fig 1A)。不同浓度的HSD预处理4 h后用HFHG处理24 h的实验结果表明当HSD浓度为20-80 μmol·L-1时细胞存活率高于HFHG实验组,选用20、40 μmol·L-1浓度的HSD用于之后的实验(P<0.05,Fig 1B)。
2.2 Hoechst 33258 染色观察MIN6细胞核形态染色后如Fig 2所示,Control组细胞核内染色质分布均匀,20、40 μmol·L-1HSD预处理4 h+HFHG处理24 h组与单独HFHG组比,细胞核呈致密浓染,细胞减少(如白色箭头所示)。由此可知,HSD预处理后能显著减少HFHG诱导的细胞凋亡。
2.3 HSD对凋亡相关蛋白表达的影响观察20、40 μmol·L-1HSD预处理4 h + HFHG处理24 h组与单独HFHG处理组对凋亡相关蛋白表达的影响。与Control组相比,HFHG组Bcl-2/Bax比值降低(P<0.05,Fig 3),与HFHG组比,HSD预处理后Bcl-2/Bax比值上调(P<0.01,Fig 3)。
2.4 HSD对炎症因子表达的影响与Control组相比,HFHG组IL-1β、TNF-α mRNA表达均显著增加,与HFHG组相比,HSD预处理+HFHG组IL-1β mRNA 的表达水平有下降趋势,TNF-α mRNA的表达下降(P<0.05,Fig 4)。
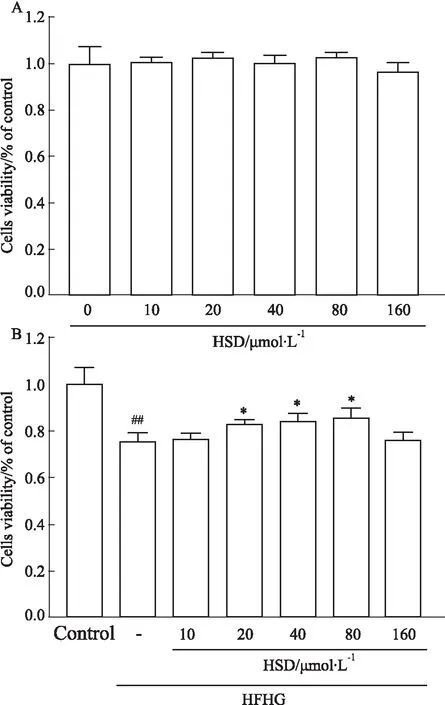
Fig 1 Effects of different concentrations of HSD on MIN6 cell viability and HFHG- induced apoptosis reduced by HSD n=4)##P<0.01 vs Control group;*P<0.05 vs HFHG group

Fig 2 Effects of HFHG treatment for 24 h after HSD pretreatment for 4 h and HFHG treatment for 24 h on nuclear morphology of MIN6 cells (×200)A:Control;B:HFHG;C:20 μmol·L-1 HSD+HFHG;D:40 μmol·L-1 HSD+HFHG
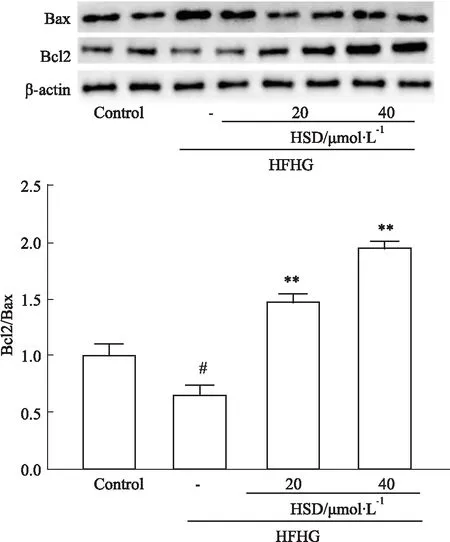
Fig 3 Effects of HFHG alone and pretreatment with HSD on expression of apoptosis-related proteins n=4)#P<0.05 vs Control;**P<0.01 vs HFHG

Fig 4 Effects of HSD on activities of IL-1β,TNF-α in MIN6 cells treated with HFHG n=3)#P<0.05,##P<0.01 vs Control group;*P<0.05 vs HFHG group
2.5 HSD对胰岛素分泌的影响由于MIN6细胞的胰岛素分泌能力较弱,因此提取原代胰岛并进行相同的分组处理后检测胰岛素分泌。结果显示,与Control组相比,高糖刺激下HFHG组胰岛的胰岛素分泌作用减弱,而HSD一定程度上恢复了胰岛素分泌作用(P<0.05或P<0.01,Fig 5)。
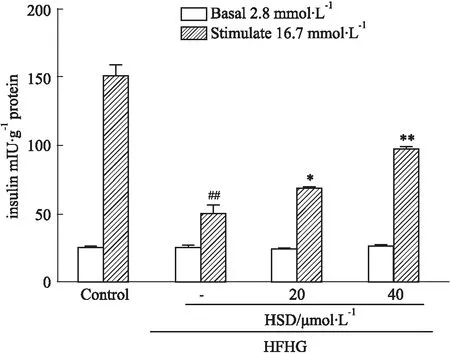
Fig 5 Effects of HSD on glucose-stimulated insulin secretion of islets n=3)##P<0.01 vs Control group;*P<0.05,**P<0.01 vs HFHG group
3 讨论
糖尿病是一个日益增长的公共卫生问题,不同类型糖尿病病理生理学的一个共同特征是β细胞的凋亡和/或β细胞功能的损害[11]。细胞凋亡信号传导途径主要分为内源性和外源性途径,均与糖尿病发生过程中胰岛β细胞的凋亡有关[12]。内源性途径通过不同类型的细胞应激(如缺氧或氧化应激)激活,其中包括Bcl-2家族的参与[13]。Bcl-2家族分为3类:第一类抑制细胞凋亡,包括Bcl-2等;第二类促进细胞凋亡,包括Bax等;第三类抑制用作细胞应激传感器的抗凋亡蛋白来促进凋亡信号,包括Bad等[14]。外源性途径通过如TNF-α、IL-1β等细胞因子[15-16]与胰岛β细胞表面一些表达凋亡信号的受体结合,激活细胞内信号通路诱导凋亡。β细胞功能的损害主要表现在机体内胰岛素分泌的减少,而恢复β细胞分泌的手段主要包含以下4种:防止其凋亡/功能障碍、促进增殖、改善去分化、诱导细胞转分化为可以分泌胰岛素的β样细胞[11]。
本研究从预防β细胞凋亡、促进其增殖入手,探究HSD对小鼠胰岛 β细胞株MIN6细胞活性的影响。鉴于长期暴露于高水平的葡萄糖和游离脂肪酸会导致β细胞功能障碍,并诱导β细胞凋亡,实验选用高糖高脂培养刺激胰岛 β细胞建立β细胞受损的体外模型。结果表明,高糖高脂处理后,MIN6细胞凋亡显著增加,而HSD预处理后细胞凋亡显著减少。同时,HSD预处理后增加了MIN6细胞中抗凋亡蛋白Bcl-2的表达;抑制了促凋亡蛋白Bax,炎症因子TNF-α、IL-1β的表达。最后通过原代胰岛的葡萄糖刺激胰岛素分泌试验证明HSD预处理改善了胰岛素分泌功能。
综上所述,高糖高脂环境能够使MIN6细胞活性降低、凋亡增加,胰岛的胰岛素分泌功能障碍,而HSD预处理可增加该环境下Min6细胞活性、抑制其凋亡,改善胰岛的胰岛素分泌功能。因此,HSD预处理对胰岛β细胞的保护作用可能是通过抑制细胞凋亡信号传导途径、改善胰岛素分泌作用来实现的。

